胶体金免疫层析法检测食品中天然存在的危害物质的研究进展
徐超莲,赖卫华*,刘道峰
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
胶体金免疫层析法检测食品中天然存在的危害物质的研究进展
徐超莲,赖卫华*,刘道峰
(南昌大学 食品科学与技术国家重点实验室,江西 南昌 330047)
胶体金免疫层析法是一种简易、快速的检测方法,现已广泛应用于食品安全检测、生物医学诊断等许多领域。食品中的有害成分可分为人为添加和天然存在的两部分。本文综述了胶体金免疫层析法在食品中天然存在的危害物质快速检测中的应用,并对其发展前景进行展望。
胶体金;免疫层析;食品安全;天然危害物质
目前,以胶体金为示踪物应用于抗原抗体反应的免疫层析方法已广泛地应用于食品安全的快速检测。胶体金是由氯金酸在还原剂如柠檬酸三钠、抗坏血酸、柠檬酸钠、鞣酸等的作用下聚合成一定大小的金颗粒,并在静电作用下形成稳定的胶体状态[1]。因为胶体金具有肉眼可见的红色,当抗原与抗体结合部位的金颗粒达到一定数量时,便可观察到红色条带,通过红色条带即可判断检测结果。通常实际检测根据具体情况可以采用两种不同的方式:双抗夹心法和竞争法。以胶体金为免疫标记物方法的优点是操作简单、价格低廉、成本较低、特异性和灵敏度较高、肉眼易判断、检测时间短,特别适合广大基层和大批量现场检测。
胶体金独特的理化特性及作为标记物的独特优点,使其在食品安全检测、生物医学诊断等各个领域得到了广泛地应用,且胶体金试纸条的产业化已规模化且产品日益成熟。近年来,食品生产的工业化和工业发展带来的污染使得因此而起的食品安全重大事件引起国际社会的广泛关注。然而,除了人工合成的化学物质的非法添加等造成的污染外,食品中天然存在的危害物质:食源性致病菌、生物毒素、过敏原及环境中的重金属,更是引起食品安全问题频繁发生的重要因素。本文从胶体金免疫层析法在食品中天然存在的危害物质快速检测中的研究应用展开综述。
1 胶体金免疫层析法快速检测食源性致病菌
食源性致病菌主要有沙门氏菌、大肠杆菌O157∶H7、志贺菌、单增李斯特菌等。纵观全球各地,由食源性致病菌引起的食物中毒已经成为当前世界上最突出的食品安全问题。据报道,全球每年发生40~60亿例食源性疾病,发展中国家每年约有180万人口死于食源性疾病,即使是在发达国家,每年亦有10%以上的人群感染食源性疾病[2]。1996年日本发生了世界上规模最大、涉及6 300名学生的大肠杆菌O157∶H7食物中毒,死亡2人[3],全球已有6大洲30多个国家报道有该菌所致的感染流行[4]。单增李斯特氏菌其主要的传染源是动物性食品,据美国疾病预防控制中心(Centers for Disease Control,CDC)报道,美国每年约有600~2 000例病人,死亡约450人[5]。2010年日本4 090个养鸡场中抽取203个调查,48个显示大气浮尘感染沙门氏菌,感染率达23.6%[6]。最近一项食源性疾病主动监测显示,我国平均6个半人中就有1人次罹患食源性疾病。食源性疾病已成为我国头号食品安全问题[7]。目前,检测食源性致病菌的主要方法之一是免疫层析法,其中基于双抗夹心原理的胶体金免疫层析法在检测食源性致病菌领域的发展已比较成熟,特别是针对于大肠杆菌O157、沙门氏菌、单增李斯特菌、金黄色葡萄球菌等致病菌已有较多的研究报道,具体见表1。
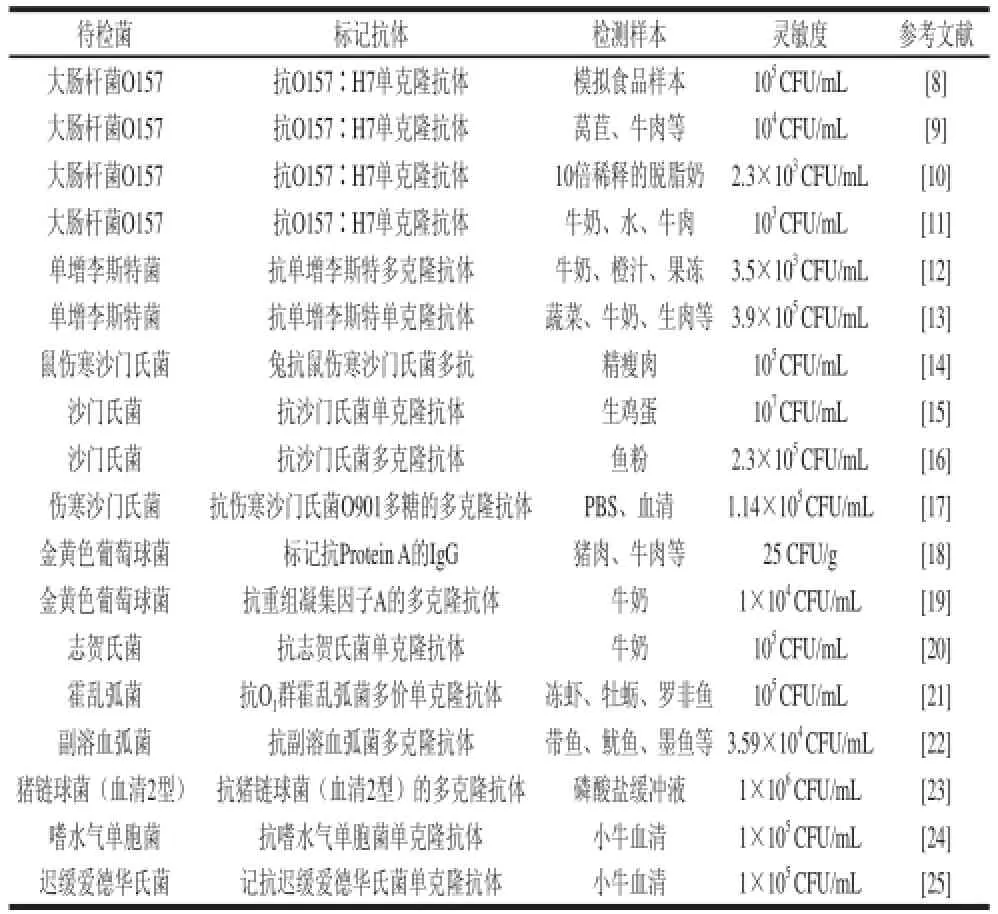
表1 胶体金免疫层析法在食源性致病菌的检测应用进展Table 1 Application of colloidal gold immunochromatography assay in the detection of foodborne pathogens
从近几年的文献报道看,国内外关于胶体金免疫层析法检测食源性致病菌在大肠杆菌O157、沙门氏菌、单增李斯特菌的研究应用较多。其胶体金免疫层析试纸条采用的标记抗体主要有单克隆抗体和多克隆抗体。单克隆抗体虽然制备周期较长、价格较贵,但在检测食源性致病菌时其灵敏度比多克隆抗体稍高[26],如黄岭芳等[9]采用单克隆抗体为标记抗体制备的大肠杆菌O157的胶体金免疫层析试纸条,检测限为104CFU/mL,比采用多克隆抗体的胶体金免疫层析试纸条低100倍[27]。可见,采用在纯度相当的条件下采用亲和力强的单克隆抗体可以提高食源性致病菌的检测灵敏度和特异性。此外,有些研究还在此基础上,结合了免疫磁珠富集技术或生物素-链霉亲和素系统,提高其检测灵敏度:如Qi Hui等[11]用免疫层析法结合免疫磁珠富集技术快速检测大肠杆菌O157,灵敏度为103CFU/mL,比直接用免疫层析法检测灵敏度提高了2个数量级[8];Zhao Xihong等[10]基于生物素-链霉亲和素系统制备胶体金免疫层析试纸条检测大肠杆菌O157,检测食品中10倍稀释的O157,最低限度为2.3×103CFU/mL,经富集后检测限度达2.3 CFU/mL。随着检测能力不断提高,胶体金免疫层析试纸条也趋向定量检测和多元检测发展。例如,谢士嘉等[12]建立了胶体金试纸条-胶体金生物传感器有机整合的胶体金定量检测系统检测单增李斯特菌,在人为肉眼判断3.5×104CFU/mL的基础上提高了检测的敏感性,定量检测灵敏度为3.5×103CFU/mL,线性范围3.5×103~3.5×108CFU/mL,回收率在99%~101.7%之间;王卫杰[28]建立了同时检测E.coli O157∶H7和Salmonella Tyhpimurium的免疫层析技术,同时检测时检测限为105CFU/mL,可以提高检测效率,降低检测成本,对需要多个指标联检物质的检测具有很大的应用价值[29]。但目前,关于食源性致病菌多元检测的文献报道较少,可以借鉴其他物质多元检测的思路,研制出食源性致病菌联检的胶体金试纸条。
2 胶体金免疫层析法快速检测生物毒素
生物毒素也是食品安全检测中不可忽视的问题,它主要包括贝类毒素和真菌毒素。
2.1 贝类毒素
贝类毒素属于海洋天然有机物,其形成与海洋有毒藻类赤潮密切相关。有毒藻类产生的毒素通过食物链进入贝类体内,形成贝类毒素,而人们食用含贝类毒素的贝类产品会造成食物中毒。常见的贝类毒素有麻痹性贝毒、神经性贝毒、记忆缺失性贝毒和腹泻性贝毒[30]。自1967年以来,我国共发生有记载的贝类中毒事件47起,29人死亡,604人中毒后需入院治疗,中毒事件主要发生在我国的福建、台湾、浙江、广东沿海[31]。近几年来,我国贝类中毒事件频繁发生,贝类毒素已经成为环境和食品安全的严重问题,寻求一种快速筛查海产品中贝类毒素的方法尤为迫切。目前国内外已有应用胶体金技术检测海水或海产品中甲藻毒素、麻痹性贝毒、腹泻性贝毒等方面的报道,其检测原理主要为竞争抑制免疫反应。
Zhou Yu等[32-33]建立一步免疫层析法快速检测水产品样本中的双鞭甲藻毒素(PbTxs)和河豚鱼组织中的河豚毒素,灵敏度分别为20 ng/mL和40 ng/mL,适于现场快速检测。高利利等[34]制备软骨藻酸(domoic acid,DA)胶体金免疫层析快速检测试纸条,能快速检测贝类食品中软骨藻含量,检测灵敏度为20 ng/mL。Liu Renyan等[35]研制了快速检测软海绵酸(okadaic acid,OA)的胶体金试纸条,其检出限为12 ng/mL。此外,Lu Shiying等[36]也建立了一种现场快速筛查软海绵酸的胶体金试纸条,定性检测限为150 μg/kg,其结果与应用高效液相色谱法-质谱联用仪/质谱联用仪(high performance liquid chromatography-mass spectrometry/mass spectrometry,HPLC-MS/MS)保持一致。由于高纯度的毒素制备困难,价格昂贵,将毒素与载体蛋白偶联技术难度较大,国内外相关研究起步较晚,水平较滞后,受抗贝毒有毒成分的单克隆抗体的制备水平的限制,胶体金免疫层析法检测贝毒的研究还有很大的提升空间。
2.2 真菌毒素
真菌毒素是一些真菌在生长过程中所产生的次级代谢产物,几乎广泛地存在于所有的食品和饲料中,危害人类和动物的健康安全。目前研究较多、对人类危害较大的真菌毒素包括黄曲霉毒素(主要是AFB1和AFM1)、赭曲霉毒素A(ochratoxin A,OTA)、伏马菌素(fumonisin,FB)、玉米赤霉烯酮(zearalenone,ZEN)、脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)等,具有毒性强、污染频率高的特点,可致癌、致畸、致突变。据报道[37],全球每年由于霉变、污染真菌毒素引起的农产品和工业原料的损失达数百亿。据联合国粮食及农业组织统计,全世界每年约有25%的谷物受真菌毒素污染。鉴于真菌毒素给粮油食品产业带来的巨大损失,相关检测技术已展开了广泛的研究,尤其是适于大批量现场快速筛查的胶体金免疫层析技术。目前,胶体金免疫层析法已广泛应用于真菌毒素的检测中。由于真菌毒素是小分子化合物,研制的免疫层析试纸条均采用的是竞争免疫层析原理,具体见表2。

表2 胶体金免疫层析法在真菌毒素检测中的应用进展Table 2 Application of colloidal gold immunochromatography assay in the detection of mycotoxins
真菌毒素不仅对人和动物具有多种特定器官的毒性及致癌性,而且价格昂贵,研究一种能够替代真菌毒素的标准品的检测元件可能是未来真菌毒素检测发展的一个趋势。目前,针对真菌毒素半抗原的研究包括抗原模拟表位肽和抗独特型抗体[55]。Lai Weihua等[46]将噬菌体展示的OTA模拟表位应用于胶体金免疫层析试纸条,建立了一种安全快速的OTA的检测方法,检测限为10 ng/mL,该方法解决了真菌毒素标品来源受限的问题,为其他真菌毒素的无毒检测提供了新的思路。此外,应用胶体金试纸条实现2种甚至是多种真菌毒素的同时检测也将是一个有价值的研究热点。近一两年来,国内外关于这方面的研究报道已比较广泛。Wang Yuankai等[52]建立了同时检测ZEN和FB1的胶体金免疫层析法,实现了食品样本的多种毒素的联检,为其他食品有害物质的多元检测提供了参考方法。
3 胶体金免疫层析法快速检测环境中存在的重金属
重金属是相对密度在5以上的金属,对环境造成污染的重金属主要是指汞、镉、铅、铬以及类金属砷等生物毒性显著的重金属元素。土壤、水体等环境中重金属污染可通过食物链富集而对食品安全构成威胁,在人体内积累达到一定程度,会造成慢性中毒。迄今为止,我国发生了多起重金属污染事件,因此国家出台的“十二五”规划提出对饮用水安全、重点流域水污染防治、重金属治理等一系列措施,重金属含量快速检测的需要越来越迫切。目前,国内外胶体金免疫层析法在检测重金属方面的应用比较少,只有在检测水样中的镉、铬、铜和铅有关报道,如表3所示。
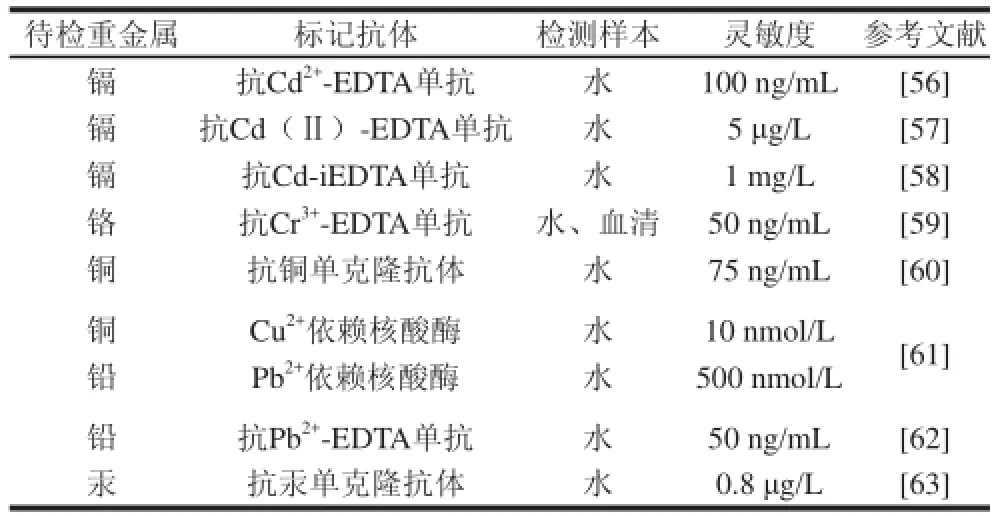
表3 胶体金免疫层析法在环境中重金属的检测应用进展Table 3 Application of colloidal gold immunochromatography assay in the detection heavy metals
胶体金免疫层析法在检测重金属中标记抗体基本上采用都是抗重金属-EDTA螯合物单克隆抗体,如刘斌等[57]建立的快速检测环境水样中重金属镉残留的胶体金免疫层析法,灵敏度可达5 μg/L。而黄婧[61]在国内外首次提出了将重金属依赖的核酸酶和胶体金免疫层析技术结合的创新思想,并研制了检测铜和铅的胶体金传感器,灵敏度为10 nmol/L和500 nmol/L,对环境中重金属离子的检测具有重要的借鉴研究意义。
4 胶体金免疫层析法快速检测过敏原
全球性转基因食品的侵袭和过敏症发病率的逐年增高,导致食品过敏已成为重要的食品安全问题。食物中过敏原主要分为植物性过敏原、动物性过敏原、转基因食物过敏原。日常生活中常见的引起过敏反应的食物有:花生、牛奶、海产品类、蛋类。由食品或食品成分引起的危害健康的过敏反应会发生在大约1%~3%的人群和4%~6%的小孩中[64]。而且发达国家超过20%的人受过敏性疾病的困扰,因此对进口食品过敏原标签的要求越来越严格[65]。所以,开发快速、简便、灵敏、特异的过敏原成分筛查的免疫层析方法十分必要。目前,国内外检测过敏原主要采用酶联免疫吸附方法(enzyme linked immunosorbent assay,ELISA),利用胶体金免疫层析法检测的相关文献报道非常少,许多相关的研究尚待开展。Ji Kunmei等[66]建立了双位点单克隆抗体胶体金免疫层析法检测花生过敏原Ara h 1。其对标准花生样品的灵敏度为10 ng/mL。Chen Jiajie等[67]建立了一种实用的筛查和鉴定食品中花生过敏原的检测系统,胶体金试纸条筛出阳性样本后用免疫印迹检测确认。由于食物过敏原成分在加热和加压等加工过程中可能会发生蛋白质变性,给以抗原抗体特异性反应的免疫层析检测方法带来难题,很多问题还有待解决。
5 结 语
从近年来的文献报道来看,国内的胶体金免疫层析法在食品安全中的应用主要还是集中在检测兽药残留、农药残留、三聚氰胺等非法添加或过量添加方面,在天然存在的危害物质的检测方面应用相对较少。可以想象,随着技术的进步及各方对食品安全重视程度的增强,未来非法添加与滥用造成的食品安全威胁将逐步减少,而食品中天然存在的危害物质必将成为食品安全的关注点。
胶体金免疫层析技术作为一种新型的免疫学快速诊断和检测技术,具有需样微量、特异性强、操作简便、检测时间短等优点,适合基层和现场大批量快速检测。但是在实际检测应用中依然存在一些需要改进和优化的条件。首先为放大特异性抗原抗体的反应信号,增强胶体金的显色效果,可采用生物素亲和链霉亲和素系统或免疫金银染色法(immunogold silver staining,IGSS)等措施,并结合一些相应的生物传感器、电化学设备来拓宽其检测范围。其次可采用多膜复合或单膜多元受体固定2种方式,一次检测可同时得到多组结果,节省检测时间及成本,这对于检测某些具有联检意义的物质具有很大的应用价值。此外,目前胶体金试纸条的检测结果的判断大多通过目测显色情况,只能定性或半定量检测,可能存在较大的误差。为了减小误差,迫切地需要研制出一种定量化的读取仪器。
[1] CHANDLER J, GURMIN T, ROBINSON N. The place of gold in rapid tets[J]. IVD Technology, 2000, 6: 37-49.
[2] EHIRI J E, AZUBUIKE M C, UBBAONU C N, et al. Critical controlpoints of complementary food preparation and handling in eastern Nigeria[J]. Bulletin of the World Health Organization, 2001, 79(5): 423-433.
[3] World Health Organization. WHO Fact Sheet124: emerging foodborne diseases[R]. Geneva: WHO, 2002.
[4] 杨平, 杨会利. O157:H7感染症的流行概况[J]. 国外医学: 卫生学分册, 1997, 24(3): 170.
[5] World Health Organization. WHO Fact Sheet237: food safety and foodborne[R]. Geneva: WHO, 2002.
[6] IWABUCHI E, MARUYAMA N, HARA A, et al. Nationwide survey of Salmonella prevalence in environmental dust from layer farms in Japan[J]. Journal of Food Protection, 2010, 73(11): 1993-2000.
[7] 陈君石. 食源性疾病是我国头号食品安全问题[J]. 科学中国人, 2012(10): 71.
[8] 钟珍, 齐晖, 李富荣, 等. 胶体金免疫层析法检测大肠杆菌O157:H7的实验研究[J]. 实用医学杂志, 2010, 26(13): 2280-2283.
[9] 黄岭芳, 段霞, 陈媛, 等. 大肠杆菌O157:H7胶体金试纸条的研制[J].食品科学, 2010, 31(24): 355-359.
[10] ZHAO Xihong, HE Xiaowei, LI Wenmei, et al. Development and evaluation of colloidal gold immunochromatographic strip for detection of Escherichia coli O157[J]. African Journal of Microbiology Research, 2010, 4(9): 663-670.
[11] QI Hui, ZHONG Zhen, ZHOU Hanxin, et al. A rapid and highly sensitive protocol for the detection of Escherichia coli O157:H7 based on immunochromatography assay combined with the enrichment technique of immunomagnetic nanoparticles[J]. International Journal of Nanomedicine, 2011, 6: 3033-3039.
[12] 谢士嘉, 王静, 王振国. 利用胶体金免疫层析技术快速定量检测单增李斯特菌方法的建立[J]. 中国国境卫生检疫杂志, 2010, 33(2): 126-129.
[13] 崔焕忠, 张辉, 王兴龙. 胶体金试纸快速检测食品中单增李斯特菌[J].食品科学, 2010, 31(4): 239-242.
[14] 周东明, 唐雨德, 郁兴明, 等. 快速检测鼠伤寒沙门氏菌的胶体金免疫层析法的建立与初步应用[J]. 东南国防医药, 2007, 9(3): 180-182.
[15] SEO K H, HOLT P S, STONE H D, et al. Simple and rapid methods for detecting Salmonella enteritidis in raw eggs[J]. Int J Food Microbiol, 2003, 87(1/2): 139-144.
[16] 陈琼, 孔繁德, 张长弓, 等. 沙门氏菌快速检测试纸条的研制与应用[J]. 福建畜牧兽医, 2006, 28(5): 6-8.
[17] PATTARACHAYA P, KULWADEE P, WIJITAR D, et al. Development of a one-step immunochromatographic strip test using gold nanoparticles for the rapid detection of Salmonella typhi in human serum[J]. Biosensors and Bioelectronics, 2012, 31: 562-566.
[18] H UA N G S u h u a, W E I H C, L E E Y C. O n e-s t e p immunochromatographic assay for the detection of Staphylococcus aureus[J]. Food Control, 2007, 18(8): 893-897.
[19] 刘洪贵, 武瑞. 免疫层析法快速检测金黄色葡萄球菌的研究[J]. 中国预防兽医学报, 2009, 31(4): 283-287.
[20] 徐峰, 武晓丽, 徐迪, 等. 牛奶样品中志贺氏菌胶体金免疫试纸条检测方法的建立[J]. 中国乳品工业, 2012, 40(5): 46-50.
[21] 何艳玲, 林松, 王陆迪, 等. 胶体金免疫层析法检测水产品中O1群霍乱弧菌方法的建立和优化[J]. 中国国境卫生检疫杂志, 2007, 30(1): 52-55.
[22] 孔繁德, 刘阳, 徐淑菲, 等. 免疫金层析技术快速检测副溶血弧菌方法的初步研究[J]. 中国兽医科学, 2012(8): 819-824.
[23] JU Ying, HAO Huaijie, XIONG Guohua, et al. Development of colloidal gold-based immunochromatographic assay for rapid detection of Streptococcus suis serotype 2[J]. Veter Immunol Immunopathol, 2010, 133(2/4): 207-211.
[24] 辛志明, 樊海平, 吴斌, 等. 嗜水单胞菌胶体金快速检测试纸条的研制[J]. 中国兽医科学, 2012, 42(7): 708-712.
[25] 辛志明. 迟缓爱德华氏菌胶体金快速检测试纸的研制[J]. 中国海洋大学学报, 2011, 41(10): 40-44.
[26] LEONARD P, HEARTY S, BRENNAN J, et al. Advances in biosensors for detection of pathogens in food and water[J]. Enzyme and Microb Technol, 2003, 32(1): 3-13.
[27] 吴斌, 王玫, 高阳, 等. 大肠杆菌O157:H7胶体金试纸条的制备与检测[J]. 食品科技, 2011, 36(4): 292-295.
[28] 王卫杰. 食品中肠出血性大肠杆菌O157:H7和鼠伤寒沙门氏菌同时快速检测方法的研究[D]. 泰安: 山东农业大学, 2010.
[29] RAO R S, ALBALA J S, LANE S M, et al. Developing rapid point-ofcare multiplex detection for use in lateral flow devices[J]. Proc SPIE, 2005, 6007:pages600711.
[30] DARANAS A H, NORTE M, FERNANDEZ J J. Toxic marine microalgae[J]. Toxicon, 2001, 39(8): 1101-1132.
[31] ANDERSON D M, KULIS D M, QI Y Z, et al. Paralytic shellfish poisoning in Southern China[J]. Toxicon, 1996, 34(5): 579-590.
[32] ZHOU Yu, PAN Fengguang, LI Yangsong, et al. Colloidal gold probe-based immunochromatographic assay for the rapid detection of brevetoxins in fishery product samples[J]. Biosensors and Bioelectronics, 2009, 24(8): 2744-2747.
[33] ZHOU Yu, LI Yansong, LU Shiying, et al. Gold nanoparticle probebased immunoassay as a new tool for tetrodotoxin detection in puffer fish tissues[J]. Sensors and Actuators B: Chemical, 2010, 146: 368-372.
[34] 高利利, 程金平, 刘元嫄, 等. 软骨藻酸胶体金免疫层析检测试纸条的研制[J]. 环境科学, 2011, 32(8): 2492-2496.
[35] LIU Renyan, LIANG Yubo, CHEN Yuan, et al. Development of gold immunochromatography assay for the detection of okadaic acid[J]. Journal of Analytical Science, 2010, 26(1): 31-34.
[36] LU Shiying, LIN Chao, LI Yansong, et al. A screening lateral flow immunochromatographic assay for on-site detection of okadaic acid in shellfish products[J]. Analytical Biochemistry, 2012, 422: 59-65.
[37] 张道宏, 李培武, 张奇, 等. 污染粮油食品的主要真菌毒素及胶体金免疫层析技术在快速检测中的应用[J]. 中国油料作物学报, 2010, 32(4): 577-582.
[38] SUN Xiulan, ZHAO Xiaolian, TANG Jian, et al. Development of an immunochromatographic assay for detection of aflatoxin B1in foods[J]. Food Control, 2006, 17: 256-262.
[39] JIN Xiaoyong, JIN Xuefang, CHEN Liguo, et al. Piezoelectric immunosensor with gold nanoparticles enhanced competitive immunoreaction technique for quantification of aflatoxin B1[J]. Biosensors and Bioelectronics, 2009, 24: 2580-2585.
[40] 邓省亮, 赖卫华, 许杨. 胶体金免疫层析法快速检测黄曲霉毒素B1的研究[J]. 食品科学, 2007, 28(2): 232-235.
[41] 赖卫华, 刘道峰, 邓省亮. 胶体金免疫层析法检测酱油中黄曲霉毒素B1[J]. 食品与机械, 2012, 28(1): 70-72.
[42] LIU B H, HSU Y T, LU Chuanchen, et al. Detecting aflatoxin B1in foods and feeds by using sensitive rapid enzyme-linked immunosorbent assay and gold nanoparticle immunochromatographic strip[J]. Food Control, 2013, 30: 184-189.
[43] ZHANG Daohong, LI Peiwu, YANG Yang, et al. A high selective immunochromatographic assay for rapid detection of aflatoxin B1[J]. Talanta, 2011, 85: 736-742.
[44] ZHANG Daohong, LI Peiwu, ZHANG Qi, et al. Ultrasensitive nanogold probe-based immunochromatographic assay for simultaneous detection of total aflatoxins in peanuts[J]. Biosensors and Bioelectronics, 2011, 26: 2877-2882.
[45] WANG J J, LIU B H, HSU Y T, et al. Sensitive competitive direct enzyme-linked immunosorbent assay and gold nanoparticle immunochromatographic strip for detecting aflatoxin M1in milk[J]. Food Control, 2011, 22: 964-969.
[46] LAI Weihua, FUNG D Y C, XU Yang, et al. Development of a colloidal gold strip for rapid detection of ochratoxin a with mimotope peptide[J]. Food Control, 2009, 20(9): 791-795.
[47] ANFOSSI L, D’ARCO G, BAGGIANI C, et al. A lateral flow immunoassay for measuring ochratoxin A: development of a single system for maize, wheat and durum wheat[J]. Food Control, 2011, 22: 1965-1970.
[48] 马文蔚. 基于核酸适配体的食品中OTA和Hg(Ⅱ)的生物传感器检测方法研究[D]. 无锡: 江南大学, 2012.
[49] WANG Xianghong, LIU Tao, XU Na, et al. Enzyme-linked immunosorbent assay and colloidal gold immunoassay for ochratoxin A: investigation of analytical conditions and sample matrix on assay performance[J]. Anal Bioanal Chem, 2007, 389: 903-911.
[50] LI Yansong, ZHOU Yu, LU Shiying, et al. Development of a one-step test strip for rapid screening of fumonisins B1, B2and B3in maize[J]. Food Control, 2012, 24: 72-77.
[51] WANG Shuo, QUAN Ying, LEE N J, et al. Rapid determination of fumonisin B1in food samples by enzyme-linked immunosorbent assay and colloidal gold immunoassay[J]. Agric Food Chem, 2006, 54(7): 2491-2495.
[52] WANG Yuankai, SHI Yibo, ZOU Qi, et al. Development of a rapid and simultaneous immunochromatographic assay for the determination of zearalenone and fumonisin B1in corn,wheat and feedstuff samples[J]. Food Control, 2013, 31: 180-188.
[53] XU Yang, HUANG Zhibing, HE Qinghua, et al. Development of an immunochromatographic strip test for the rapid detection of deoxynivalenol in wheat and maize[J]. Food Chemistry, 2010, 119(2): 834-839.
[54] HUANG Zhibing, XU Yang, LI Laisheng, et al. Development of an immunochromatographic strip test for the rapid simultaneous detection of deoxynivalenol and zearalenone in wheat and maize[J]. Food Control, 2012, 28: 7-12.
[55] 贺贞云, 何庆华, 许杨. 真菌毒素免疫分析中新型检测元件的研究进展[J]. 食品工业科技, 2013, 34(3): 387-391.
[56] 向军俭, 陈耀强, 唐勇, 等. 胶体金免疫层析法快速检测水样品中的镉离子[J]. 中国生物制品学杂志, 2010, 23(5): 529-532.
[57] 刘斌, 唐勇, 向军俭, 等. 纳米钛富集水样重金属镉-胶体金免疫层析法快速检测方法的建立[J]. 分析测试学报, 2010, 29(3): 247-251.
[58] 吴凡. 重金属镉胶体金免疫层析快速测定方法及凹凸棒土对其吸附去除研究[D]. 南京: 南京大学, 2011.
[59] LIU Xi, XIANG Junjian, TANG Yong, et al. Colloidal gold nanoparticle probe-based immunochromatographic assay for the rapid detection of chromium ions in water and serum samples[J]. Analytica Chimica Acta, 2012, 745: 99-105.
[60] 刘文迪. 重金属铜单克隆抗体的制备及免疫检测方法的建立[D]. 长春: 吉林大学, 2012.
[61] 黄婧. 用于检测铜离子和铅离子的核酸纳米金传感器的研究[D]. 合肥: 中国科学技术大学, 2011.
[62] TANG Yong, ZHAI Yifa, XIANG Junjian, et al. Colloidal gold probebased immunochromatographic assay for the rapid detection of lead ions in water samples[J]. Environmental Pollution, 2010, 158(6): 2074-2077.
[63] 张燚. Hg2+快速免疫检测技术研究[D]. 长春: 吉林大学, 2011.
[64] SCHUBERT-ULLRICH P, RUDOLF J, ANSARI P, et al. Commercialized rapid immunoanalytical tests for determination of allergenic food proteins: an overview[J]. Anal Bioanal Chem, 2009, 395: 69-81.
[65] 黄峙, 郭宝江. 食品过敏原检测与评价技术研究进展[J]. 食品科学, 2003, 24(8): 240-244.
[66] JI Kunmei, CHEN Jiajie, GAO Chen, et al. A two-site monoclonal antibody immunochromatography assay for rapid detection of peanut allergen Ara h 1 in Chinese imported and exported foods[J]. Food Chemistry, 2011, 129: 541-545.
[67] CHEN Jiajie, XIA Lixin, WU Xuli, et al. A practical test system for sensitive, rapid screening and authentication of peanut allergens in imported and exported food products in Chinese Customs[J]. Food Control, 2012, 23: 154-158.
Progress in the Detection of Naturally Occurring Hazardous Substances in Foods by Colloidal Gold Immunochromatography Assay
XU Chao-lian, LAI Wei-hua*, LIU Dao-feng
(State Key Laboratory of Food Science and Technology, Nanchang University, Nanchang 330047, China)
Colloidal gold immunochromatography assay is a simple and fast immunological detection technology and is now widely applied in many fields including food safety detection, biomedical diagnosis, and so on. The food-derived hazardous substances are classified into either artificially added or naturally occurring.includeman-added additives and ly existing hazards In this article, the application of colloidal gold immunochromatography assay in the detection of the naturally ing occurring hazardous substances is reviewed. The further development of the immunochromatography assay is prospected as well.
colloidal gold; immunochromatography; food safety; natural hazardous substances
TS207
A
1002-6630(2014)05-0257-05
10.7506/spkx1002-6630-201405050
2012-12-11
江西省主要学科学术和技术带头人培养计划项目(20113BCB22007);江西省教育厅落地项目(KJLD13009);
江西省生猪产业质量安全岗位专家项目(JXARS-03)
徐超莲(1988—),女,硕士研究生,研究方向为食品工程。E-mail:chaochaoncu@163.com
*通信作者:赖卫华(1968—),男,教授,博士,研究方向为食品科学。E-mail:talktolaiwh@163.com

