苦荞酒液态发酵工艺条件的优化
陈佳昕,赵晓娟,吴 均,杜木英*
(西南大学食品科学学院,重庆市特色食品工程技术研究中心,重庆市农产品加工及贮藏重点实验室,重庆 400715)
苦荞酒液态发酵工艺条件的优化
陈佳昕,赵晓娟,吴 均,杜木英*
(西南大学食品科学学院,重庆市特色食品工程技术研究中心,重庆市农产品加工及贮藏重点实验室,重庆 400715)
以重庆酉阳生产的苦荞为原料,应用液态发酵技术,通过单因素和正交试验对苦荞酒的酿造工艺条件进行优化,从而确定苦荞酒的最佳工艺参数。结果表明:苦荞酒最佳液化工艺条件为α-淀粉酶添加量0.15%、pH 6.5、温度60 ℃、液化时间2.5 h;最佳糖化工艺条件为糖化酶添加量1.5%、pH 5.0、温度60 ℃、糖化时间3 h;最佳发酵工艺条件为酵母菌添加量0.1%、发酵温度28 ℃、pH 4.5。在此条件下发酵72h即可得到酒度为9°左右的苦荞酒。
苦荞酒;液态法;液化;糖化;发酵
荞麦为蓼科荞麦属一年生草本植物,包括甜荞和苦荞两个品种[1]。苦荞麦又名鞑靼荞麦、野荞麦、万年荞[2],主要分布于我国云贵高原、西南山区及山西、陕西等地[3]。苦荞含有丰富的蛋白质、脂肪、淀粉、矿物质和维生素[4],还含有其他禾谷类作物没有的叶绿素和生物类黄酮[5]。大量研究表明,苦荞提取物中生物类黄酮、苦荞蛋白、苦荞糖醇等具有很强的生物活性,能降低血糖、血脂、尿糖,具有抗疲劳、抗衰老、抗炎镇痛、抑制肿瘤细胞等作用[6-18]。
传统酿酒工艺主要是固态及半固态发酵工艺,此工艺生产周期长,人工劳动强度大,原料利用率低,不适应现代化生产的要求。虽然苦荞有很高的营养保健价值,但苦荞酒的生产技术尚未成熟,市面上可见产品不多,液态发酵法生产苦荞酒的研究报告更是少之又少,且原料大多为苦荞及其他作物组成的复合物,因此研制一种以100%苦荞为原料的既营养又美味且便于实现机械化和自动化生产的苦荞酒符合当今酒类生产消费的发展趋势。本研究以重庆酉阳生产的苦荞为原料,通过单因素和正交试验对苦荞酒的酿造工艺条件进行优化,旨在为以后工业化生产提供参考数据。
1 材料与方法
1.1 材料与试剂
苦荞,产地重庆酉阳,选用颗粒饱满无霉变的苦荞通过高速粉碎机粉碎后过40目筛,置阴凉干燥地备用。
α-淀粉酶(酶活力≥3700U/g)、糖化酶(酶活力≥105U/g) 北京奥博星生物技术有限责任公司;酿酒高活性干酵母 安琪酵母有限公司;其余试剂均为国产分析纯。
1.2 仪器与设备
HH-6数显恒温水浴锅 金坛市富华仪器有限公司;DFT-200型高速粉碎机 温岭市林大机械有限公司;PB-10型酸度计、FA2004型分析天平 上海精密科学仪器有限公司;HH·B11·420-S-Ⅱ型恒温培养箱 上海跃进医疗器械厂;PSX-280A型手提高压灭菌锅 上海申安医疗器械厂;RHB-32ATC型手持糖度计 厦门晋力自动化有限公司;722-P可见分光光度计 上海现科仪器有限公司。
1.3 方法
1.3.1 苦荞酒制作的基本工艺流程

1.3.2 酵母的活化
将酵母用2%的糖水或4~5°Brix的稀糖化醪在35~40 ℃的温水中复水15~20 min,然后将温度降至34 ℃以下活化1~2 h即可。
1.3.3 指标测定
还原糖含量采用GB/T 5009.7—2008《食品中还原糖的测定》中的直接滴定法;可溶性固形物采用手持糖度计直接测定;酒精度采用GB/T 13662—2008《黄酒》中的比重计法,以乙醇的体积分数计;黄酮含量采用GB/T 20574—2006《蜂胶中总黄酮含量的测定方法》。pH值采用pH计直接测定;总酸含量采用GB/T 12456—2008《食品中总酸的测定》中的酸碱滴定法;氨基酸态氮:采用GB/T 13662—2008《黄酒》中的酸度计法;溶液相对密度使用密度计法;葡萄糖当量(dextrose equivalent,DE)值表示溶液中淀粉的水解程度或糖化程度,是糖液中还原糖(以葡萄糖计)的含量占干物质的百分比[19]。

1.3.4 苦荞酒液化条件的单因素试验设计
1.3.4.1 α-淀粉酶液化温度的确定
将苦荞粉末按1∶4(m/V)的料液比糊化后,用2mol/L NaOH调节pH值至6.5,然后添加0.1%的α-淀粉酶,将其放置温度分别为50、55、60、65、70 ℃的水浴锅中水浴3 h,通过测定其DE值来确定最适液化温度。
1.3.4.2 α-淀粉酶液化pH值的确定
将苦荞粉末按1∶4(m/V)的料液比糊化后,用2 mol/L NaOH或2 mol/L柠檬酸调节pH值分别为5.5、6.0、6.5、7.0、7.5,然后添加0.1%的α-淀粉酶,将其在60 ℃的水浴锅中水浴3h,通过测定其DE值来确定最适液化pH值。
1.3.4.3 α-淀粉酶液化时间的确定
将苦荞粉末按1∶4(m/V)的料液比糊化后,用2mol/L NaOH调节pH值至6.5,然后添加0.1%的α-淀粉酶,将其在60℃的水浴锅中分别水浴1、1.5、2、2.5、3、3.5h,通过测定其DE值来确定最适液化时间。
1.3.4.4 α-淀粉酶液化添加量的确定
将苦荞粉末按1∶4(m/V)的料液比糊化后,用2mol/L NaOH调节pH值至6.5,然后分别添加0.05%、0.1%、0.15%、0.2%、0.25%、0.3%的α-淀粉酶,将其在60℃的水浴锅中水浴3h,通过测定其DE值来确定最适液化酶添加量。
1.3.4.5 苦荞酒液化条件的正交试验设计
根据以上苦荞酒液化条件的单因素试验,确定各因素适合的水平范围,设计四因素三水平的正交试验,以液化DE值为考核指标,确定液化最优试验组合。
1.3.5 苦荞酒糖化条件的单因素试验设计
1.3.5.1 糖化酶糖化温度的确定
以1.3.4节得到的最佳液化条件的苦荞液化液为研究对象,用2mol/L柠檬酸调节pH值至5.0,然后添加1%的糖化酶,将其分别放置温度为50、55、60、65、70、75℃的水浴锅中水浴3h,通过测定其还原糖含量来确定最适糖化温度。
1.3.5.2 糖化酶最适pH值的确定
以1.3.4节得到的最佳液化条件的苦荞液化液为研究对象,用2mol/L柠檬酸调节pH值分别至3.0、3.5、4.0、4.5、5.0、5.5、6.0,然后添加1%的糖化酶,将其放置55℃的水浴锅中水浴3h,通过测定其还原糖含量来确定最适糖化pH值。
1.3.5.3 糖化酶糖化时间的确定
以1.3.4节得到的最佳液化条件的苦荞液化液为研究对象,用2mol/L柠檬酸调节pH值至5.0,然后添加1%的糖化酶,将其在55℃的水浴锅中分别水浴0.5、1、1.5、2、2.5、3、3.5h,通过测定其还原糖含量来确定最适糖化时间。
1.3.5.4 糖化酶添加量的确定
以1.3.4节得到的最佳液化条件的苦荞液化液为研究对象,用2mol/L柠檬酸调节pH值至5.0,然后添加1%的糖化酶,然后分别添加0.05%、0.1%、0.3%、0.5%、1.0%、1.5%、2.0%的糖化酶,将其在55℃的水浴锅中水浴3h,通过测定其还原糖含量来确定最适糖化酶添加量。
1.3.5.5 苦荞酒糖化条件的正交试验设计
以1.3.4节得到的最佳液化条件的苦荞液化液为研究对象,根据以上苦荞酒糖化条件的单因素试验结果,设计四因素三水平的正交试验,以还原糖含量为考核指标,确定糖化最优试验组合。
1.3.6 苦荞酒发酵条件的单因素试验设计
1.3.6.1 苦荞酒发酵pH值的确定
将经过液化和糖化后的料液,用2mol/L柠檬酸分别调节其pH值至3.5、4.0、4.5、5.0、5.5,然后添加0.1%的安琪酵母,在28℃的条件下发酵72h,通过比较其酒精度和黄酮含量来确定发酵初始pH值。
1.3.6.2 苦荞酒发酵酵母菌添加量的确定
将经过液化和糖化后的料液,用2mol/L柠檬酸调节其pH值至4.5,然后分别添加0.05%、0.1%、0.15%、0.2%、0.25%、0.30%的安琪酵母,在28℃的条件下发酵72h,通过比较其酒精度和黄酮含量来确定酵母菌的添加量。
1.3.6.3 苦荞酒发酵温度的确定
将经过液化和糖化后的料液,用2mol/L柠檬酸调节其pH值至4.5,然后添加0.1%的安琪酵母,分别置于20、24、28、32、36℃的条件下发酵72h,通过比较其酒精度和黄酮含量来确定最适发酵温度。
1.3.6.4 苦荞酒发酵条件的正交试验设计
以1.3.4、1.3.5节得到的最佳液化条件和最佳糖化条件的苦荞液为研究对象,根据以上苦荞酒发酵条件的单因素试验结果,设计三因素三水平的正交试验,以酒精度及黄酮含量为考核指标,确定发酵最优试验组合。
1.4 数据分析
采用Origin Pro8.6软件对单因素和正交试验数据进行处理。
2 结果与分析
2.1 苦荞酒液化最佳工艺条件的确定
2.1.1 温度对液化液DE值的影响

图1 液化温度对液化液DE值的影响Fig.1 Effect of liquefaction temperature on DE
由图1可知,当温度为60℃时,液化液DE值达到最大,即α-淀粉酶对液化液的水解程度达到最高。当温度小于60℃时,液化液DE值随着温度的升高而显著增加(P<0.05);当温度大于60℃时,随着温度的增加,液化液DE值显著下降(P<0.05)。这是因为温度对α-淀粉酶的活性存在影响,在适宜温度范围内,随着温度的升高,反应速度加快,一旦超过最适温度范围,α-淀粉酶的活性逐渐降低甚至丧失,反应速率下降。因此,液化的最适温度为60℃。
2.1.2 pH值对液化液DE值的影响

图2 pH值对液化液DE值的影响Fig.2 Effect of liquefaction pH on DE
由图2可知,当pH值为7时,液化液DE值达到最大,即α-淀粉酶对液化液的水解程度达到最高。当pH值小于7时,液化液DE值随着pH值的升高而显著增加(P<0.05),当pH值大于7时,随着pH值的升高,液化液DE值显著下降(P<0.05)。这是因为pH值对α-淀粉酶的活性存在影响,pH值过高或过低都会改变酶的活性中心构象[20],即酶只在最适的pH值范围内才能表现出最大活力。在适宜pH值范围内,随着pH值的升高,反应速度加快,一旦超过最适pH值范围,α-淀粉酶的活性逐渐降低甚至丧失,反应速率下降。因此,液化的最适pH值为7。
2.1.3 液化时间对液化液DE值的影响

图3 液化时间对液化液DE值的影响Fig.3 Effect of liquefaction time on DE
由图3可知,当液化时间小于2h时,液化液DE值随着液化时间的增加显著升高(P<0.05),当液化时间大于2h时,随着液化时间的增加,液化液DE值上升缓慢,不显著(P>0.05),趋于平稳。这是因为随着液化的进行,液化液中短链淀粉产物逐渐增多,使得水解的速度变慢。α-淀粉酶对淀粉的液化可以分为两个阶段,开始时α-淀粉酶主要作用于直链淀粉,使其降解生成寡糖,淀粉液黏度下降,然后作用于支链淀粉,产生葡萄糖、麦芽糖以及α-限制糊精,同时使寡糖水解生成葡萄糖和麦芽糖[21]。因此,考虑到时间成本,以提高效率,液化的最适时间选为2h。
2.1.4 α-淀粉酶添加量对液化液DE值的影响

图4 α-淀粉酶添加量对液化液DE值的影响Fig.4 Effect of amount of α- amylase used for liquefaction on DE
由图4可知,当α-淀粉酶添加量小于0.15%时,液化液DE值随着α-淀粉酶添加量的增多而显著增大(P<0.05);当α-淀粉酶添加量大于0.15%时,液化液DE值随着α-淀粉酶添加量的增加不显著(P>0.05),逐渐趋于平稳。α-淀粉酶属于内切酶,可以水解淀粉分子结构内部的α-1,4糖苷键,但较难水解位于分子末端的α-1,4糖苷键,且不能水解α-1,6糖苷键,从而,随着液化时间的延长,DE值基本不再变化。因此,从节约酶用量和降低生成成本角度考虑,液化的最适α-淀粉酶添加量为0.15%。
2.1.5 苦荞酒液化的正交试验
在单因素试验的基础上,设计以下四因素三水平的正交试验,实验结果见表1。
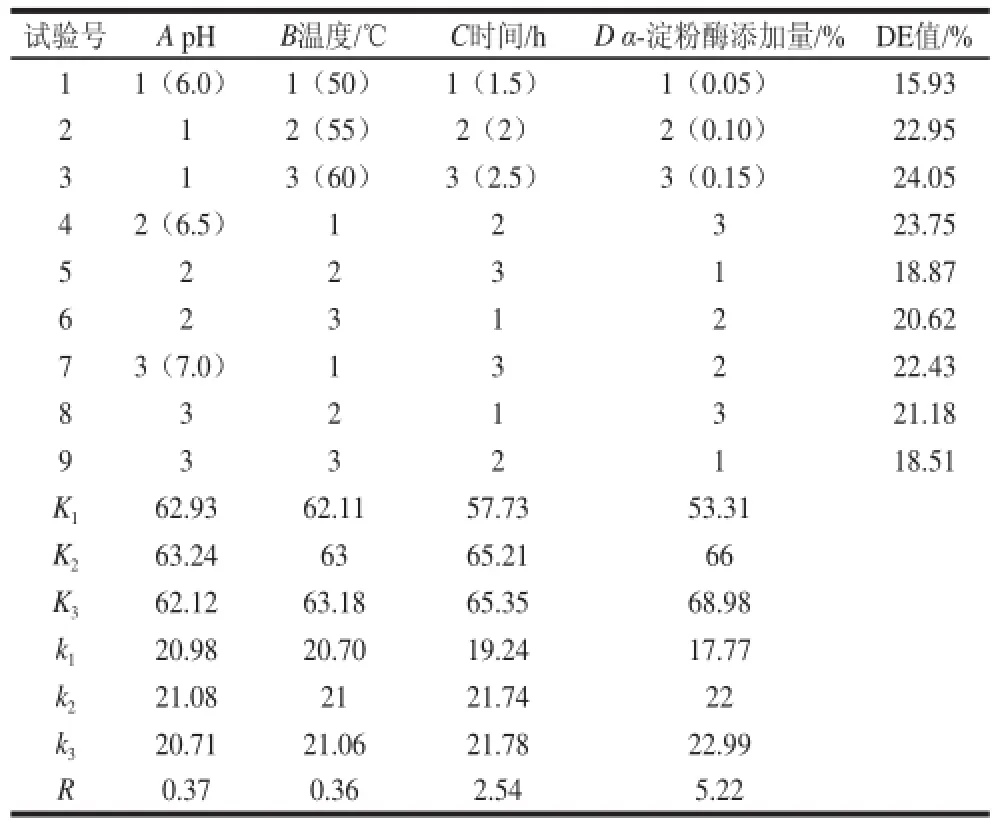
表1 液化正交试验结果Table1 Orthogonal array design and results for the optimization of liquefaction conditions
由表1可知,各因素对苦荞酒液化DE值的影响次序为D>C>A>B,即α-淀粉酶添加量>时间>pH值>温度。苦荞酒液化的最优组合为A2B3C3D3,但是此组合未在9组实验中出现,因此需要对该组合做验证实验。通过验证实验,在此最佳组合下得到的DE值为25.43%,高于9组试验,因此,苦荞酒液化的最佳条件为:α-淀粉酶添加量为0.15%、温度60 ℃、pH 6.5、液化时间2.5 h。
2.2 苦荞酒糖化最佳工艺条件的确定
2.2.1 糖化pH值对糖化液还原糖含量的影响
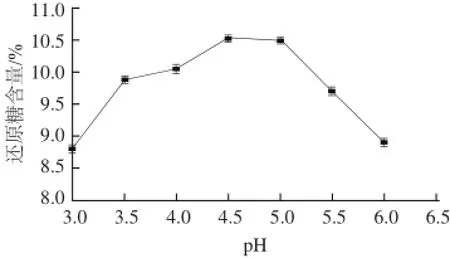
图5 糖化pH值对糖化液还原糖含量的影响Fig.5 Effect of saccharification pH on reducing sugar content
由图5可知,当pH<4.5时,还原糖含量随着pH值的升高而升高;当pH>4.5时,还原糖含量随着pH值的再度升高而降低;当pH值为4.5时,还原糖含量达到最大,为10.53%。这是因为pH值影响糖化酶的活性,pH值过低或过高都会导致酶变性,从而降低糖化酶的活性,甚至失活。因此,最适糖化pH值为4.5。
2.2.2 糖化温度对糖化液还原糖含量的影响

图6 糖化温度对糖化液还原糖含量的影响Fig.6 Effect of saccharification temperature on reducing sugar content
由图6可知,当温度低于60℃时,随着温度的升高还原糖含量显著增加(P<0.05);当温度超过60 ℃时,还原糖含量随着温度的升高而降低;当温度为60 ℃时,还原糖含量达到最大值。这是因为当温度超过60 ℃时,糖化酶的活性逐渐降低,因此,最适糖化温度为60 ℃。
2.2.3 糖化时间对糖化液还原糖含量的影响

图7 糖化时间对糖化液还原糖含量的影响Fig.7 Effect of saccharification time on reducing sugar content
由图7可知,当糖化时间小于2.5 h时,糖化液还原糖含量随着糖化时间的延长而显著升高(P<0.05);当糖化时间长于2.5 h时,还原糖含量随着糖化时间的延长逐渐趋于平稳(P>0.05)。因此,考虑到时间成本,以提高效率,糖化最适时间为2.5 h。
2.2.4 糖化酶添加量对糖化液还原糖含量的影响
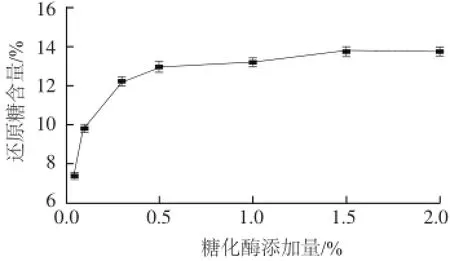
图8 糖化酶添加量对糖化液还原糖含量的影响Fig.8 Effect of glucoamylase amount on reducing sugar content
由图8可知,当糖化添加量小于0.5%时,糖化液还原糖含量随着糖化酶添加量的增多而显著增大(P<0.05);当糖化酶添加量大于0.5%时,糖化液还原糖含量升高幅度缓慢,趋于平衡(P>0.05)。因此,从节约酶用量和降低生成成本角度考虑,糖化最适糖化酶添加量为0.5%。
2.2.5 苦荞酒液化的正交试验

表2 糖化正交试验结果Table2 Orthogonal array design and results for the optimization of saccharification conditions
由表2可知,各因素对还原糖含量的影响次序为B>C>D>A,即温度>时间>糖化酶添加量>pH值。分析得出还原糖含量对苦荞酒糖化的最优组合均为A3B2C3D3,但是此组合未在9组试验中出现,因此需要对该组合做验证实验。通过验证实验,在此最佳组合下得到的还原糖含量为13.32%,高于9组试验,因此,苦荞酒糖化的最佳条件为:糖化酶添加量为1.5%、温度60℃、pH5.0、糖化时间3h。
2.3 苦荞酒发酵最佳工艺条件的确定
2.3.1 酵母菌添加量对苦荞酒酒精度及黄酮含量的影响

图9 酵母菌添加量对苦荞酒酒精度及黄酮含量的影响Fig.9 Effect of yeast inoculum size on the contents of alcohol and flavonoids in tartary buckwheat wine
由图9可知,当酵母菌添加量为0.1%时,苦荞酒的酒精度及黄酮含量均达到最大;当酵母菌添加量小于0.1%时,苦荞酒的酒精度和黄酮含量逐渐增大,这是因为当酵母菌添加量过小的时候,发酵液中的原料糖分不能被酵母菌充分利用,发酵不完全;而当酵母菌添加量大于0.1%时,苦荞酒的酒精度和黄酮含量逐渐降低,这是因为酵母菌添加量过大时,酵母菌会利用发酵液中的糖分用于自身生长,而用于产酒精的底物浓度降低,且当酵母菌添加过多时,微生物繁殖过快,也会消耗发酵液中的糖分,使得最终酒精度较低。因此,最适酵母菌添加量为0.1%。
2.3.2 pH值对苦荞酒酒精度及黄酮含量的影响

图10 pH值对苦荞酒酒精度及黄酮含量的影响Fig.10 Effect of fermentation pH on contents of alcohol and flavonoids in tartary buckwheat wine
由图10可知,当pH值为4.5时,苦荞酒的酒精度与黄酮含量达到最大。当pH<4.5时,随着pH值的增加,酒精度与黄酮含量逐渐增加。当pH>4.5时,随着pH值的逐渐增大,酒精度与黄酮含量逐渐降低。这是因为当pH值过低时,酵母菌的代谢能力受到影响,发酵速度减慢,不利于发酵;而当pH值过高时,杂菌繁殖不受抑制,影响最终酒的风味,且使得酒精度降低。综合考虑,苦荞酒最适发酵pH值为4.5。
2.3.3 发酵温度对苦荞酒酒精度及黄酮含量的影响
由图11可知,当发酵温度为28 ℃时,所得苦荞酒的酒精度与黄酮含量达到最大;而当温度低于28 ℃时,随着温度的升高,苦荞酒的酒精度与黄酮含量均逐渐升高;当温度高于28 ℃时,随着温度的升高,苦荞酒的酒精度与黄酮含量均逐渐降低。这是因为,当温度对微生物的生长有很大的影响,当温度较低时,酵母菌代谢能力较弱,不能充分利用发酵液中的糖分进行酒精发酵,而当温度较高时,酵母菌的发酵速率较快,会提前导致酵母菌老化,且残糖量高,酒精产量低。因此,综合考虑苦荞酒发酵的最适温度为28 ℃。

图11 温度对苦荞酒酒精度及黄酮含量的影响Fig.11 Effect of fermentation temperature on the contents of alcohol and flavonoids in tartary buckwheat wine
2.3.4 苦荞酒发酵的正交试验
在单因素试验的基础上,设计以下三因素三水平的正交试验,结果见表3。

表3 苦荞酒发酵正交试验结果Table3 Orthogonal array design and results for the optimization of fermentation conditions
由表3可知,各因素对苦荞酒发酵酒精度的影响次序为C>B>A,即发酵温度>发酵pH值>酵母菌的添加量,对黄酮含量的影响次序为A>B=C,即酵母菌的添加量>发酵pH值=发酵温度。分析得出二指标对苦荞酒发酵的最优组合均为A1B2C1,但是此组合在9组试验中未出现,因此需要对该组合做验证实验。通过验证实验,在此最佳组合下得到的酒精度为8.9°,黄酮含量为0.94 mg/L高于9 组试验,因此,苦荞酒发酵的最佳条件为:酵母菌添加量为0.1%、温度28 ℃、pH 4.5。
2.4 最优条件下苦荞酒基本理化指标测定结果

表4 苦荞酒基本理化指标Table4 Basic physical and chemical indicators of tartary buckwheat wine
由表4可知,苦荞成品酒各指标均达到黄酒相关标准,其中酒精度约为8.9°,功能因子总黄酮含量达到0.94mg/L左右,氨基酸态氮的含量也大于黄酒标准,因此,苦荞酒总体符合黄酒相关标准。
3 结 论
通过对苦荞酒酿造工艺的研究,确定了最佳液化工艺条件为:α-淀粉酶添加量0.15%、pH 6.5、温度60 ℃、液化时间2.5 h;最佳糖化最佳工艺条件为:糖化酶添加量1.5%、pH 5、温度60 ℃、糖化时间3 h;最佳发酵工艺条件为:酵母添加量0.1%、发酵温度28 ℃、pH 4.5。所得最优工艺条件下的苦荞酒相关指标符合国家相关标准。
[1] 何嵋, 王锐, 周云. 荞麦研究进展综述[J]. 现代农业科技, 2011(2): 46-49.
[2] 林兵, 胡长玲, 黄芳, 等. 苦荞麦的化学成分和药理活性研究进展[J].现代药物与临床, 2011, 26(1): 29-33.
[3] 刘萍, 张东送, 吴雅静. 我国苦荞麦的开发利用及存在的问题与对策[J]. 食品科学, 2011, 32(11): 361-363.
[4] 林汝法. 中国荞麦[M]. 北京: 中国农业出版社, 1994: 12.
[5] 宋毓雪, 黄凯丰. 苦荞营养保健成分研究[J]. 安徽农业科学, 2011, 39(1): 100-102.
[6] CAO W, CHEN W J, SUO Z R, et al. Protective effects of ethanolic extracts of buckwheat groats on DNA damage caused by hydroxyl radicals [J]. Food Research International, 2008, 41(9): 924-929.
[7] BONAFACCIA G, MAROCCHINI M, KREFT I. Composition and technological properties of the flour and bran from common and tartary buckwheat [J]. Food Chemistry, 2003, 80(1): 9-15.
[8] 张强, 李艳琴. 苦荞功能成分及其开发利用[J]. 山西师范大学学报:自然科学版, 2009, 23(4): 85-90.
[9] KAWA J M, TAYLOR C G, PRZYBYLSKI R. Buckwheat concentrate reduces serum glucose in streptozotocin-diabetic rats[J]. Journal of Agricultural Food Chemistry, 2003, 51(25): 7287-7291.
[10] 薛长勇, 张月红, 刘英华, 等. 苦荞黄酮降低血糖和血脂的作用途径[J].中国临床康复, 2005, 35(9): 111-113.
[11] 胡一冰, 赵刚, 邹亮, 等. 苦荞籽提取物抗小鼠躯体疲劳作用初探[J].成都大学学报: 自然科学版, 2008, 27(3): 181-182.
[12] 张超, 卢艳, 郭贯新, 等. 苦荞麦蛋白质抗疲劳功能机理的研究[J].食品与生物技术学报, 2005, 24(6): 78-82.
[13] 王敏, 魏益民, 高锦明. 苦荞麦总黄酮对高脂血大鼠血脂和抗氧化作用的影响[J]. 营养学报, 2006, 28(6): 502-509.
[14] 马挺军, 陕方, 贾昌喜. 苦荞颗粒冲剂对糖尿病小鼠降血糖作用研究[J]. 中国食品学报, 2011, 11(5): 15-18.
[15] 左光明, 谭斌, 王金华, 等. 苦荞蛋白对高脂血症小鼠降血糖及抗氧化功能研究[J]. 食品科学, 2010, 31(7): 247-250.
[16] 杨叶红, 杨联芝, 柴岩, 等. 甜荞和苦荞籽中多酚存在形式与抗氧化活性的研究[J]. 食品工业科技, 2011, 32(5): 90-94.
[17] 胡一冰, 赵钢, 彭镰心, 等. 苦荞芽提取物的抗炎镇痛作用和急性毒性试验研究[J]. 食品科学, 2009, 30(23): 406-409.
[18] 闫斐艳. 苦荞总黄酮的提取及体外抗肿瘤活性研究[D]. 太原: 山西大学, 2010.
[19] 姜锡瑞, 段钢. 新编酶制剂实用技术手册[M]. 北京: 中国轻工业出版社, 2002: 42.
[20] 张国权, 魏益民, 罗勤贵等. 荞麦淀粉酶水解工艺条件研究[J]. 西北农林科技大学学报: 自然科学版, 2006, 34(9): 86-93.
[21] 张国权, 史一一, 魏益民等. 荞麦淀粉耐高温α-淀粉酶液化工艺条件研究[J]. 中国粮油学报, 2008, 23(3): 73-76.
Optimization of Liquid-State Fermentation Conditions for Buckwheat Wine
CHEN Jia-xin, ZHAO Xiao-juan, WU Jun, DU Mu-ying*
(Chongqing Special Food Programme and Technology Research Center, Chongqing Key Laboratory of Produce Processing and Storage, College of Food Science, Southwest University, Chongqing 400715, China)
This study reports the production of tartary buckwheat wine from liquid-state fermentation of tartary buckwheat from Youyang, Chongqing municipality. We optimized the process conditions using single-factor and orthogonal array designs. The best liquefaction results were obtained by enzymatic treatment for 2.5 h using α-amylase at pH 6.5 and 60 ℃with an enzyme dosage of 0.15%. The best saccharification conditions were achieved by allowing the hydrolysis process catalyzed by 1.5% glucoamylase at pH 5.0 and 60 ℃ to proceed for 2.5 h. The best fermentation conditions were determined as 0.1% yeast inoculum size, pH 4.5 and 28 ℃. After 72 h of fermentation under these optimized conditions, tartary buckwheat wine with an alcohol content of approximately 9% by volume was obtained.
tartary buckwheat wine; liquid-state fermentation; liquefaction; saccharification; fermentation
TS261.4
A
1002-6630(2014)11-0129-06
10.7506/spkx1002-6630-201411026
2013-07-19
中国-匈牙利政府间科技合作项目(国科外字[2013]83号,No:6-30)
陈佳昕(1989—),女,硕士研究生,研究方向为食品安全与质量控制。E-mail:331956701@qq.com
*通信作者:杜木英(1972—),女,副教授,博士,研究方向为微生物与发酵工程。E-mail:muyingdu@swu.edu.cn

