His-N2蛋白体外排除抑制大肠杆菌DH5α黏附猪肠黏液蛋白的研究
都立辉,张 虹,施荣华,和肖营,刘 琴
(南京财经大学食品科学与工程学院,江苏省粮油品质控制及深加工技术重点实验室,江苏 南京 210023)
His-N2蛋白体外排除抑制大肠杆菌DH5α黏附猪肠黏液蛋白的研究
都立辉,张 虹,施荣华,和肖营,刘 琴
(南京财经大学食品科学与工程学院,江苏省粮油品质控制及深加工技术重点实验室,江苏 南京 210023)
以植物乳杆菌KLDS1.0320候选表面黏附蛋白NP_785232 N端前两个结构域组成的融合表达蛋白为研究对象,采用体外模拟肠道环境的方法研究其对大肠杆菌DH5α黏附猪肠黏液的排除抑制作用。对猪肠黏液进行固定,加入His-N2融合表达蛋白37℃孵育1h,再加入大肠杆菌DH5α菌悬液37℃孵育1h,洗去未黏附的菌体,之后用1%Triton X-100进行裂解,将裂解液涂布LB琼脂平板以进行菌落计数。结果表明:pH值为6.6时,相对于缓冲液阴性对照组,His-N2蛋白对大肠杆菌DH5α黏附猪肠黏液的抑制率为(50.37±3.66)%,相对于BSA蛋白对照组的抑制率为(38.33±4.55)%;pH值为7.5时,相对于缓冲液阴性对照组,His-N2蛋白对大肠杆菌DH5α黏附猪肠黏液的抑制率为(42.18±3.44)%,相对于BSA蛋白对照组的抑制率为(34.48±3.90)%。在体外模拟条件下,由植物乳杆菌KLDS1.0320的候选表面黏附蛋白NP_785232 N端前两个结构域组成的His-N2蛋白能排除抑制大肠杆菌DH5α对猪肠黏液蛋白的黏附。
植物乳杆菌;His-N2蛋白;大肠杆菌;猪肠黏液;排除抑制
乳酸杆菌(Lactobacillus)是一类菌体形状呈杆状或棒球杆状的革兰氏阳性细菌的总称。其DNA的G+C含量低于55%,兼性厌氧或严格厌氧,无芽孢和荚膜,对营养要求高,发酵碳水化合物时产生大量乳酸,嗜酸性,最适生长pH值范围为5.5~6.2,在自然界中分布广泛,是人和动物消化道等部位的重要生理性菌群之一。
乳酸杆菌具有公认的生物安全性(generally regarded as safe,GRAS)和益生作用,其益生作用主要包括:调节和维持肠道微生态系统的平衡[1];协同和促进食物的消化吸收[2-4];强化肠黏膜系统的屏障作用,抑制病原菌的黏附和定殖[5-7];直接或间接地增强机体的免疫能力[8-11]。正是由于乳酸杆菌的这些安全、绿色的益生功能,使之成为国内外微生态制剂领域的研究热点之一。目前,不少研究已经证实乳酸杆菌具有抑制病原菌黏附细胞和宿主肠道的作用[12-13],但其抑制作用的具体机制,即乳酸杆菌与病原菌和肠道分子之间的相互作用方式尚不明确,相关报道也较少,这极大地制约了人类对乳酸杆菌益生作用的认知水平。
乳酸杆菌能够在宿主肠道中黏附并定殖是其发挥益生功能的前提。细菌的黏附是菌体表面多种结构参与的复杂过程,这些结构包括多糖、脂磷壁酸、细胞壁毛缘和细菌表面蛋白等。文献报道的与黏附相关的乳酸杆菌表面蛋白有S-层蛋白、引物酶sortase依赖蛋白和黏膜结合蛋白[14]等。这些黏附蛋白的存在佐证了乳酸杆菌在肠道中的黏附定殖能力,同时不同黏附蛋白的存在也暗示它们可能通过不同的机制促进相应菌体的黏附。因此,研究黏附蛋白与肠道分子的相互作用,必将从分子水平上揭示乳酸菌在肠道定殖及其益生作用的内在机理。
本实验以植物乳杆菌KLDS1.0320候选表面黏附蛋白NP_785232 N端前两个结构域组成的融合蛋白(His-N2蛋白)为研究对象,采用外源重组表达的方法对其进行大量诱导表达,依次通过亲和色谱和排阻色谱等分离技术对His-N2蛋白进行分离纯化。在此基础上,通过体外固定猪肠黏液以模拟肠道环境,研究His-N2蛋白对大肠杆菌DH5α菌株黏附猪肠黏液的排除抑制作用。研究结果为进一步确证His-N2蛋白在植物乳杆菌黏附宿主肠道过程中的具体作用及其抑制病原菌黏附的机制提供参考。
1 材料与方法
1.1 菌株
大肠杆菌DH5α菌株由本实验室保存。
1.2 材料与试剂
猪肠黏液由如皋市太阳肠衣食品有限公司惠赠;BCA蛋白定量试剂盒 南京诺唯赞生物科技有限公司;HisTrap HP柱、Sephadex G-25填料、HiTrapTMDesalting 5mL柱 美国GE公司;灭菌96孔细胞培养板 南京丁贝生物科技有限公司;PBS缓冲液、牛血清白蛋白(BSA蛋白)等其他常规药品及试剂均为国产分析纯。
1.3 仪器与设备
THZ-D型恒温振荡器 江苏太仓市强乐实验设备有限公司;无菌工作台 上海三发科技有限公司;微量台式冷冻离心机 美国Thermo Fisher Scientif c公司;高速台式离心机 上海安亭科学仪器厂;J-26XP落地式高速冷冻离心机 德国Beckman Coulter公司;LDZX-50FB立式压力蒸汽灭菌器 上海申安医疗器械厂;U-3900紫外-可见分光光度计 日本Hitachi公司;梯度PCR自动系列化分析仪 东盛国际贸易有限公司;DYY-6C型电泳仪 北京六一仪器厂;JS-6800全自动凝胶成像分析仪 上海培清科技有限公司;JY92-Ⅱ超声波细胞粉碎机 宁波新艺超声设备有限公司;AKTA蛋白纯化系统美国GE公司;SpectraMax M2e 酶标仪 美国Molecular Devices公司。
1.4 方法
1.4.1 His-N2蛋白的制备
首先使用1mmol/L 的IPTG对融合有NP_785232蛋白N端两个特定结构域基因pET30a/N2重组质粒的E.coli Rosetta(DE3)表达菌株进行诱导表达,然后使用HisTrap HP亲和色谱柱进行初步分离后再使用Sephadex G-25填料对两种分子质量不同的蛋白进行分离,最后使用HiTrapTMDesalting 5mL柱将分离获得的较高纯度的His-N2蛋白缓冲液置换为0.01mol/L 的PBS缓冲液。使用BCA蛋白定量试剂盒测定所制备蛋白溶液的质量浓度,用直径为0.22μm的滤膜过滤除菌后进行1mL分装,置于-80℃保存备用。
1.4.2 猪肠黏液的制备与固定
选取健康并即将宰杀的中年猪(9月龄),宰杀前禁食2 h,宰杀后迅速剖开腹腔,将猪的小肠取出,其中包括十二指肠、空肠和回肠,剪开肠壁并用预冷的无菌生理盐水冲洗2 次,然后用干净的载玻片轻轻刮取肠黏膜层上的黏液,转移至无菌的0.01 mol/L PBS缓冲液中混匀。4 ℃、13 000 r/min离心10 min去除细胞和组织碎片,取上清液,用等体积的石油醚去脂3 次,然后依次用直径为0.45、0.22 μm的滤膜过滤除菌。使用BCA蛋白定量试剂盒测定所制备黏液中的蛋白浓度,适当分装后于-80 ℃保存备用[15]。
猪肠黏液的固定[16]:在96 孔细胞培养板中,每孔加入100 μL已制备好的猪肠黏液,4 ℃固定16 h。
猪肠黏液固定效果的检测:将4 ℃固定16 h的猪肠黏液在37 ℃预温30 min后,吸弃未被固定的猪肠黏液,轻轻加入100 μL PBS缓冲液洗涤1 次,再加入100 μL 1%的Triton X-100室温裂解10 min,同时以未固定猪肠黏液的细胞培养板空孔作为对照。选取适当稀释梯度使用BCA蛋白定量试剂盒测定裂解液的蛋白质量浓度,每组做3 次重复实验。
1.4.3 蛋白质质量浓度的测定
蛋白质质量浓度标准曲线的绘制参考BCA蛋白定量试剂盒说明书。根据测得的样品吸光度,在标准曲线上查得并计算出制备的His-N2蛋白溶液和猪肠黏液中蛋白质量浓度。
1.4.4 菌株培养
吸取50μL活化的大肠杆菌DH5α菌悬液(1%接种量)于5 mL LB液体培养基中,37 ℃、200 r/min振荡培养16 h后,4 ℃、12 000 r/min离心5 min收集菌体,用PBS缓冲液洗涤菌泥2 次后再用PBS缓冲液重新悬浮菌体,将菌体浓度调整到1×108CFU/mL左右用于黏附实验。
1.4.5 不同孵育时间对大肠杆菌DH5α黏附量的影响
将已固定猪肠黏液的96 孔细胞培养板和大肠杆菌DH5α菌悬液置于37 ℃预温30 min;吸弃未被固定的猪肠黏液,轻轻加入100 μL PBS缓冲液洗涤1 次,然后每孔加入100 μL已调整好浓度的菌悬液,37 ℃分别孵育15、30、45、60、90、120、180 min,每个孵育时间做3次重复实验;孵育到设定的时间后,吸弃残留菌液,然后用PBS缓冲液轻轻洗涤6 次(100 μL/次)以去除未黏附的菌体;向每孔中加入200 μL 1%的Triton X-100室温裂解10 min;用PBS缓冲液对细胞裂解液进行10 倍连续梯度稀释;选取适当梯度的稀释液进行涂布LB琼脂平板以对大肠杆菌DH5α进行培养和计数(人工计数,选取菌落数在30~300左右的平板记录数据),每个梯度稀释液做3 次重复实验,每次取100 μL稀释液进行涂布,37 ℃培养过夜。大肠杆菌DH5α的黏附量以(CFU/mL)表示。
1.4.6 His-N2蛋白对大肠杆菌DH5α黏附的排除抑制作用实验
His-N2蛋白、大肠杆菌DH5α和猪肠黏液三者之间的相互作用方式有3 种:竞争抑制、排除抑制和替换。本实验主要研究二者之间的排除抑制作用,操作步骤如下:将已固定猪肠黏液的96 孔细胞培养板、0.01 mol/L PBS缓冲液、BSA蛋白溶液、His-N2蛋白溶液以及大肠杆菌DH5α菌悬液置于3 7 ℃下预温30 min;吸弃未被固定的猪肠黏液,轻轻加入100 μL PBS缓冲液洗涤1 次,然后按照表1进行加样,每组做3次重复实验,加样完毕,37 ℃孵育1 h;吸弃多余溶液,向每孔中加入100 μL菌悬液,37 ℃孵育1 h;之后操作步骤同1.4.5节。

表1 排除抑制实验的分组及加样Table1 Sample groups used in exclusive inhibition tests
分别配制pH值为6.6和7.5的0.01mol/L的PBS缓冲液,灭菌后用于制备His-N2蛋白溶液、猪肠黏液、菌悬液以及与His-N2蛋白溶液浓度相同的BSA蛋白溶液,按照上述方法进行排除抑制实验。大肠杆菌DH5α的黏附量以±s表示。

式中:A0为加入PBS缓冲液或BSA蛋白溶液的对照组黏附的大肠杆菌DH5α数量/(CFU/mL);A1为加入His-N2蛋白溶液的实验组黏附大肠杆菌DH5α的数量/(CFU/mL)。
2 结果与分析
2.1 His-N2重组蛋白的制备
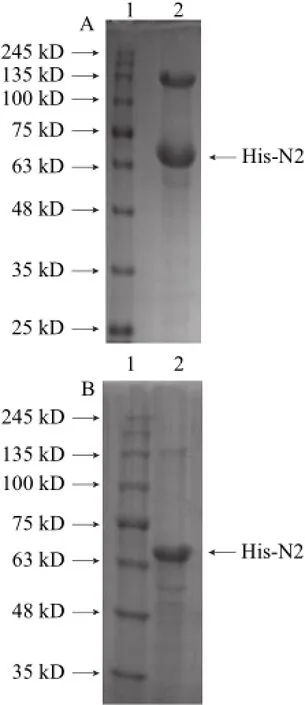
图1 经HisTrap HP亲和色谱柱(A)和Sephadex G-25填料(B)纯化后得到的蛋白溶液SDS-PAGE电泳结果Fig.1 SDS-PAGE analysis of purified protein by HisTrap affinity chromatography (A) and Sephadex G-25 (B)
由图1A可知,分离获得的蛋白溶液中主要有两种分子质量不同的蛋白,第1条带为分子质量在135 kD左右的蛋白,第2条带为质谱鉴定正确的His-N2蛋白。再使用Sephadex G-25填料对这两种分子质量不同的蛋白进行分离后,SDS-PAGE电泳分析结果如图1B所示。经蛋白质Marker比对,泳道2中主要含有分子质量为63~75 kD的His-N2蛋白,这说明经Sephadex G-25填料装填的分离柱再分离后可获得较高纯度的His-N2蛋白。
2.2 His-N2蛋白溶液和猪肠黏液蛋白含量的测定
根据蛋白含量标准曲线获得回归方程为:y= 21.66x-0.529(R2=0.997)。根据方程及所测得的样品的A562nm可得制备的His-N2蛋白溶液蛋白含量为3.9 mg/mL,制备的猪肠黏液蛋白含量为1.4 mg/mL,将猪肠黏液4 ℃固定16 h再37 ℃预温30 min后,96 孔细胞培养板中每孔含有5.29 μg蛋白,可说明猪肠黏液蛋白已被固定。
2.3 不同孵育时间对大肠杆菌DH5α黏附量的影响
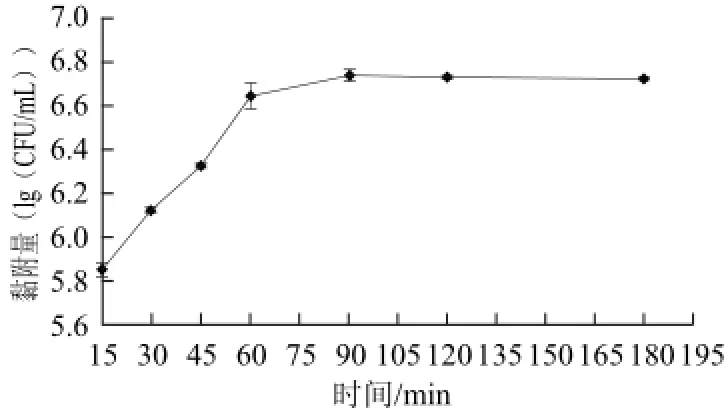
图2 不同孵育时间对大肠杆菌DH5α黏附量的影响Fig.2 Effect of incubation time on the adhesion of E. coli DH5α
如图2所示,大肠杆菌DH5α对猪肠黏液的黏附量随着孵育时间的延长而增加,黏附量趋于饱和的孵育时间为90min。大肠杆菌DH5α对猪肠黏液的最大黏附量约为5.5×106CFU/mL。
2.4 His-N2蛋白对大肠杆菌DH5α黏附的排除抑制作用
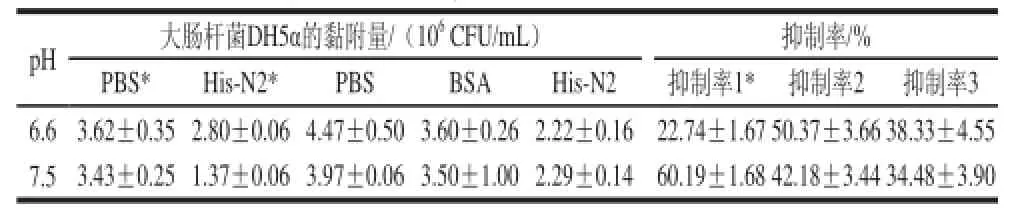
表2 His-N2蛋白对大肠杆菌DH5黏附的抑制率Table2 Inhibition rates of E. coollii DDHH55α adhesion to porcine intestinal mucus by His-N2 protein
由表2可知,无论固定猪肠黏液与否,在两个pH值条件下,相对于阴性对照组和阳性对照组,His-N2蛋白均对大肠杆菌DH5α的黏附有明显抑制作用。
3 讨 论
随着经济和社会的迅速发展,人们在不断提高生活水平的同时也更加注重自身的健康状况。医学也从治疗为主发展到预防为主,进而到现在的保健医学。人们开始渐渐形成提前预防、无病保健的意识。此外,近年来由于抗生素等药物在预防和治疗人及动物传染病上的不规范使用而引起的胃肠道功能紊乱以及致病菌的耐药性增强和动物产品药物残留等问题引发了人们的广泛关注,因此,寻求并开发对动物及人类安全有效,对环境绿色无污染的抗生素替代品已迫在眉睫。乳酸杆菌作为人和动物消化道中的正常微生物菌群之一,除了能直接食用、对环境无污染外,还具有维持和改善肠道微生态体系的平衡、抑制致病菌的黏附和定殖以及提高机体免疫力等益生功能,是一种理想的绿色生物添加剂。
目前,乳酸杆菌的益生作用已被广泛研究和证实,但人们对其益生机制仍不太清楚。不少研究报道,乳酸杆菌能抑制致病菌对细胞和宿主肠道的黏附,如唾液乳酸杆菌(Lactobacillus salvarius)CTC2197可竞争抑制肠炎沙门氏菌C-114在来亨鸡肠道内的定植和繁殖[17],L. rhamnosus GG和L. casei Shirota能竞争和排除抑制肠道致病菌对人肠黏膜糖蛋白和Caco-2细胞的黏附,但是置换的效率却比较低,且抑制程度因菌株而异[13]。这些研究只是初步揭示了乳酸杆菌的益生机制,其抑制致病菌黏附的具体机制,即发挥抑制作用的乳酸杆菌相关结构及作用方式仍有待进一步研究。
陈雪燕[12]研究了卷曲乳酸杆菌ZJ001的耐强酸和胆盐的能力,对体外培养细胞的黏附能力、对病原菌的抑制能力以及其菌体表面S-层蛋白的结构和功能,结果表明S-层蛋白参与了L. crispatus ZJ001黏附HeLa细胞的过程,并在拮抗鼠伤寒沙门氏菌和大肠杆菌O157∶H7的黏附过程中发挥了重要作用。尽管如此,目前国内外还鲜有报道体外模拟肠道环境,并通过外源表达乳酸杆菌表面蛋白以研究其在抑制病原菌黏附过程中作用的报道。据文献报道[18-20],十二指肠pH值一般为6.63±0.53,空肠pH值一般为7.41±0.36,回肠pH值一般为7.49±0.46,结肠pH值一般为6.63±0.67。由于猪肠结构与人体小肠结构非常相似[21]。因此,本实验在体外模拟肠道环境时,选择使用猪肠黏液,环境温度设置为37℃、pH值为6.6和7.5。
本实验以植物乳杆菌KLDS1.0320候选表面黏附蛋白NP_785232 N端前两个结构域组成的融合蛋白(His-N2蛋白)为研究对象,通过体外模拟肠道环境,研究了His-N2蛋白对大肠杆菌DH5α黏附猪肠黏液的排除抑制作用,在两个pH值条件下,无论固定猪肠黏液与否,His-N2蛋白的加入均降低了大肠杆菌DH5α的黏附量;除pH值为6.6条件下固定猪肠黏液加入His-N2蛋白的实验组外,其余实验组均是pH值为6.6时,大肠杆菌DH5α的黏附量高于pH值为7.5的相应实验组。这一结果可能与乳酸杆菌的嗜酸性有关,暗示其表面蛋白可能在酸性和碱性条件下具有不同的空间构象,从而影响了His-N2重组蛋白对大肠杆菌的排除抑制作用,这一推理期待通过以后应用差示扫描量热仪等进一步的实验手段进行确认。
综上,本实验结果表明His-N2蛋白在体外实验能有效抑制大肠杆菌DH5α对猪肠黏液的黏附,但鉴于动物肠道结构及肠道菌群的复杂性,His-N2蛋白在体内真实环境中能否有效抑制大肠杆菌DH5α对猪肠黏液的黏附还有待进一步研究。本实验结果为深入探索植物乳杆菌KLDS1.0320候选表面黏附蛋白NP_785232的功能及乳酸杆菌的益生机制提供了参考。
参考文献:
[1] BLUM S, SCHIFFRIN E J. Intestinal microf ora and homeostasis of the mucosal immune response: implications for probiotic bacteria[J]. Current Issues in lntestinal Microbiology, 2003, 4: 53-60.
[2] MARTIN F P, WANG Y, SPRENGER N, et al. Effects of probiotic Lactobacillus paracasei treatment on the host gut tissue metabolic profiles probed via magic-angle-spirnning NMR spectroscopy[J]. Journal of Proteome Research, 2007, 6: 1471-1481.
[3] CARRERA-SILVA E A, SILVESTRONI A, LEBLANC J G, et al. A thermostable alpha-galactosidase from Lactobacillus fermentum CRL722: genetic characterization and main properties[J]. Current Microbiology, 2006, 53: 374-378.
[4] 宋良敏. 复合微生态制剂在养猪生产上的应用研究[D]. 北京: 中国农业科学院, 2012.
[5] DANIEL C, POIRET S, GOUDERCOURT D, et al. Selecting lactic acid bacteria for their safety and functionality by use of a mouse colitis model[J]. Applied and Environmental Microbiology, 2006, 72(9): 5799-5805.
[6] 张瑛. 益生菌对体外循环心脏直视手术患者肠黏膜屏障功能的影响[D]. 大连: 大连医科大学, 2010.
[7] 邱志兵. 转基因乳酸杆菌联合5-氨基水杨酸对实验性结肠炎小鼠肠道炎症及免疫调节影响的研究[D]. 上海: 复旦大学, 2011.
[8] GALDEANO C M, PERDIGON G. The probiotic bacterium Lactobacillus casei induces activation of the gut mucosal immune system through innate immunity[J]. Clinical and Vaccine Immunology, 2006, 13: 219-226.
[9] LEE H S, HAN S Y. Lactic acid bacteria inhibit proinflammatory cytokine expression and bacterial glycosaminoglycan degradation activity in dextran sulfate sodium-induced colitic mice[J]. International Immunopharmacology, 2008, 8: 574-580.
[10] VIZOSO PINTO M G, SCHUSTER T, BRIVIBA K, et al. Adhesive and chemokine stimulatory properties of potentially probiotic Lactobacillus strains[J]. Journal of Food Protection, 2007, 70: 125-134.
[11] CUON H, CHO I B, LEE E, et al. Immunomodulatory effects of specific bacterial components of Lactobacillus plantarum KFCC11389P on the murine macrophage cell line RAW 264.7[J]. Journal of Applied Microbiology, 2009, 107(5): 1588-1597.
[12] 陈雪燕. 卷曲乳酸杆菌ZJ001 S-层蛋白基因结构及其表达产物的黏附和锚定功能研究[D]. 杭州: 浙江大学, 2007.
[13] LEE Y K, PUONG K Y, OUWEHAND A C, et al. Displacement of bacterial pathogens from mucus and Caco-2 cell surface by lactobacilli[J]. Journal of Medical Microbiology, 2003, 52: 925-930.
[14] 汪海峰, 章文明, 汪以真, 等. 乳酸杆菌与肠道黏附相关表面因子及其机制的研究进展[J]. 动物营养学报, 2011, 23(2): 179-186.
[15] 曾东, 王益平, 倪学勤, 等. 几株益生菌对鲤前肠黏液的体外黏附特性[J]. 水产学报, 2010, 34(1): 147-152.
[16] VESTERLUND S, PALTTA J, KARP M, et al. Measurement of bacterial adhesion: in vitro evalution of different methods[J]. Journal of Microbiological Methods, 2005, 60: 225-233.
[17] PASCUAL M, HUGAS M, BADIOLA J L, et al. Lactobacillus salivarius CTC2197 prevents Salmonella enteritidis colonization in chickens[J]. Applied and Environmental Microbiology, 1999, 65: 4981-4986.
[18] EVANS D F, PYE G, BRAMLEY R, et al. Measurement of gastrointestinal pH profiles in normal ambulant human subjects[J]. Gut, 1988, 29(8): 1035-1041.
[19] PETER J, WATTS, LISBETEE I. Colonic drug delivery[J]. Drug Development and Industrial Pharmacy, 1997, 23(9): 893-9131.
[20] 魏科达. 纳米碳酸钙肠溶生物黏附片的制备及其驱铅效果研究[D].长沙: 中南大学, 2010.
[21] ZHANG Quanshun, WIDMER G, TZIPORI S. A pig model of the human gastrointestinal tract[J]. Gut Microbes, 2013, 4(3): 193-200.
in vitro Exclusive Inhibition of E. coli DH5α Adhesion to Porcine Intestinal Mucus by His-N2 Protein
DU Li-hui, ZHANG Hong, SHI Rong-hua, HE Xiao-ying, LIU Qin
(Jiangsu Key Laboratory of Quality Control and Further Processing of Cereals and Oils, College of Food Science and Engineering, Nanjing University of Finance and Economics, Nanjing 210023, China)
His-N2 protein, consisting of two domains at the N terminus of Lactobacillus plantarum KLDS 1.0320 adhesion surface protein NP_785232, was selected as the candidate in this work. This protein was used to explore the exclusive inhibition against E. coli DH5α adhesion to porcine intestinal mucus in vitro. First, porcine mucus was f xed on 96-well cell plates and incubated at 37 ℃ for 1 h after adding His-N2 protein, and then the solution containing E. coli DH5α was added. After co-incubation at 37 ℃ for 1 h, the mucus was washed and disrupted with 1% Triton X-100. Ten-fold dilutions of the cell lysates were prepared and spread on LB agar plates for counting of E.coli DH5α. Results indicated that His-N2 protein could inhibit the adhension of E. coli DH5α to porcine intestinal mucus by (50.37 ± 3.66)% compared with PBS and by (38.33% ± 4.55)% compared with BSA protein at pH 6.6, while the inhibitory rates were (42.18 ± 3.44)% and (34.48 ± 3.90)% at pH 7.5, respectively. Therefore, His-N2 protein is involved in the exclusive inhibition of E. coli DH5α adhersion to porcine intestinal mucus in vitro.
Lactobacillus plantarum; His-N2 protein; E. coli DH5α; porcine mucus; exclusive inhibition
TS201.3
A
1002-6630(2014)11-0095-05
10.7506/spkx1002-6630-201411019
2013-07-22
国家自然科学基金青年科学基金项目(31101338);江苏省高校自然科学基金面上项目(11KJB550002);南京财经大学研究生创新研究项目(M12067)
都立辉(1981—),男,副教授,博士,研究方向为食品微生物与生物技术。E-mail:ddabc_2000@163.com

