酿酒条件对两株商业酿酒酵母β-葡萄糖苷酶的影响
张方方,江 璐,刘延琳,2,*
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.陕西省葡萄与葡萄酒工程技术研究中心,陕西 杨凌 712100)
酿酒条件对两株商业酿酒酵母β-葡萄糖苷酶的影响
张方方1,江 璐1,刘延琳1,2,*
(1.西北农林科技大学葡萄酒学院,陕西 杨凌 712100;2.陕西省葡萄与葡萄酒工程技术研究中心,陕西 杨凌 712100)
研究酿酒条件(氧气、pH值、温度、糖和乙醇等)对两株商业酿酒酵母β-葡萄糖苷酶的影响。结果显示:氧气促进酵母β-葡萄糖苷酶的合成,两株商业酿酒酵母完整细胞的β-葡萄糖苷酶最适pH值为5.0,最适温度为60℃,果糖、葡萄糖和蔗糖对两株酿酒酵母完整细胞的β-葡萄糖苷酶活性具有轻微抑制作用,乙醇(体积分数2%~20%)促进β-葡萄糖苷酶的酶活力。在葡萄酒发酵过程中,β-葡萄糖苷酶主要存在于完整细胞和透性化细胞中,上清液中酶较少。
酿酒酵母;β-葡萄糖苷酶;葡萄汁发酵
香气是葡萄酒重要特征之一,葡萄汁、葡萄酒中许多香气成分(如里那醇、里那醇氧化物、香叶醇、橙花醇、香茅醇、α-萜品醇等)是以糖苷形式存在的。β-葡萄糖苷酶(β-Glucosidase,EC3.2.1.21)又称β-D-葡萄糖苷水解酶,是糖苷水解的关键酶[1],在微生物(如细菌、酵母和霉菌)中广泛存在,也存在于植物中,主要用于增强葡萄酒、啤酒和果汁的感官特性,特别是香气[2-3]。β-葡萄糖苷酶水解糖苷,释放挥发性糖苷配基,如萜烯醇,增加葡萄酒香气。葡萄中含有单糖苷和二糖苷,二糖苷的水解,首先在α-L-鼠李糖苷酶、α-L-阿拉伯糖苷酶或β-D-洋芹糖苷酶作用下切断相应二糖苷的糖苷键,形成β-D-葡萄糖单糖苷,然后在β-葡萄糖苷酶的作用下释放挥发性物质[4]。β-葡萄糖苷酶是糖苷水解的关键酶[5],因此大部分研究主要集中于β-葡萄糖苷酶[2,6-7]。
在葡萄酒酿造过程中,β-葡萄糖苷酶主要来自于葡萄[8]和参与葡萄酒发酵的微生物(如酵母[9]和乳酸菌[10]),但在酿酒条件下葡萄自身合成的酶几乎没有活性。酿酒酵母能合成β-葡萄糖苷酶[11],但葡萄酒的发酵是一个厌氧的过程,因此氧气影响酵母合成β-葡萄糖苷酶。在葡萄酒发酵的过程中,pH值、温度、糖、乙醇等因素同样影响酿酒酵母的β-葡萄糖苷酶的活性,研究发现在这些条件下β-葡萄糖苷酶的酶活低,甚至没有酶活[12]。目前,对酿酒酵母β-葡萄糖苷酶的研究较少[13-15],尤其在发酵过程中酵母产β-葡萄糖苷酶[16-17]方面。本实验主要研究不同的酿酒条件对两株商业酿酒酵母RC212和VL1的β-葡萄糖苷酶的影响,以及酿酒过程中酵母产β-葡萄糖苷酶的动态变化。
1 材料与方法
1.1 材料与试剂
商业酿酒酵母RC212和VL1。
宁夏御马酒厂霞多丽葡萄汁,含糖量200 g/L、总酸6.88 g/L(酒石酸计),pH 3.89。
pNPG(4-nitrophenyl β-D-glucopyranoside,≥98%(TLC))、咪唑(≥98.5%) 美国Sigma公司;柠檬酸、磷酸氢二钠、碳酸钠、葡萄糖、蔗糖 天津博迪化工股份有限公司;还原态谷胱甘肽(≥98%)、Triton X-100(试剂级) 美国Amresco公司;甲苯、乙醇(分析纯) 西安三浦化学试剂有限公司;果糖(分析纯) 北京索莱宝科技有限公司。
YPD液体培养基:葡萄糖20 g/L、蛋白胨20 g/L、酵母粉10 g/L,pH 5.0;WL固体培养基:酵母浸粉4 g/L、蛋白胨5 g/L、葡萄糖50 g/L、磷酸二氢钾0.55 g/L、氯化钾0.425 g/L、氯化钙0.125 g/L、硫酸镁0.125 g/L、氯化铁0.002 5 g/L、硫酸锰0.002 5 g/L、溴甲酚绿22 mg/L、琼脂20 g/L,pH 6.5。培养基灭菌条件:121℃、20 min。
1.2 仪器与设备
MJPS-250型霉菌培养箱、DHG-9071A鼓风干燥箱、DK-S22电热恒温水浴锅 上海精宏实验设备有限公司;FRESC017型高速冷冻离心机 美国Thermo公司;UV1800紫外-可见分光光度计 日本岛津公司。
1.3 方法
1.3.1 菌株活化与培养
取100 μL、-20 ℃保存的菌种接种至5 mL YPD液体培养基中,28 ℃、150 r/min活化24 h。活化的菌株接种至含有1/5体积的YPD (pH 5.0)液体培养基的三角瓶中,接种量为体积分数1%,28 ℃、180 r/min,培养24 h后取样,每个样品重复2次。
1.3.2 样品处理
上清液:取1 mL菌液,10 000×g、4 ℃离心10 min,取0.2 mL上清液,测定上清液中的酶活力。
完整细胞:取1 mL菌液,10 000×g、4 ℃离心10 min,菌体用1 mL冷却无菌水洗2次,加入0.2 mL pH 5.0、0.1 mol/L柠檬酸-磷酸缓冲溶液,所得菌液用于测定完整细胞的酶活力。
透性化细胞:取1 mL菌液,10 000×g、4 ℃离心10 min,菌体用1 mL冷却无菌水洗2次,加1 mL 0.075 mol/L pH 7.5咪唑缓冲溶液,迅速加0.05 mL 0.3 mol/L谷胱甘肽,0.01 mL质量分数10% triton X-100,0.05 mL甲苯-乙醇(体积比1∶4),剧烈振荡5 min,10 000×g、4 ℃离心10 min,得到的菌体用1 mL冷却无菌水洗2次,加入0.2 mL pH 5.0柠檬酸-磷酸缓冲溶液,用于透性化细胞酶活力(酵母的胞内酶)分析[12]。
细胞干重:取4 mL菌液,10 000×g离心10 min,用冷却的无菌水洗2次,105 ℃烘至恒质量,分析天平称质量。
1.3.3 β-葡萄糖苷酶酶活力测定
分别取0.2 mL上清液、完整细胞液和透性化细胞液,加入0.2 mL pNPG(5 mmol/L溶于pH 5.0柠檬酸-磷酸缓冲液中),30 ℃水浴反应1 h后,加入pH 10.2、0.2 mol/L碳酸钠缓冲溶液终止反应,400 nm波长测定吸光度[12]。β-葡萄糖苷酶的酶活力单位为在1 h内1 mL上清液中反应生成对硝基苯酚量(ømol)或每小时每毫克干细胞质量中生成的对硝基苯酚量(ømol),即μmol/(mL·h)和μmol/(mg·h)。
1.3.4 酿酒条件对完整细胞β-葡萄糖苷酶的影响
1.3.4.1 氧气
有氧培养:按1%接种量,将活化的菌株培养液接种至含有1/5体积YPD液体培养基(pH 5.0)的三角瓶,28 ℃、180 r/min培养24 h;厌氧培养:按相同接种量接种至含有80%体积YPD液体培养基(pH 5.0)的离心管中厌氧静止培养3 d,分别取样测定完整细胞的酶活力,每个样品重复测定2次。
1.3.4.2 pH值
在30 ℃条件下,pH值分别为3.0、3.4、4.0、4.4、5.0、5.4、6.0、6.4、7.0的柠檬酸-磷酸缓冲溶液中测定完整细胞β-葡萄糖苷酶的酶活力,每个样品重复测定2次。
1.3.4.3 温度
在pH 5.0柠檬酸-磷酸缓冲液中,分别在15、20、25、30、35、40、45、50、60、70 ℃温度下测定两株商业酿酒酵母完整细胞的酶活力,每个样品重复测定2次。
1.3.4.4 糖
在pH 5.0柠檬酸-磷酸缓冲溶液中,果糖、葡萄糖和蔗糖质量浓度分别为0、20、40、80、120、160、200 g/L,30 ℃测定完整细胞的酶活力,每个样品重复测定2次。
1.3.4.5 乙醇
在pH 5.0的柠檬酸-磷酸缓冲溶液中,分别加入体积分数0%、2%、4%、8%、12%、16%、20%的乙醇,30 ℃测定完整细胞的酶活力,每个样品重复测定2次。
1.3.5 葡萄酒微型发酵
将活化的商业酿酒酵母RC212、VL1接种至400 mL经巴氏杀菌(70 ℃保持20 mim,然后降至室温,每天一次,连续3 d)的葡萄汁中,接种量为106cells/mL(血球计数法计数),18 ℃静止发酵,每个样品重复测定2次。监测发酵过程中CO2失重、酵母细胞数量的变化、酵母产β-葡萄糖苷酶(上清液、完整细胞和透性化细胞)。CO2失重连续3 d不变说明发酵结束,每个样品重复测定2次。不同部位酵母的β-葡萄糖苷酶的量表示为每小时1 mL菌液中反应生成的对硝基苯酚的ømol数。
2 结果与分析
2.1 氧气对酵母产酶的影响

表1 氧气对酵母产β-葡萄糖苷酶的影响Table 1 Effect of oxygen onβ-glucosidase activity from Saccharomyces cereviissiiaaee
由表1可知,氧气对酵母不同部位的β-葡萄糖苷酶的影响不同,氧气对上清和透性化细胞中酶活力有显著影响。厌氧条件下,RC212与VL1的上清液中酶活分别降低了22.20%和27.89%,透性化细胞中的酶活分别降低了33.00%和49.07%。而氧气对完整细胞酶活的影响不同,厌氧条件下RC212完整细胞中酶活增加了32.04%,而对VL1完整细胞中酶活的影响不显著,整体而言,氧气促进酵母产酶。
2.2 pH值对完整细胞酶活力的影响
pH值对完整细胞的β-葡萄糖苷酶活性的影响如图1所示,以最高值为100.00%,两株商业酿酒酵母的变化趋势基本上一致,pH5.0时酶活力最高,因此最适pH值为5.0。pH值为3.4~4.0时,RC212完整细胞的相对酶活力为31.80%~60.73%,VL1完整细胞的相对酶活力为40.08%~69.92%。其他一些研究也证明了低pH值对β-葡萄糖苷酶酶活力具有抑制作用[18]。

图1 pH值对酵母完整细胞β--葡萄糖苷酶酶活力的影响Fig.1 Effect of pH on β-glucosidase activity in whole cells
2.3 温度对完整细胞酶活力的影响
pH 5.0条件下,不同反应温度(15~70 ℃)对酶活力的影响结果如图2所示,以30 ℃的酶活为100.00%。60 ℃时,两株商业酿酒酵母完整细胞的β-葡萄糖苷酶酶活力最高,RC212与VL1的相对酶活力分别为275.00%和248.00%;20 ℃时,RC212与VL1的相对酶活力分别为43.64%和43.74%。随着温度的升高酶活力逐渐升高,温度超过60 ℃后急剧下降,这种现象可能是由于温度的升高增加酶的反应速度,但温度过高导致蛋白质变性从而酶活力迅速降低。
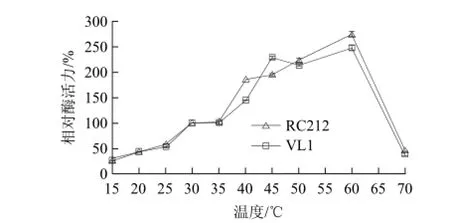
图2 温度对酵母完整细胞β-葡萄糖苷酶活力的影响Fig.2 Effect of temperature on β-glucosidase activity in whole cells
2.4 糖对完整细胞酶活力的影响
葡萄汁中的糖(果糖、葡萄糖和蔗糖)对β-葡萄糖苷酶的酶活抑制现象十分普遍,不仅抑制酿酒酵母的β-葡萄糖苷酶活力,对非酿酒酵母、黑曲霉的β-葡萄糖苷酶也有抑制作用[18-20]。果糖、葡萄糖和蔗糖对酵母完整细胞β-葡萄糖苷酶活性的影响如图3所示,以不添加糖时酵母的相对酶活力为100.00%。糖对β-葡萄糖苷酶活性的抑制作用强弱稍有不同,葡萄糖抑制作用最强,特别是对RC212。葡萄汁中葡萄糖和果糖大约各占50%,果糖、葡萄糖和蔗糖含量为120 g/L时,RC212完整细胞的β-葡萄糖苷酶的相对酶活力分别为66.01%、63.25%和66.12%,VL1完整细胞的相对酶活力为75.11%、71.02%和74.36%。

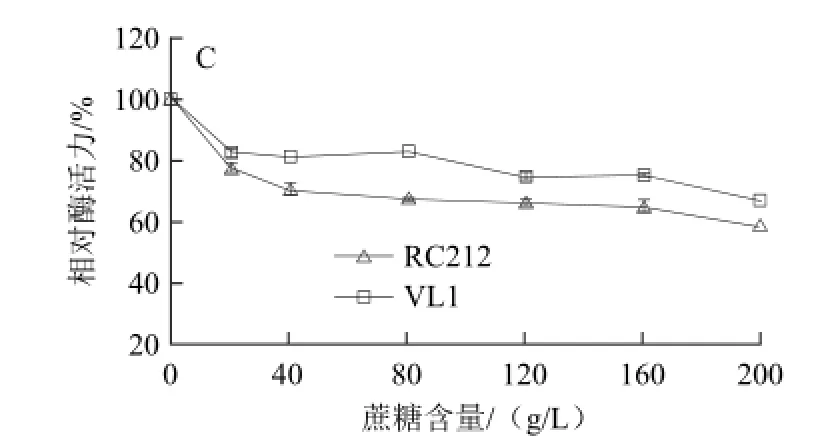
图3 果糖(A)、葡萄糖(B)、蔗糖(C)对完整细胞β-葡萄糖苷酶活力的影响Fig.3 Effects of fructose (A), glucose (B) and sucrose (C) concentrations on β-glucosidase activity in whole cells
2.5 乙醇对完整细胞酶活力的影响
乙醇既能抑制酵母的β-葡萄糖苷酶活性[19],也能促进其活性。乙醇对酵母β-葡萄糖苷酶活性的影响如图4所示,以不添加乙醇时β-葡萄糖苷酶的相对酶活力为100.00%。乙醇体积分数为12%时,RC212和VL1完整细胞的酶活力分别增加19.39%和25.86%,乙醇体积分数为20%时,RC212和VL1完整细胞的酶活力分别增加30.33%和23.84%,乙醇对酶的这种影响对葡萄酒的酿造有重要意义。乙醇体积分数范围在2%~20%时,VL1完整细胞的酶活力逐渐升高,乙醇体积分数在16%时,酶活力达到最高,随后稍有下降,可能是由于乙醇导致酶结构的变化,引起酶活性部位的变化,从而降低其活力[20]。乙醇促进β-葡萄糖苷酶的活性可能是由于酶固定在酵母的细胞膜上,酶的内部结构和酶活部位或酶自身的保护机制减少蛋白质的解折叠率[21];β-葡萄糖苷酶具有糖基转移酶活性,乙醇具有亲核性,可以作为糖基转移时的中间受体,导致酶活力的增加[22-23];较高的乙醇含量可能改变膜透性,使底物与胞内酶作用[24]。
2.6 葡萄酒微型发酵
RC212、VL1分别是红、白葡萄酒发酵常用的商业酿酒酵母,利用二氧化碳的失重监测酵母的发酵情况,结果如图5A所示。这两株酿酒酵母的发酵力相似,RC212、VL1分别在17、15 d发酵结束。发酵过程中酵母数量的变化如图5B所示,酵母细胞数量在3 d后达到稳定期,发酵末期酵母数量仍然能保持较高水平。
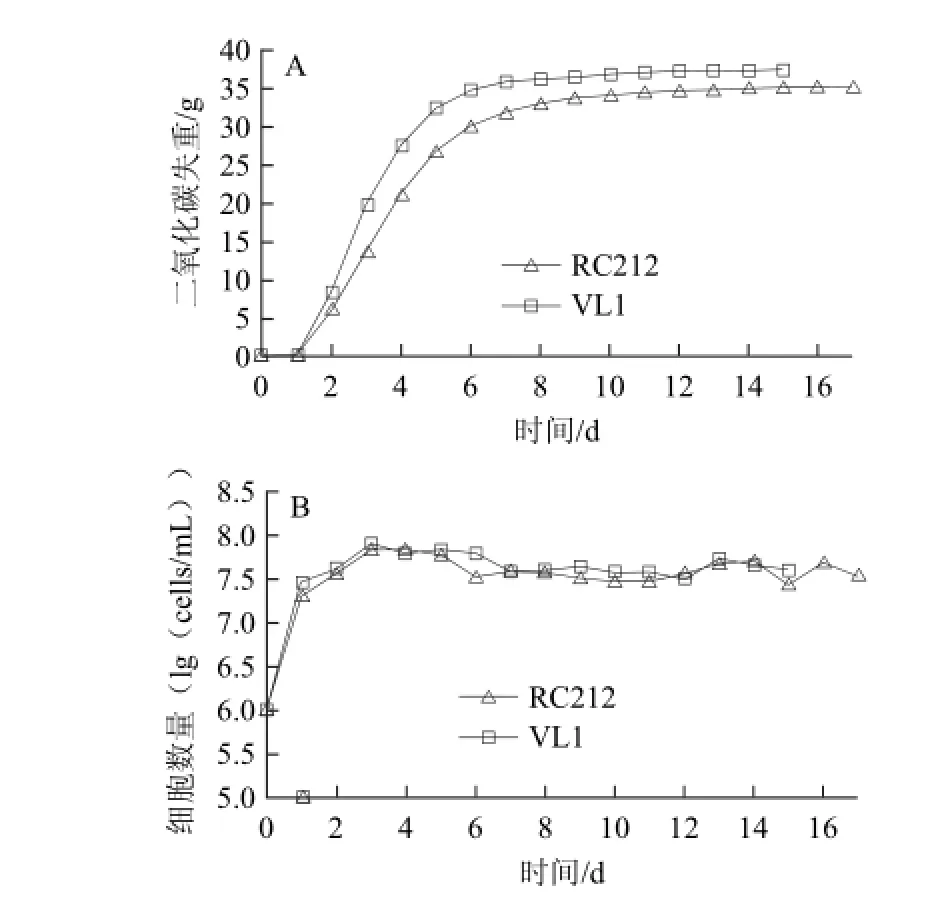
图5 葡萄汁发酵过程中发酵速率(A)及酵母细胞数(B)的变化Fig.5 Fermentation kinetics (A) and yeast population (B) during grape juice fermentation

图6 葡萄汁发酵过程中上清液(A)、完整细胞(B)及透性化细胞(CC)中β-葡萄糖苷酶酶量的变 化Fig.6 Changes in β-glucosidase activity in supernatant (A), whole cells (B) and permeabilized cells (C) during grape juice fermentation
发酵过程中β-葡萄糖苷酶酶量的变化如图6所示,两株酵母β-葡萄糖苷酶的变化趋势基本相似,上清液中的酶在发酵48h时,达到产酶高峰(图6A),RC212与VL1上清中的最大值分别为0.30、0.32 ømol/(mL·h),随后明显下降,完整细胞(图6B)和透性化细胞(图6C)的产酶高峰分别在发酵的3 d和5 d,RC212与VLI完整细胞β-葡萄糖苷酶酶量最高值分别为1.04、1.07 ømol/(mL·h),透性化细胞中酶量最高值分别为1.34、1.46 ømol/(mL·h)。
酶的生物合成与转移和酵母生长期的代谢有密切关系[25],代谢旺盛、产酶高、酶转移较快。在酵母的指数生长期,上清液的β-葡萄糖苷酶酶量达到最高,这一时期酵母活动旺盛,因此酶的运转也较快,发酵后期,酵母逐渐衰老、产酶降低。发酵过程中上清液、完整细胞和透性化细胞中β-葡萄糖苷酶到达峰值的时期不同,上清液、完整细胞和透性化细胞的产酶最高峰逐渐延后。
3 结 论
在有氧条件下,酵母生长旺盛,氧气促进酵母β-葡萄糖苷酶的合成,在其他研究中,也得到相同的结论[6,12]。两株酿酒酵母RC212和VL1的β-葡萄糖苷酶最适pH值为5.0,最适温度为60 ℃,15~20 ℃时酵母的酶活较低。较低的pH值抑制酵母的β-葡萄糖苷酶活性,pH值为3.4~4.0时,RC212的相对酶活力为31.80%~60.73%,VL1的相对酶活力为40.08%~69.92%。糖对β-葡萄糖苷酶的酶活抑制较弱,乙醇促进β-葡萄糖苷酶的酶活力。温度和pH值是限制β-葡萄糖苷酶活性的主要因素。
在葡萄汁发酵过程中,两株酿酒酵母的β-葡萄糖苷酶主要分布在完整细胞和透性化细胞中,上清液的酶比较少,透性化细胞中的酶是胞内酶,对于糖苷的水解不起作用,只有转移到细胞表面或细胞外才能起作用。在葡萄汁发酵的过程中酿酒酵母虽然能合成β-葡萄糖苷酶,但是葡萄酒发酵过程中氧气、温度、pH值、糖和乙醇都影响β-葡萄糖苷酶酶活。本实验研究了氧气、温度、pH值、糖和乙醇对酵母的β-葡萄糖苷酶活性的影响及发酵过程中β-葡萄糖苷酶的动态变化,但β-葡萄苷酶对葡萄酒香气的影响还需要进一步研究。
[1] PALMERI R, SPAGNA G. β-Glucosidase in cellular and acellular form for winemaking application[J]. Enzyme and Microbial Technology, 2007, 40(3): 382-389.
[2] BAFFI M A, TOBAL T, LAGO J H G, et al. Wine aroma improvement using a β-gucosidase preparation from Aureobasidium pullulans[J]. Applied Biochemistry and Biotechnology, 2013, 169(2): 493-501.
[3] WANG Y, KANG W, XU Y, et al. Effect of different indigenous yeast β-glucosidases on the liberation of bound aroma compounds[J]. Journal of the Institute of Brewing, 2011, 117(2): 230-237.
[4] RIOU C, SALMON J M, VALLIER M J, et al. Purification, characterization, and substrate specificity of a novel hig hly glucosetolerant β-glucosidase from Aspergillus oryzae[J]. Applied and Environmental Microbiology, 1998, 64(10): 3607-3614.
[5] RODR GUEZ M, LOPES C, BROOCK M, et al. Screening and typing of Patagonian wine yeasts for glycosidase activities[J]. Journal of Applied Microbiology, 2004, 96(1): 84-95.
[6] HERNANDEZ L F, ESPINOSA J C, FERNANDEZ-GONZALEZ M, et al. β-Glucosidase activity in a Saccharomyces cerevisiae wine strain[J]. International Journal of Food Microbiology, 2003, 80(2): 171-176.
[7] VILLENA M A, IRANZO J F U, OTERO R R C, et al. Optimization of a rapid method for studying the cellular location of β-glucosidase activity in wine yeasts[J]. Journal of Applied Microbiology, 2005, 99(3): 558-564.
[8] LECAS M, GUNATA Z Y, SAPIS J C, et al. Purification and partial characterization of β-glucosidase from grape[J]. Phytochemistry, 1991, 30(2): 451-454.
[9] PREZ G, FARI A L, BARQUET M, et al. A quick screening method to identify β-glucosidase activity in native wine yeast strains: application of Esculin Glycerol Agar (EGA) medium[J]. World Journal of Microbiology and Biotechnology, 2011, 27(1): 47-55.
[10] MICHLMAYR H, SCH MANN C, BARREIRA BRAZ DA SILVA N, et al. Isolation and basic characterization of a β-glucosidase from a strain of Lactobacillus brevis isolated from a malolactic starter culture[J]. Journal o f Applied Microbiology, 2010,108(2): 550-559.
[11] DELCROIX A, G NATA Z, SAPIS J C, et al. Glycosidase activities of three enological yeast strains during wi nemaking: effect on the terpenol content of Muscat wine[J]. American Journal of Enology and Viticulture, 1994, 45(3): 291-296.
[12] ROSI I, VINELLA M, DOMIZIO P. Characterization of β-glucosidase activity in yeasts of oenological origin[J]. Journal of Applied Microbiology, 1994, 77(5): 519-527.
[13] GIL J V, MANZANARES P, GENOV S S, et al. Over-production of the major exoglucanase of Sa ccharomyces cerevisiae leads to an increase in the aroma of wine[J]. International Journal of Food Microbiology, 2005,103(1): 57-68.
[14] TOSI E, AZZOLINI M, GUZZO F, et al. Evidence of different fermentation behaviours of two indigenous strains of Saccharomyces cerevisiae and Saccharomyces uvarum isolated from Amarone wine[J]. Journal of Applied Microbiology, 2009, 107(1): 210-218.
[15] VERNOCCHI P, NDAGIJIMANA M, SERRAZANETTI D I, et al. Use of Saccharomyces cerevisiae strains endowed with β-glucosidase activity for the production of Sangiovese wine[J]. World Journal of Microbiology and Biotechnology, 2011, 27(6): 1423-1433.
[16] BLASCO L, VEIGA-CRESPO P, POZA M, et al. Hydrolases as markers of wine aging[J]. World Journal of Microbiology and Biotechnology, 2006, 22(11): 1229-1233.
[17] MATURANO Y P, RODRIGUEZ ASSAF L A, TORO M E, et al. Multi-enzyme production by pure and mixed cultures of Saccharomyces and non-Saccharomyces yeasts during wine fermentation[J]. International Journal of Food Microbiology, 2012, 155(1/2): 43-50.
[18] BAFFI M A, TOBAL T, HENRIQUE J, et al. A novel β-glucosidase from Sporidiobolus pararoseus: characterization and application in winemaking[J]. Journal of Food Science, 2011, 76(7): C997-C1002.
[1 9] SWANGKEAW J, VICHITPHAN S, BUTZKE C E, et al. Characterization of β-glucosidases from Hanseniaspora sp. and Pichia anomala with potentially aroma-enhancing capabilities in juice and wine[J]. World Journal of Microbiology and Biotechnology, 2011, 27(2): 423- 430.
[20] BARBAGALLO R N, SPAGNA G, PALMERI R, et al. Selection, characterization and comparison of β-glucosidase from mould and yeasts employable for enological applications[J]. Enzyme and Microbial Technology, 2004, 35(1): 58-66.
[21] S PAGNA G, BARBAGALLO R N, PALMERI R, et al. Properties of endogenous β-glucosidase of a Saccharomyces cerevisiae strain isolated from Sicilian musts and wines[J]. Enzyme a nd Microbial Technology, 2002, 31(7): 1030-1035.
[22] LEITE R S R, ALVES-PRADO H F, CABRAL H, et al. Production and characteristics comparison of crude β-glucosidases produced by microorganisms Thermoascus aurantiacus e Aureob asidium pullulans in agricultural wastes[J]. Enzyme and Microbial Technology, 2008, 43(6): 391-395.
[23] SWANGKEAW J, VICHITPHAN S, BUTZKE C E, et al. The characterisation of a novel Pichia anomala β-glucosidase with potentially aroma-enhancing capabili ties in wine[J]. Annals of Microbiology, 2009, 59(2): 335-343.
[24] PEMBERTON M, BROWN R, EMERT G. The role of β-glucosidase in the bioconversion of cellulose to ethanol[J]. Canadian Journal of Chemical Engineering, 1980, 58(8): 723-729.
[25] FIA G, GIOVANI G, ROSI I. Study of β-glucosidase production by wine-related yeasts during alcoholic fermentation. A new rapid fluorimetric method to determine enzymati c activity[J]. Journal of Applied Microbiology, 2005, 99(3): 509-517.
Effect of Winemaking Conditions on β-Glucosidase Activity from Two Commercial Saccharomyces cerevisiae Strains
ZHANG Fang-fang1, JIANG Lu1, LIU Yan-lin1,2,*
(1. College of Enology, Northwest A&F University, Yangling 712100, China;
2. Shaanxi Engineering Research Center for Viti-viniculture, Yangling 712100, China)
The present study aimed to investigate the effect of vinification environments such as oxygen, pH, temperature, sugar and ethanol on β-glucosidase activity from two commercial Saccharomyces cerevisiae strains. The results showed that aerobic condition stimulated β-glucosidases biosynthesis. The optimal pH and temperature for β-glucosidase activity from the whole cells of both strains were 5.0 and 60 ℃, respectively. β-Glucosidase activity was slightly inhibited by fructose, glucose and sucrose. An ethanol concentration between 2% and 20% could activate β-glucosidase from the two S. cerevisiae strains. During grape juice fermentation, the enzyme was mostly in both whole cells and permeabilized cells, while the activity in the culture supernatant was low.
Saccharomyces cerevisiae; β-glucosidase; grape juice fermentation
TS261.1
A
1002-6630(2014)03-0148-05
10.7506/spkx1002-6630-201403030
2013-03-23
国家自然科学基金项目(31271917);西北农林科技大学基本科研业务费专项(22050205);国家现代农业(葡萄)产业技术体系建设专项(CARS-30-jg-3)
张方方(1984—),女,硕士研究生,研究方向为葡萄酒微生物。E-mail:zhangfangfang8875@163.com
*通信作者:刘延琳(1966—),女,教授,博士,研究方向为酿酒微生物及葡萄-葡萄酒学。E-mail:yanlinliu@nwsuaf.edu.cn

