煮制用水pH值及金属离子对绿豆清汤的影响
陈 然,王 静,万海静,赵建京,范志红*
(中国农业大学食品科学与营养工程学院,北京 100083)
煮制用水pH值及金属离子对绿豆清汤的影响
陈 然,王 静,万海静,赵建京,范志红*
(中国农业大学食品科学与营养工程学院,北京 100083)
采用不同水样煮制绿豆清汤,探究不同煮制用水pH值及Ca2+、Mg2+、Zn2+、Al3+、Fe2+5种金属离子对绿豆清汤pH值、颜色及1,1-二苯基-2-三硝基苯肼(2,2-diphenyl-1-picrylhydrazyl,DPPH)自由基清除能力的影响。结果表明:随着煮制用水pH值的上升,自来水豆汤的颜色由绿转红,抗氧化能力大幅下降,但去离子水豆汤的变化较小。用含不同质量浓度金属离子的水煮制后,5 mg/L Mg2+组豆汤呈黄绿色,50 mg/L Al3+组豆汤为鲜绿色,而5 mg/L Fe2+组豆汤变为橙红色;不同质量浓度的Zn2+和Fe2+均会显著降低绿豆清汤的DPPH自由基清除能力,而50 mg/L和500 mg/L的Mg2+能够明显提高绿豆清汤的抗氧化性。
绿豆清汤;pH值;金属离子;颜色;DPPH自由基清除能力
绿豆汤是中国家庭夏季常备的一种饮品,具有清热解毒、止渴消暑的功效。绿豆汤中含有大量类黄酮化合物,其主要组成为牡荆素和异牡荆素(图1)[1],这两种成分是绿豆汤抗氧化能力[2]、抑制晚期糖基化终末代谢产物的形成[3]及抑制α-葡萄糖苷酶活性[4-5]等生物功能的主要来源。
在日常煮制绿豆汤时,有些地区的人们发现绿豆汤会出现变红的现象。相关研究表明,用去离子水煮制得到的绿豆清汤呈黄绿色,自来水豆汤则呈橙红色,而豆汤颜色主要与其中的多酚类成分有关[6]。因去离子水与自来水的pH值及金属离子含量有一定差异[7],而此两种因素已经被证明会对茶汤的颜色产生较大影响[8]。故本实验采用多种水样煮制得到绿豆清汤,对豆汤的pH值、颜色值及DPPH自由基清除能力进行测定,探究不同煮制用水、煮制用水pH值及金属离子的种类和含量对绿豆清汤的影响。
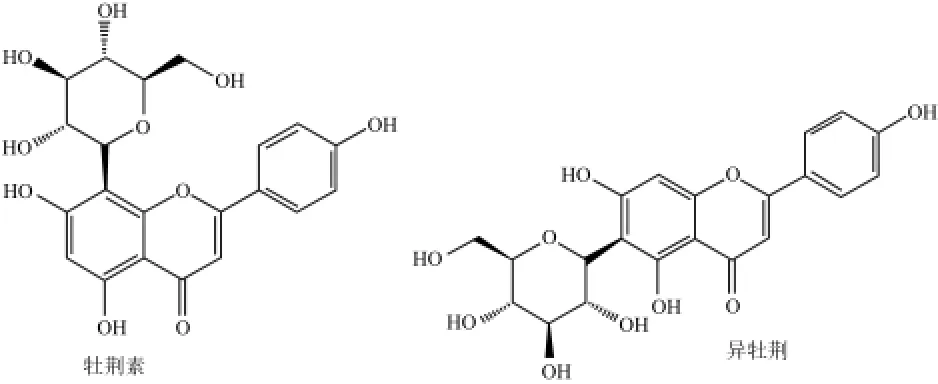
图1 牡荆素和异牡荆素结构式Fig.1 Structures of vitexin and isovitexin
1 材料与方法
1.1 材料、试剂与仪器
绿豆(原产地:内蒙古林西县) 北京大和恒粮油贸易有限公司;1,1-二苯基-2-三硝基苯肼 美国Sigma公司;浓硫酸、氢氧化钠、无水氯化钙、六水合氯化镁、结晶氯化铝、氯化亚铁、硫酸锌、无水乙醇、抗坏血酸,以上皆为国产分析纯。
BS223S型电子天平(0.001 g) 北京赛多利斯仪器系统有限公司;UV-5200型紫外-可见分光光度计上海元析仪器有限公司;TP2型全自动色差计 北京奥克依光电仪器有限公司;FE20型pH计 梅特勒-托利多仪器(上海)有限公司;C19-SH1983型多功能电磁炉美的集团有限公司。
1.2 方法
1.2.1 样品处理
挑选颗粒完整、表皮无破损的绿豆10.0 g,用去离子水清洗3次,每次50 mL。取100 mL实验水样于不锈钢杯中,用电磁炉加热至沸腾后加入绿豆,并调节功率使水温保持在90 ℃以上,盖上盖子煮制10 min。煮制结束后,用100目滤网过滤豆汤,滤液冷却至室温后定容至100 mL,测定绿豆清汤pH值、颜色值及DPPH自由基清除能力。
1.2.1.1 煮制用水pH值对绿豆汤的影响
用去离子水(pH 6.04)和自来水(pH 7.72,总硬度381 mg/L)作为实验水样进行实验,再分别用0.1 mol/L的稀硫酸和氢氧化钠溶液调节去离子水、自来水pH值至5.0、6.0、7.0、8.0、9.0,得到实验水样进行实验。
1.2.1.2 金属离子对绿豆汤的影响
根据水质检测结果[9],配制单一金属离子溶液进行实验:用CaCl2配制得到质量浓度为500、50、5 mg/L的Ca2+水样;用MgCl2•6H2O配制得到质量浓度为500、50、5 mg/L的Mg2+水样;用ZnSO4•7H2O配制得到质量浓度为5、0.5、0.05 mg/L的Zn2+水样;用FeSO4•7H2O配制得到质量浓度为5、0.5、0.05 mg/L的Fe2+水样;用AlCl3•6H2O配制得到质量浓度为50、5、0.5 mg/L的Al3+水样。
1.2.2 色差值的测定
采用CIE-1976色差系[10],测定颜色的3个分量L*、a*、b*。其中L*值代表明度;a*值代表红绿色度;b*值代表黄蓝色度。
1.2.3 DPPH自由基清除能力测定
参照文献[11]并略作修改。在小试管中加入200 μL适当稀释的样品溶液,以提取试剂代替样品作为空白,以400 μmol/L抗坏血酸溶液代替样品作为对照。加入3800 μL DPPH乙醇溶液(0.1 mmol/L),涡旋振荡充分混匀。室温下,避光放置30 min。以无水乙醇调零,测定溶液在517 nm处的吸光度得到A样品、A空白和A对照。DPPH自由基清除能力以抗坏血酸当量表示(mgAAE/100 mL)。
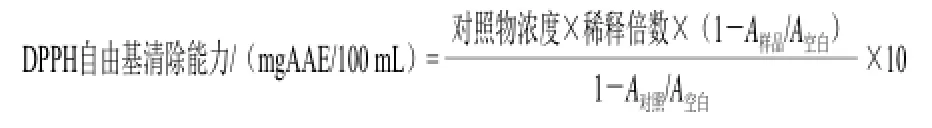
1.3 数据统计分析
2 结果与分析
2.1 煮制用水pH值对绿豆汤的影响
以未调节pH值的去离子水豆汤和自来水豆汤为对照组,分别用pH 5.0~9.0的去离子水及自来水煮制绿豆清汤,豆汤颜色值的变化如表1所示。

表1 煮制用水pH值对绿豆汤pH值及颜色值的影响Table 1 Effect of different pH values of cooking water on pH and color values of MBCS
由表1可知,随着煮制用水pH值的上升,豆汤的pH值、|a*|值和b*值均呈上升趋势,自来水组的变化程度大幅高于去离子水组。当去离子水pH值在6.0~8.0时,各组豆汤颜色值几乎没有显著性差异;而去离子水pH值达到9.0后,豆汤的pH值及颜色值出现较大幅度上升,但仍呈现弱酸性。以pH 6.0的自来水煮制时,豆汤的L*值显著降低,|a*|值和b*值显著增加,黄绿色加深;pH值达到7.0后,豆汤的a*值由负变正,同时L*值明显下降、b*值大幅上升,呈现明显的橙红色;当pH值在7.0~9.0时,豆汤的pH值、L**值和b*值变化较小,仅a*值显著增加,而pH 8.0组豆汤的颜色与自来水豆汤对照组最为接近;除pH 5.0组外,其余各组自来水豆汤均呈现碱性。
去离子水pH值由5.0增至9.0的过程中,豆汤始终为弱酸性;在此条件下随着豆汤pH值的上升,牡荆素等黄酮类化合物向呈现黄色的查尔酮型转化不断增加[12],这可能是去离子水组豆汤黄色加深的原因。相关研究表明[13],pH值由6.0上升至8.0的过程中花色素-3-葡萄糖苷的最大吸收峰发生大幅度红移,在此pH值区间内自来水组豆汤的颜色也发生了最大幅度的变化;由于花色素-3-葡萄糖苷和牡荆素同属于黄酮类化合物[14],推测此两种反应可能变色机理类似。
以未调节pH值的去离子水豆汤和自来水豆汤为对照组,分析绿豆清汤DPPH自由基清除能力随煮制用水pH值的变化,实验结果如图2~3所示。
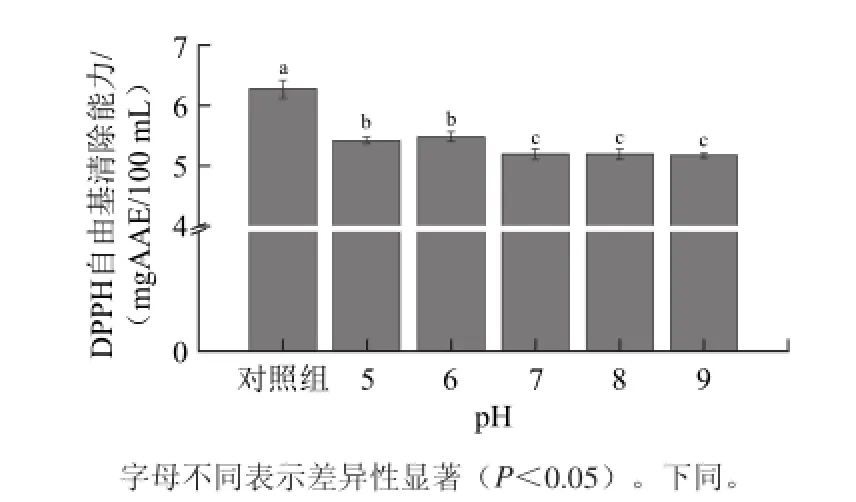
图2 去离子水pH值对绿豆汤DPPH自由基清除能力的影响Fig.2 Effect of pH value of deionized water onDPPH radical scavenging capacity of MBCS
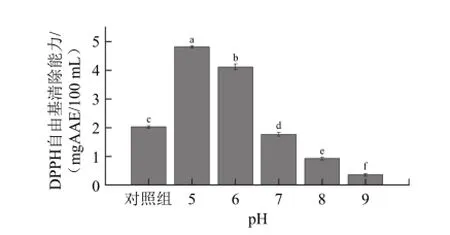
图3 自来水pH值对绿豆汤DPPH自由基清除能力的影响Fig.3 Effect of pH value of tap water on DPPH radical scavenging capacity of MBCS
由图2~3可知,调节pH值后豆汤的DPPH自由基清除能力均显著低于去离子水豆汤对照组,而自来水组5种样品显著低于去离子水组的样品。用pH≥7.0的去离子水煮制得到豆汤的DPPH自由基清除能力显著低于pH<7.0的去离子水组样品,但其下降幅度较小。随着煮制用水pH值的上升,自来水组样品的DPPH自由基清除能力出现了明显的下降:自来水pH值从6.0升至7.0时下降幅度最大;pH 7.0组自来水豆汤的DPPH自由基清除能力已经显著低于自来水豆汤对照组;而当自来水pH值达到9.0时,豆汤的DPPH自由基清除能力仅为去离子水豆汤对照组的6%,几乎失去清除DPPH自由基的能力。
当煮制用水pH值变化时,去离子水组豆汤的变化程度较小,而自来水组豆汤的各项指标均发生大幅度改变,说明pH值并不是引起绿豆清汤颜色变化的主要因素,这与黄波等[7]对贡菊茶汤变色因素探究的结论相同。除pH值外,去离子水与自来水的金属离子含量也存在较大差异,而金属离子能够与黄酮化合物发生络合反应从而导致其颜色发生显著改变[15],因此自来水豆汤颜色出现显著改变可能与其中的金属离子有关。
2.2 不同离子梯度对绿豆汤的影响
研究发现钙、镁离子会对茶汤的颜色和抗氧化能力产生显著影响[9],而锌、二价铁和铝离子则被发现会引起多酚化合物吸收光谱的改变[12]。因此以去离子水豆汤作为对照,选取上述5种离子配制成不同质量浓度的溶液进行实验,探究金属离子对绿豆清汤的影响。绿豆清汤pH值及颜色值的变化如表2所示。5种离子中Ca2+、Mg2+对绿豆清汤pH值及颜色值的影响较为相似;两种离子的质量浓度为5 mg/L时,豆汤的pH值、a*值和b*值均显著高于对照组;质量浓度为50 mg/L时,a*值、b*值仍有显著上升,但pH值与对照组无显著性差异;当质量浓度达到500 mg/L时,Ca2+组b*值显著升高,黄色加深,而Mg2+组b*值显著降低,豆汤颜色变浅。在低质量浓度下Zn2+对绿豆清汤的pH值和颜色无显著影响,但当Zn2+质量浓度达到5 mg/L时能够显著提高豆汤的pH值并使豆汤颜色变浅。
不同质量浓度的Fe2+和Al3+均会对绿豆清汤的pH值差生显著影响,质量浓度较低时升高了豆汤的pH值,而质量浓度达到一定程度后则会使豆汤的pH值显著下降。颜色值方面,0.05 mg/L的Fe2+显著提高了豆汤的b*值,而质量浓度达到5 mg/L时则会大幅降低豆汤的L*值,并使a*值变为正值,豆汤呈现明显的橙红色。0.5 mg/L的Al3+使豆汤颜色变浅,而质量浓度为50 mg/L时则会显著增加|a*|值和b*值,豆汤变为鲜绿色。
牡荆素和异牡荆素的主体结构为5,7,4’-三羟基黄酮,由于其B环上只有一个羟基,故其与金属离子的络合位点主要发生在4位羰基和5位羟基间[16]。相关研究表明Al3+与芦丁等黄酮类化合物结合后,其最大吸收峰由360 nm红移至406 nm;而Fe3+虽不会引起吸收峰的移动,但会大幅升高黄酮的光吸收强度,使溶液颜色变暗[12],这与5 mg/L Al3+组豆汤b*值的变化和5 mg/L Fe2+组L*值的变化相类似。推测实验中各种金属离子主要通过辅色作用与黄酮化合物络合引起绿豆汤颜色的改变[17],而豆汤呈现不同颜色与金属离子的类型有关。此外,体系pH值和配位比也是影响黄酮-金属络合物性质的重要因素[17],不同质量浓度离子组豆汤的颜色存在较大差异可能与此相关。

表2 不同浓度金属离子对绿豆清汤pH值及颜色值的影响Table 2 Effect of different concentration of metal ions on pH and color values of MBCS

图4 不同质量浓度金属离子对绿豆清汤DPPH自由基清除能力的影响Fig.4 Effect of different concentrations of metal ions on DPPH radical scavenging capacity of MBCS
由图4可知,5 mg/L的Ca2+和Mg2+均会显著降低豆汤的DPPH自由基清除能力,而高质量浓度Ca2+组豆汤与对照组无显著性差异;高质量浓度Mg2+组豆汤的DPPH自由基清除能力显著高于对照组,且随着Mg2+浓度的上升豆汤的DPPH自由基清除能力逐渐加强。不同质量浓度的Zn2+和Al3+均会显著降低豆汤的DPPH自由基清除能力,Zn2+各组豆汤间无显著性差异,而呈现亮绿色的50 mg/L Al3+组豆汤DPPH自由基清除能力的下降幅度显著高于低质量浓度的Al3+组豆汤。0.05 mg/L的Fe2+未对豆汤的DPPH自由基清除能力产生显著影响,但0.5 mg/L组和橙红色的5 mg/L组豆汤的DPPH自由基清除能力均显著下降。
金属离子与黄酮化合物发生络合反应后会改变其生物活性[18]。研究表明黄酮化合物同Zn2+、Fe2+、Fe3+络合后,能够表现出比游离黄酮更加突出的细胞损伤抑制能力[19];另外一些研究则发现Fe2+、Fe3+与黄烷酮化合物络合后会加速其酸解离,从而造成该类化合物抗亚油酸氧化能力的下降,但Zn2+、Al3+的影响较小[20]。不同种类金属-黄酮络合物的抗氧化性存在差异,而同种离子对黄酮化合物不同生物活性的影响也不尽相同。因此,不同种类及质量浓度的金属离子对绿豆清汤DPPH自由基清除能力的变化表现出了相异的趋势,但其具体机理仍有待进一步研究。
3 结 论
煮制用水对绿豆清汤的颜色及抗氧化性有较大影响。弱碱性水会使豆汤颜色发生明显变化,并会显著降低其自由基清除能力,而弱酸性水不会对豆汤产生明显影响。随着煮制用水pH值的上升,自来水豆汤的颜色由绿转红,DPPH自由基清除能力大幅下降,但去离子水豆汤的变化较小,说明pH值并不是引起绿豆清汤颜色变化的主要因素。用某些质量浓度的金属离子溶液煮制绿豆清汤,其颜色及抗氧化性会产生较大改变。5 mg/L Mg2+豆汤呈黄绿色、50 mg/L Al3+豆汤为鲜绿色,而5 mg/L Fe2+豆汤变为橙红色。不同质量浓度的Zn2+和Fe2+均会显著降低绿豆清汤的DPPH自由基清除能力,而50 mg/L和500 mg/L的Mg2+能够明显提高绿豆清汤的抗氧化性。
本研究发现高质量浓度的Fe2+会使绿豆清汤变红,但日常生活用水质量浓度的Fe2+煮制后豆汤仍为黄绿色,可见Fe2+并不是引起家庭烹调绿豆清汤变红的主要因素,其变红的因素还有待进一步探究。
[1] LI He, CAO Dongdong, YI Jianyong, et al. Identifi cation of the fl avonoids in mungbean (Phaseolus radiatus L.) soup and their antioxidant activities[J]. Food Chemistry, 2012, 135(4): 2942-2946.
[2] CAO Dongdong, LI He, YI Jianyong, et al. Antioxidant properties of the mung bean flavonoids on alleviating heat stress[J]. PLOS One, 2011, 6(6): 1-9.
[3] PENG Xiaofei, ZHENG Zongping, CHENG K W, et al. Inhibitory effect of mung bean extract and its constituent vitenxin and isovitexin on the formation of advanced glycation endproducts[J]. Food Chemistry, 2008, 106(2): 475-481.
[4] CHOO C Y, SULONG N Y, MAN F, et al. Vitexin and isovitexin from the leaves of Ficus deltoidea with in vivo α-glucosidase inhibition[J]. Journal of Ethnopharmacology, 2012, 142(3): 776-781.
[5] YAO Yang, CHENG Xuzhen, WANG Lixia, et al. Biological potential of sixteen legumes in China[J]. International Journal of Molecular Sciences, 2011, 12(10): 7048-7058.
[6] 陈然, 赵建京, 范志红. 煮制条件对绿豆清汤颜色及抗氧化性的影响[J]. 食品科学, 2012, 33(8): 115-120.
[7] 黄波, 张文鹏, 郭腾, 等. 自来水冲泡贡菊花茶变色机理及抗氧化活性差异研究[J]. 现代食品科技, 2009, 25(9): 1028-1031.
[8] 尹军峰, 许勇泉, 陈建新, 等. 主要金属离子对冷溶性速溶绿茶复水后品质的影响[J]. 食品科学, 2009, 30(7): 99-105.
[9] 陈然, 张季艾, 范志红. 北京自来水冲泡绿茶汤颜色及抗氧化性变化因素[J]. 食品科学, 2012, 33(7): 78-82.
[10] PAULI H. Proposed extension of the CIE recommendation on “Uniform color spaces, color difference equations, and metric color terms”[J]. JOSA, 1976, 66(8): 866-867.
[11] XU B J, CHANG S K C. A comparative study on phenolic profi les and antioxidative activity of legumes as affected by extraction solvents[J]. Journal of Food Science, 2007, 72(2): 159-166.
[12] CHEN Wanping, LI Ping, WANG Xiaohong. Chemical stability of yellow pigment extracted from the flower bud of Sophora japonica L.(Huaimi)[J]. International Journal of Food Science & Technology, 2010, 45(8): 1666-1672.
[13] CABRITA L, FOSSEN T, ANDERSEN Ø M. Colour and stability of the six common anthocyanidin 3-glucosides in aqueous solutions[J]. Food Chemistry, 2000, 68(1): 101-107.
[14] 石碧. 植物多酚[M].北京: 科学出版社, 2000: 46-47.
[15] CASTANEDA-OVANDO A, PACHECO-HEMANDEZ M L, PAEZHEMANDEZ M E, et al. Chemical studies of anthocyanins: a review[J]. Food Chemistry, 2009, 113(4): 859-871.
[16] JURD L, GEISSMAN T A. Absorption spectra of metal complexes of fl avonoid compounds[J]. Journal of Organic Chemistry, 1956, 21(12): 1395-1401.
[17] MALESEV D, KUNTIC V. Investigation of metal-fl avonoid chelates and the determination of fl avonoids via metal-fl avonoid complexing reactions[J]. Journal of the Serbian Chemical Society, 2007, 72(10): 921-939.
[18] de SOUZA R F V, SUSSUCHI E M, de GIOVANI W F. Synthesis, electrochemical, spectral, and antioxidant properties of complexes of fl avonoids with metal ions[J]. Synthesis and Reactivity in Inorganic and Metal-organic Chemistry, 2003, 33(7): 1125-1144.
[19] KOSTYUK V A, POTAPOVICH A I, VLADYKOVSKAYA E N, et al. Infl uence of metal ions on fl avonoid protection against asbestosinduced cell injury[J]. Archives of Biochemistry and Biophysics, 2001, 385(1): 129-137.
[20] KUMAMOTO M, SONDA T, NAGAYAMA K, et al. Effects of pH and metal ions on antioxidative activities of catechins[J]. Bioscience, Biotechnology, and Biochemistry, 2001, 65(1): 126-132.
Effect of pH Value of Cooking Water and Metal Ions on pH, Color and Free Radical Scavenging Capacity of Mung Bean Clear Soup
CHEN Ran, WANG Jing, WAN Hai-jing, ZHAO Jian-jing, FAN Zhi-hong*
(College of Food Science and Nutritional Engineering, China Agricultural University, Beijing 100083, China)
Different types of cooking water were used to investigate the effects of pH value and metal ions (Ca2+, Mg2+, Zn2+, Al3+, and Fe2+) on the pH, color and 2,2-diphenyl-1-picrylhydrazyl (DPPH) radical scavenging capacity of mung bean clear soup (MBCS). The results showed that the color of MBCS cooked with tap water turned from green to red and the DPPH radical scavenging capacity dropped markedly with increasing pH of cooking water, whereas the MBCS cooked with deionized water changed little. When cooking the soup with solutions of different metal ions, its color and DPPH radical scavenging capacity were changed differently. Mg2+at 5 mg/L increased its yellow color whereas 50 mg/L Al3+increased its green color and 5 mg/L Fe2+turned its color to red. In addition, both Zn2+and Fe2+at different concentrations decreased the DPPH radical scavenging capacity of MBCS while Mg2+at 50 mg/L and 500 mg/L increased its anti-oxidative activity significantly.
mung bean clear soup; pH value; metal ions; color; DPPH radical scavenging capacity
TS201.2
A
1002-6630(2014)03-0096-04
10.7506/spkx1002-6630-201403020
2013-04-15
陈然(1989—),男,硕士研究生,研究方向为食物营养。E-mail:chenran71@126.com
*通信作者:范志红(1966—),女,副教授,博士,研究方向为食物营养。E-mail:daisyfan@vip.sina.com

