乙醇熏蒸处理对鲜切西兰花活性成分和抗氧化活性的影响
王慧倩,郑 聪,王华东,王 静,郑永华*
乙醇熏蒸处理对鲜切西兰花活性成分和抗氧化活性的影响
王慧倩,郑 聪,王华东,王 静,郑永华*
(南京农业大学食品科技学院,江苏 南京 210095)
研究乙醇熏蒸处理对鲜切西兰花总酚、总黄酮、总硫代葡萄糖苷和萝卜硫素等活性成分含量及抗氧化活性的影响。先将花球在20 ℃条件下分别用体积分数为2%、5%、10%、20%乙醇溶液熏蒸处理6 h,再切割成小花并在10 ℃条件下贮藏。结果表明,10%乙醇溶液熏蒸处理可以显著延长鲜切西兰花的货架期、提高总酚和总黄酮含量、延缓总硫代葡萄糖苷和萝卜硫素含量下降,并可有效保持较高的DPPH(1,1-diphenyl-2-picrylhydrazyl)自由基清除能力和还原力,提高其清除超氧阴离子自由基和羟自由基能力,从而延缓西兰花采后衰老、保持较高的抗氧化活性。同时发现,总酚、总黄酮和萝卜硫素含量与DPPH自由基清除能力存在极显著的正相关性。这些结果表明乙醇熏蒸处理在鲜切西兰花保鲜中具有较好的应用前景。
鲜切西兰花;乙醇熏蒸处理;活性成分;抗氧化活性
西兰花亦称青花菜、绿菜花,富含VC、类黄酮、硫代葡萄糖苷和萝卜硫素等活性成分,具有抗氧化、延缓衰老和抗癌等功效[1-3],被誉为“蔬菜皇后”。西兰花的花球组织结构非常适合于鲜切菜加工,但切割后的西兰花由于受到机械损伤,其呼吸强度加大,花蕾的衰老黄化加速,同时促进病原微生物的生长,导致商品性降低,货架期缩短,从而限制了鲜切西兰花产业的发展。因此,如何延缓花蕾的黄化,是延长鲜切西兰花货架期的关键和迫切需要解决的问题[4]。
近年来的研究表明,适当的外源乙醇处理具有减少果蔬生理病害、延缓组织衰老和抑制叶绿素降解等作用,对鲜切芒果、茄子、樱桃和苹果等都有较好的保鲜效果[5-8]。鲜切后的西兰花采用外源乙醇处理,能提高抗氧化酶活性、抑制乙烯释放量、延缓叶绿体结构的解体等[9-10],从而延缓黄化,延长货架期。但鲜切前乙醇预处理对鲜切西兰花活性成分、抗氧化活性及货架期的影响尚未见报道。因此本实验研究了乙醇熏蒸处理对鲜切西兰花总酚、总黄酮、总硫代葡萄糖苷和萝卜硫素等活性成分含量及抗氧化活性的影响,探讨乙醇熏蒸处理提高鲜切西兰花营养品质的作用,为乙醇熏蒸处理在鲜切西兰花货架保鲜中的应用提供理论依据。
1 材料与方法
1.1 材料与试剂
“超大1号”西兰花为南京六合区竹镇镇正常栽培,采收时选取大小均匀、花球紧实的西兰花。采收后的西兰花花球表面覆冰预冷,2 h内运回实验室。
浓盐酸、浓硫酸、甲醇 南京化学试剂有限公司;硫酸亚铁、铁氰化钾 西陇化工股份有限公司;邻苯三酚、亚铁氰化钾 广东光华化工厂有限公司;1,1-二苯基-二苦基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、Follin试剂、黑芥子酶 美国Sigma公司;乙腈、甲酸均为国产色谱纯;无水乙醇、丙酮、硝酸铝、碳酸钠、三氯化铁、三氯甲烷均为国产分析纯。
1.2 仪器与设备
CR-400色差仪 日本Minota公司;GL-20G-H型冷冻离心机 上海安亭科学仪器厂;UV-1600型分光光度计 上海美谱达仪器有限公司;FA1104N电子天平上海精密科学仪器有限公司;1100型高效液相色谱 美国安捷伦公司;RE-52A型旋转蒸发仪 上海亚荣生化仪器厂。
1.3 方法
1.3.1 材料处理
在乙醇处理适宜体积分数筛选实验中,将挑选好的西兰花花球随机分成5 组,分别放入体积为50 cm×30 cm×20 cm的密闭塑料箱中,在20 ℃条件下用体积分数为2%、5%、10%、20%的乙醇熏蒸处理6 h,每个体积分数12 个花球,重复3 次。处理结束后通风1 h,将西兰花花球切分成直径3~4 cm、茎梗2~3 cm的小花,用聚乙烯塑料盒(20 cm×12 cm×8 cm)分装,于10 ℃贮藏并测定其货架期。后续实验中,研究了不同体积分数乙醇熏蒸处理对鲜切西兰花活性成分和抗氧化活性的影响。将挑选后的西兰花随机分成2 组,处理组花球在20 ℃条件下用乙醇熏蒸6 h,对照组在20 ℃条件下密闭6 h。处理结束后,将花球通风1 h后切割。将鲜切后的小花分装于塑料盒中,置于10 ℃贮藏10 d,贮藏期间每隔2 d取样进行分析测定。
1.3.2 测定方法
1.3.2.1 货架期的测定
参考Ku等[11]的方法,采用感官评定,以花蕾黄化面积达到30%的时间作为货架期。
1.3.2.2 总酚和总黄酮含量的测定
总酚含量的测定参照Slinkard等[12]Folin-Ciocalteau试剂比色法。吸取20 μL提取液,加入180 μL H2O,1 mL Folion-Ciocalteu试剂,再加入0.8 mL质量浓度为75 g/L的Na2CO3溶液。混合物在30 ℃条件下反应1 h,于765 nm波长处测定吸光度,以没食子酸做标准曲线。
总黄酮含量测定采用NaNO2-Al(NO3)3比色法并略作修改[13]。吸取1 mL提取液,加入1 mL体积分数70%乙醇、0.3 mL质量分数5%的NaNO2溶液,混匀,再加入质量分数10%的Al(NO3)3溶液0.3 mL,室温条件下放置3 min后加入2 mL质量分数4%的NaOH溶液,10 min后在510 nm波长处测定吸光度。以芦丁做标准曲线。
1.3.2.3 总硫代葡萄糖苷和萝卜硫素含量的测定
总硫代葡萄糖苷含量的测定参照Heaney等[14]方法略加改动,采用苯酚-硫酸法[15],以葡萄糖做标准曲线。
萝卜硫素含量参照Liang Hao等[16]的方法略加修改。称取0.2 g冻样西兰花,加入2 mL 0.5 U/mL黑芥子酶、1 mL超纯水,用液氮研磨,再在旋涡仪上混合成匀浆,酶解30 min。匀浆中加入5 mL二氯甲烷,1 g无水硫酸钠,12 000×g离心10 min后,得到二氯甲烷相。二氯甲烷相在旋转蒸发仪30 ℃条件下完全蒸干,用1 mL乙腈溶解残渣,然后0.22 μm的微孔滤膜过滤、封口,置于-20 ℃条件下保存直至高效液相色谱分析。高效液相色谱仪(Agilent series 1100)由以下几个部分组成:在线脱气装置(G1379A)、四元泵(G1311A)、柱温箱(G1316A)和紫外检测器(G1314A)。样品量20 μL,在30 ℃条件下通过Kromasil C18柱(250 mm×4.6 mm,5μm)分离,流动相为超纯水和乙腈,流速为1 mL/min。流动相梯度为前10 min 20%乙腈,然后变为60%乙腈至第13分钟,最后变为100%乙腈冲洗柱子2 min。检测波长为254 nm。
采用外标法定量,精确称取5 mg萝卜硫素标准品用乙腈定容至10 mL容量瓶,配成标准液母液。分别准确移取0.1、0.2、0.3、0.4、0.5、0.6、0.7、0.8 mL于10 mL容量瓶中,用乙腈定容,分别进样两次。
1.3.2.4 超氧阴离子自由基清除能力测定
采用邻苯三酚自氧化法[17]进行测定。取0.05 mol/L pH 8.2的Tris-HCl缓冲液4.5 mL,25 ℃水浴20 min,分别加入1 mL提取液和0.4 mL 25 mmol/L的邻苯三酚溶液,混匀后于25 ℃水浴5 min,加入8 mol/L HCl溶液1.0 mL终止反应,以Tris-HCl 缓冲液作参比,在299 nm波长处测定吸光度,计算清除率。
1.3.2.5 羟自由基清除能力测定
参考林建原等[18]方法加以改进。取1 mL提取液,再加入9 mmol/mL硫酸亚铁溶液和1 mL 9 mmol/L水杨酸-乙醇溶液,最后加入1 mL 8.8 mol/L过氧化氢溶液,35 ℃水浴35 min,于510 nm波长处测定吸光度,计算其清除率。
1.3.2.6 DPPH自由基清除力和总还原力测定
DPPH自由基清除能力的测定参照Soengas等[19]方法,结果以清除百分率表示。
总还原力的测定参照Kumaran等[20]方法,结果以三氯化铁反应液在700 nm波长处吸光度表示,吸光度越大,则说明还原能力越强,抗氧化能力越弱。
1.4 数据处理
以上指标均用3 个重复样品测定,结果采用Excel 2007进行数据处理分析,用邓肯多重比较方法进行差异显著性分析,5%为显著水平。
2 结果与分析
2.1 不同体积分数乙醇熏蒸处理对鲜切西兰花货架期的影响
小花的黄化是限制鲜切西兰花货架贮藏的主要因素。如图1所示,在2%~10%体积分数范围内,随着乙醇体积分数的提高,西兰花的黄化受到明显抑制,货架期随之延长,其中10%乙醇处理效果最好,在10 ℃条件下的货架期可达12 d;但高体积分数(20%)乙醇处理反而促进西兰花的黄化,货架期随之缩短。因此,研究10%乙醇处理对鲜切西兰花活性成分及抗氧化活性的影响。

图1 不同体积分数乙醇熏蒸处理对鲜切西兰花货架期的影响Fig.1 Effect of ethanol volume fraction on the shelf-life of fresh-cut broccoli florets
2.2 乙醇熏蒸处理对鲜切西兰花中总酚和总黄酮含量的影响
西兰花富含总酚和总黄酮等酚类化合物而具有较强的抗氧化能力。如图2所示,鲜切西兰花在贮藏过程中其总酚和总黄酮含量均呈先上升后下降趋势,于第6天时达到峰值,乙醇处理组的总酚和总黄酮峰值含量分别为1.355 mg/g和0.785 mg/g,显著高于对照组的1.309 mg/g和0.752 mg/g(P<0.05)。在整个贮藏期间,乙醇处理组的总酚和总黄酮含量都高于对照组。
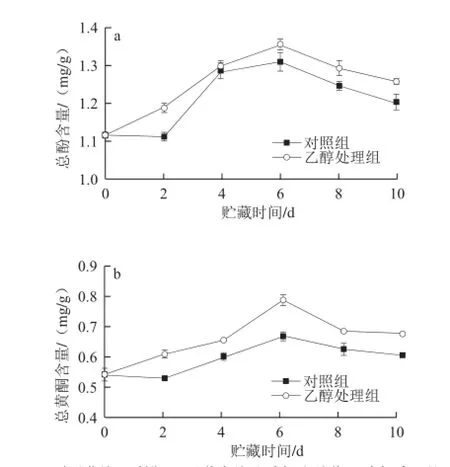
图2 乙醇熏蒸处理对鲜切西兰花中总酚(a)和总黄酮(b)含量的影响Fig.2 Effect of ethanol pretreatment on the contents of total phenols (a) and total flavonoid (b) in fresh-cut broccoli florets
2.3 乙醇熏蒸处理对鲜切西兰花中总硫代葡萄糖苷和萝卜硫素质量摩尔浓度的影响

图3 乙醇熏蒸处理对鲜切西兰花总硫代葡萄糖苷(a)和萝卜硫素(b)质量摩尔浓度的影响Fig.3 Effect of ethanol pretreatment on the contents of total glucosinolate (a) and sulforaphane (b) in fresh-cut broccoli florets
硫代葡萄糖苷是西兰花中最重要的活性成分,其降解产物——萝卜硫素具有很强的抗癌功效[3]。从图3可见,鲜切西兰花在贮藏中总硫代葡萄糖苷和萝卜硫素含量呈下降趋势,乙醇处理可延缓二者含量的下降,贮藏10 d后处理组的总硫代葡萄糖苷质量摩尔浓度为0.411 μmol/g,显著高于对照组的0.341 μmol/g,而处理组的萝卜硫素含量是对照组的1.82 倍。
2.4 乙醇熏蒸处理对鲜切西兰花抗氧化能力的影响

图4 乙醇熏蒸处理对鲜切西兰花对DPPH自由基(a)、超氧阴离子自由基(b)、羟自由基(c)清除能力和还原力(d))的影响Fig.4 Effect of ethanol pretreatment on antioxidant properties of fresh-cut broccoli florets
DPPH自由基、超氧阴离子自由基和羟自由基清除能力和还原能力是评价体外抗氧化能力的重要指标。如图4显示,在贮藏期间,鲜切西兰花中DPPH自由基、超氧阴离子自由基和羟自由基清除能力和还原力总体都呈先上升后下降趋势,这与总酚和总黄酮含量的变化趋势相似。乙醇处理显著促进了这些自由基清除能力和还原力在前期的上升,延缓后期的下降(P<0.05)。在整个贮藏期间,乙醇处理组的DPPH自由基、超氧阴离子自由基和羟自由基清除能力和还原力都显著高于对照组(P<0.05)。
2.5 鲜切西兰花中活性成分与抗氧化能力的相关性分析一般来说,果蔬中的抗氧化物质主要是酚类物质。为了探讨鲜切西兰花抗氧化能力与总酚、总黄酮及总硫代葡萄糖苷和萝卜硫素含量的关系,对4 种活性物质含量测定结果及不同方法测得抗氧化能力结果作了相关性分析。如表1所示,总酚含量与总还原力(P<0.01,R=0.960)、总酚含量与DPPH自由基清除能力(P<0.01,R=0.747)、总黄酮含量与总还原力(P<0.01,R=0.885)的相关性最高,呈极显著相关。总黄酮含量与DPPH自由基清除能力(P<0.05,R=0.739)、总硫代葡萄糖苷含量与DPPH自由基清除能力(P<0.05,R=0.620)、萝卜硫素含量与超氧阴离子自由基清除能力(P<0.05,R=0.658)、萝卜硫素含量与总还原力(P<0.05,R=0.540)呈显著相关。由此可知,总酚、总黄酮和萝卜硫素在鲜切西兰花抗氧化能力方面发挥着重要作用,尤以总酚的作用最为突出,其次是总黄酮与萝卜硫素,而总硫代葡萄糖苷与西兰花的抗氧化能力相关性较小。
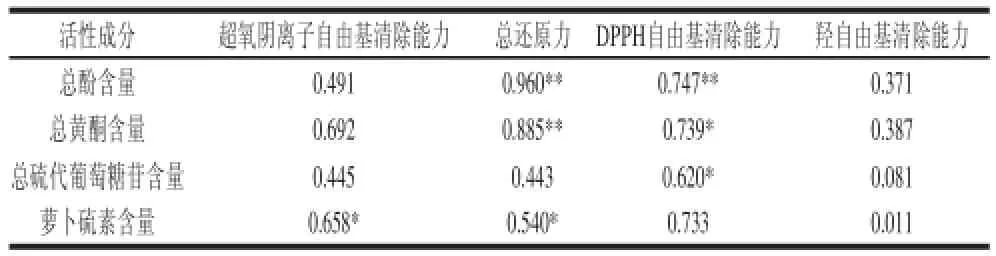
表1 鲜切西兰花中活性成分含量与抗氧化活性的相关分析Table 1 Correlation analysis between four antioxidant properties and the contents of active compounds in fresh-cut broccoli florets
3 讨论与结论
花蕾黄化抑制西兰花采后流通,如何延缓花蕾的黄化是西兰花保鲜首先要解决的问题。Xu Feng等[21]的研究发现,采用乙醇处理能显著抑制西兰花花球叶绿素降解,从而延缓黄化。在蒌蒿上的研究也发现,乙醇处理可显著抑制其叶绿素的降解,从而保持商品性[22]。本研究发现,西兰花花球用体积分数2%~10%乙醇预处理后再作切割加工,能显著延缓花蕾的黄化,延长鲜切西兰花的货架期,以10%乙醇处理效果最好。乙醇处理延缓西兰花花蕾的黄化,可能与其抑制叶绿素降解相关酶的活性和基因表达有关[21,23]。本研究还发现20%乙醇处理反而促进花蕾的黄化,缩短货架期,这可能与高体积分数乙醇破坏了细胞膜结构,从而促成叶绿素的降解有关[24]。
多酚、黄酮以及硫代葡萄糖苷和萝卜硫素等是西兰花中重要的生物活性物质,它们不仅具有自由基清除能力和抗氧化特性,还具有抑菌、降血压和预防癌症等多种生理功能[1-3]。长期以来,对西兰花的保鲜主要偏重于保持其绿色和商品性,而对其活性成分变化的影响研究较少。如何通过各种采后处理来保持甚至提高西兰花中的活性成分,对人类营养和健康具有重要意义。已有研究表明,乙醇能够调控植物的次生代谢反应,促进越橘莓[25]、葡萄[26]和杨梅[27]果实中酚类物质和花色苷的合成与积累,从而提高这些果实的抗氧化活性。采用外源蔗糖处理也可促进西兰花种芽中花色苷和硫代葡萄糖苷的积累[28]。在本研究中,10%乙醇熏蒸处理诱导了鲜切西兰花中总酚和总黄酮的积累,同时保持较高的DPPH自由基、超氧阴离子自由基和羟自由基清除能力和还原力。统计分析表明,总酚和总黄酮含量与DPPH自由基清除能力存在极显著的正相关性。这些结果表明,乙醇可以通过促进酚类和黄酮类物质的合成来提高抗氧化活性,从而提高西兰花的营养价值。但乙醇促进酚类和黄酮类物质积累的机理还不清楚,尚待进一步研究。
由此可得出如下结论:10%乙醇熏蒸处理可显著抑制在10 ℃贮藏条件下鲜切西兰花的黄化,延长其货架期,因而乙醇处理在鲜切西兰花保鲜中具有较好的应用前景;10%乙醇熏蒸处理可有效提高10 ℃贮藏条件下的鲜切西兰花总酚和总黄酮含量,延缓总硫代葡萄糖苷和萝卜硫素含量下降,保持较高的DPPH自由基、超氧阴离子自由基和羟自由基清除能力和还原力,从而保持较高的抗氧化活性和营养价值。
[1] KURILICH A C, TSAU G J, BROWN A, et al. Carotene, tocopherol, and ascorbate contents in subspecies of Brassica oleracea[J]. Journal of Agricultural and Food Chemistry, 1999, 47(4): 1576-1581.
[2] AZUMA K, NAKAYAMA M, KOSHIOKA M, et al. Phenolic antioxidants from the leaves of Corchorus olitorius L.[J]. Journal of Agricultural and Food Chemistry, 1999, 47(10): 3963-3966.
[3] SINGH S V, SINGH K. Cancer chemoprevention with dietary isothiocyanates mature for clinical translational research[J]. Carcinogenesis, 2012, 33(10): 1833-1842.
[4] 叶保华, 赵继承, 朱胜龙. 鲜切西兰花贮藏保鲜技术研究[J]. 包装与食品机械, 2009, 27(3): 18-21.
[5] PLOTTO A, BAI J, NARCISO J A, et al. Ethanol vapor prior to processing extends fresh-cut mango storage by decreasing spoilage, but does not always delay ripening[J]. Postharvest Biology Technology, 2006, 39(2): 134-145.
[6] HU Wenzhong, JIANG Aili, TIAN Mixia, et al. Effect of ethanol treatment on physiological and quality attributes of fresh-cut eggplant[J]. Journal of the Science of Food and Agriculture, 2010, 90(8): 1323-1326.
[7] BAI J, PLOTTO A, SPOTTS R, et al. Ethanol vapor and saprophytic yeast treatments reduce decay and maintain quality of intact and freshcur sweet cherries[J]. Postharvest Biology and Technology, 2011, 62(2): 204-212.
[8] BAI J, BALDWIN E A, SOLIVA F R C, et al. Effect of pretreatment of intact ‘Gala’ apple with ethanol vapor, heat, or 1-methylcyclopropene on quality and shelf life of fresh-cut slices[J]. Journal of the American Society for Horticultural Science, 2004, 129(4): 583-593.
[9] 陶炜煜, 韩俊华, 牛天贵, 等. 乙醇处理对最小加工西兰花生理和品质的影响[J]. 食品科技, 2006, 31(4): 43-46.
[10] 韩俊华, 周君一, 牛天贵, 等. 乙醇对鲜切西兰花抗氧化酶及叶绿体超微结构的影响[J]. 食品科学, 2008, 29(3): 283-287.
[11] KU V V V, WILLS R B H. Effect of 1-methylcyclopropene on the storage life of broccoli[J]. Postharvest Biology and Technology, 1999, 17(2): 127-132.
[12] SLINKARD K, SINGLETON V L. Total phenol analysis: automation and comparison with manual methods[J]. American Journal of Enology and Viticulture, 1977, 28(1): 49-55.
[13] ABDEM N, FAROUK K, ZEINAB A S, et al. Enhancement of phenolics, flavonoids and glucosinolates of Broccoli (Brassica olaracea var. Italica) as antioxidants in response to organic and bioorganic fertilizers[J]. Journal of the Saudi Society of Agricultural Sciences, 2012, 11(2): 135-142.
[14] HEANEY R K, SPINKS E A, FENWICK G R. Improved method for the determination of the total glucosinolate content of rapeseed by determination of enzymically released glucose[J]. Analyst, 1988, 113(10): 1515-1518.
[15] TIAN Lingmin, ZHAO Yan, GUO Chao, et al. A comparative study on the antioxidant activities of an acidic polysaccharide and various solvent extracts derived from herbal Houttuynia cordata[J]. Carbohydrate Polymers, 2011, 83(2): 537-544.
[16] LIANG Hao, YUAN Qipeng, DONG Huiru, et al. Determination of sulforaphane in broccoli and cabbage by high-performance liquid chromatography[J]. Journal of Food Composition and Analysis, 2006, 19(5): 473-476.
[17] 马虎飞, 王思敏, 杨章民. 紫荆陕北野生枸杞多糖的体外抗氧化活性[J]. 食品科学, 2011, 32(3): 60-63.
[18] 林建原, 陶志华, 朱钐汕. 杨梅叶中总黄酮提取工艺及其抗氧化活性研究[J]. 食品科学, 2011, 32(20): 26-29.
[19] SOENGAS P, CARTEA M E, FRANCISCO M, et al. New insights into antioxidant activity of Brassica crops[J]. Food Chemistry, 2012, 134(2): 725-733
[20] KUMARAN A, JOEL KARUNAKRAN R. Antioxidant and free radical scavenging activity of an aqueous extract of Coleus aromaticus[J]. Food Chemistry, 2006, 97(1): 109-114.
[21] XU Feng, CHEN Xuehong, JIN Peng, et al. Effect of ethanol treatment on quality and antioxidant activity in postharvest broccoli florets[J]. European Food Research and Technology, 2012, 235(5): 793-800.
[22] 龚吉军, 李忠海, 钟海雁, 等. 乙醇处理对蒌蒿采后生理生化的影响[J].中南林学院学报, 2006, 26(4): 61-64.
[23] ASUMI F, YASUO S, HIROFUMI T, et al. Effects of postharvest ethanol vapor treatment on activities and gene expression of chlorophyll catabolic enzymes in broccoli florets[J]. Postharvest Biology and Technology, 2010, 55(2): 97-102.
[24] SUZUKI Y, KIMURA T, TAKAHASHI D, et al. Ultrastructural evidence for the inhibition of chloroplast-to-chromoplast conversion in broccoli floret sepals by ethanol vapor[J]. Postharvest Biology and Technology, 2005, 35(3): 237-243.
[25] KORAKOT C, SHIOW Y W, CHIEN Y W, et al. Effect of natural volatile compounds on antioxidant capacity and antioxidant enzymes in raspberries[J]. Postharvest Biology and Technology, 2006, 40(2): 106-115.
[26] DURMUS U, ELIF C, AHMET E O, et al. Effects of modified atmosphere packaging and ethanol vapor treatment on the chemical composition of ‘Red Globe’ table grapes during storage[J]. Postharvest Biology and Technology, 2012, 68: 8-15.
[27] 杨爱萍, 汪开拓, 金文渊, 等. 乙醇熏蒸处理对杨梅果实保鲜及抗氧化活性的影响[J]. 食品科学, 2011, 32(20): 277-281.
[28] GUO Rongfang, YUAN Gaofeng, WANG Qiaomei. Sucrose enhances the accumulation of anthocyanins and glucosinolates in broccoli sprouts[J]. Food Chemistry, 2011, 129(3): 1080-1087.
Effect of Pretreatment with Ethanol on Bioactive Compounds and Antioxidant Activity in Fresh-Cut Broccoli Florets
WANG Hui-qian, ZHENG Cong, WANG Hua-dong, WANG Jing, ZHENG Yong-hua*
(College of Food Science and Technology, Nanjing Agricultural University, Nanjing 210095, China)
The effect of ethanol vapor treatment on bioactive compounds, such as total phenols, flavonoids, total glucosinolates and sulforaphane, and antioxidant activity of fresh-cut broccoli florets was investigated. The broccoli heads were pretreated with 2%, 5%, 10% or 20% ethanol vapor at 20 ℃ for 6 h, then cut into small florets and stored at 10 ℃for 10 days. The results showed that pretreatment with 10% ethanol significantly prolonged the shelf life of fresh-cut broccoli, increased the contents of total phenols and flavonoids, delayed the decrease in the contents of total glucosinolates and sulforaphane. This treatment also effectively maintained higher DPPH (1,1-diphenyl-2-picrylhydrazyl) free radical scavenging activity and reducing power, improved superoxide anion and hydroxyl free radical scavenging ability, thereby delaying postharvest senescence and maintaining higher antioxidant activity of fresh-cut broccoli florets. Meanwhile, it was found that there was a significant positive relationship between the contents of total phenols, flavonoids, glucosinolates and DPPH free radical scavenging activity. These results demonstrate that ethanol treatment may be a promising method to extend the shelflife and maintain the nutritional quality of fresh-cut broccoli.
fresh-cut broccoli; ethanol vapor treatment; bioactive components; antioxidant activity
TS255.3
A
1002-6630(2014)16-0250-05
10.7506/spkx1002-6630-201416048
2013-12-20
江苏高校优秀学科建设工程项目(PAPD)
王慧倩(1989—),女,硕士研究生,研究方向为农产品贮藏加工。E-mail:2011108075@njau.edu.cn
*通信作者:郑永华(1963—),男,教授,博士,研究方向为农产品贮藏加工。E-mail:zhengyh@njau.edu.cn

