AMD3100对局灶脑缺血/再灌注大鼠大脑皮质血管再生的影响
庞月珊 罗 勇 谢宸宸 李 满 陈瑞芳 汶海琪
(重庆医科大学附属第一医院神经内科 重庆市神经病学重点实验室,重庆400016)
基质衍生因子-1(stroma derived factor-1,SDF-1)与CXC族趋化因子受体4(CXC chemokine receptor4,CXCR4)结合后能促进造血干/祖细胞迁移、抑制凋亡、促进细胞因子分泌[1]。AC133是干/祖细胞表面标志物,它选择性表达于成人骨髓、胎肝、脐带血和外周血等造血组织的干细胞和循环内皮祖细胞[2]。AMD3100(商品名为Plerixafor)常用来阻断SDF-1/CXCR4轴信号通路,快速动员造血干/祖细胞到外周血[3],但动员到外周血中的干/祖细胞是否参加了局部的血管新生,尚未见统一报道。Takemoto等[4]认为动员到外周血中内皮祖细胞不能参与局部血管再生,而文献[5]用AMD3100局部治疗糖尿病大鼠发现外周血循环内皮祖细胞增多,伤口局部毛细血管密度显著增加。我们在前期实验的基础上连续7d给局灶脑缺血/再灌注大鼠注射AMD3100,检测外周血中AC133mRNA表达和大脑皮质CD31阳性血管新生情况及局部病理变化,以期阐明AMD3100对局灶脑缺血/再灌注损伤后缺血半暗带血管再生的影响。
材料和方法
1.主要试剂
AMD3100(abcam),CD31多克隆抗体(santacruz),DAB显色剂(北京中杉),总RNA提取试剂盒、逆转录试剂盒和荧光定量扩增试剂盒(Takara),SP免疫组化试剂盒及相关耗材(北京鼎国)。
2.模型建立和筛选
根据改良线栓法并参照罗勇等[6]介绍经验制备大鼠右侧大脑中动脉缺血/再灌注模型。清洁级雄性SD大鼠65只由重庆医科大学实验动物中心提供(SCXK(渝)2012-0001),随机分为假手术组(S组5只)、模型组(IR 组20只)、AMD3100组(IRA 组20只)、生理盐水组(IRN组20只)。缺血2h后将IR、IRN和IRA组分为再灌注12h,1、3和7d四个亚组。AMD3100在大鼠缺血2h开始腹腔注射,1.5mg/kg,连续注射7d。IRN组用同样的方法注射等体积生理盐水。根据Longa 5分制评分标准行神经功能学评分:无神经功能缺损,0分;提尾悬吊时左前肢屈曲,1分;平地行走时向左侧转圈,2分;平地行走时身体向左侧倒,3分;意识丧失不能行走,4分[7]。评分1-3分选入实验,0分、4分和 HE染色后无缺血缺氧病理改变的模型不计入实验。
3.荧光定量PCR
取1ml全血,按照Takara说明书提取总RNA,取2μl总RNA逆转录成20μl体系cDNA。根据GenBank提供的序列,Primer-Blast软件设计引物:AC133上游引物5′-CCATGCTCTTACTTCCGGCT-3′,下游引物5′-GTCAGTATCGAGACGGGTCA-3′,产物长度102bp;内参β-Actin上游引物5′-GCAGGAGTACGATGAGTCCG-3′,下 游 引 物 5-ACGCAGCTCAGTAACAGTCC-3′,产 物 长 度 74bp。按Takara荧光定量PCR说明书添加试剂,扩增条件为预变性95℃30s,PCR反应95℃5s,60℃30s,40个循环。
4.免疫组织化学染色
将切片脱蜡至水,3%H2O2室温孵育30min,微波修复21min(高火3min,低火3min,低火与解冻之间15min),自然冷却至室温,加动物血清封闭液室温封闭30min,加一抗(CD31一抗稀释比例为1∶50),同时滴加PBS代替一抗作为阴性对照,4℃过夜,第2d37℃孵育1h,加二抗37℃孵育30min,加链霉素标记卵蛋白,室温孵育30min,DAB显色,苏木素染核、脱色、返蓝、常规脱水、透明、封片。
5.HE染色
常规HE染色,镜下观察核浆染色,封片。
6.血管计数
根据 Weidner[8]改良血管计数法,先用低倍镜(×40)找出血管密度最高的三个热点区域,再用高倍镜(×200)计数被CD31染成阳性的血管数目(血管直径在6个红细胞直径以下或者单个细胞阳性但是和周围细胞分界清楚视为是一个新生血管),每个样本结果用5个高倍镜视野下血管数目均值表示。
7.统计学分析
数据用均数±标准差(¯x±s)表示,应用SPSS 19.0软件作数据统计处理,行单因素方差分析,P<0.05具有统计学意义。
结 果
1.AMD3100对外周血中内皮祖细胞标记物AC133mRNA影响
IRN 12hAC133mRNA表达开始升高,第3d达到高峰,第7d显著减少;与IRN组比较,IRA组各时间点都比较高,IRA 12h外周血AC133mRNA表达显著增高,第1d升高到峰值,第3d表达减少(P<0.05)(图1、表1)。
表1 外周血各时间点AC133mRNA表达±s,n=5)Table 1 1The expression of AC133mRNA in peripheral blood at different time(the values of 2-△△CT)±s,n=5)

表1 外周血各时间点AC133mRNA表达±s,n=5)Table 1 1The expression of AC133mRNA in peripheral blood at different time(the values of 2-△△CT)±s,n=5)
*compare with IRN group,P<0.05
Group Focal cerebral ischemia/reperfusion 12h 1d 3d 7d IRN 0.52±0.05 0.79±0.05 1.12±0.06 0.20±0.01 IRA 0.95±0.07* 2.12±0.10* 1.26±0.18* 0.36±0.03*
图1 PCR扩增曲线和溶解曲线Fig.1Primary curve and solubility curve
2.局灶脑缺血/再灌注后CD31阳性新生血管情况
IRN 1d有血管新生,但以单个细胞为主,管径较小;与S组比较,IRN 3d新生血管密度显著增加,管径增大;IRN 7d新生血管密度继续增大,不同管径血管并存;CD31阳性新生血管主要分布在缺血半暗带,梗死区较少(P<0.05)(图2、表2)。
3.AMD3100对局灶脑缺血/再灌注大鼠大脑皮质缺血半暗带新生血管的影响
与IRN 1d比较,IRA 1d新生血管密度差异无统计学意义(P>0.05);与IRN 3和7d比较,IRA组CD31阳性新生血管密度都显著减少(P<0.01)(图2、表2)。
表2 大脑皮质缺血半暗带各时间点CD31阳性新生血管密度±s,n=5)(n/mm2)Table 2 The CD31vessels density in rat cerebral cortex ischemic penumbra(¯x±s,n=5)(n/mm2)
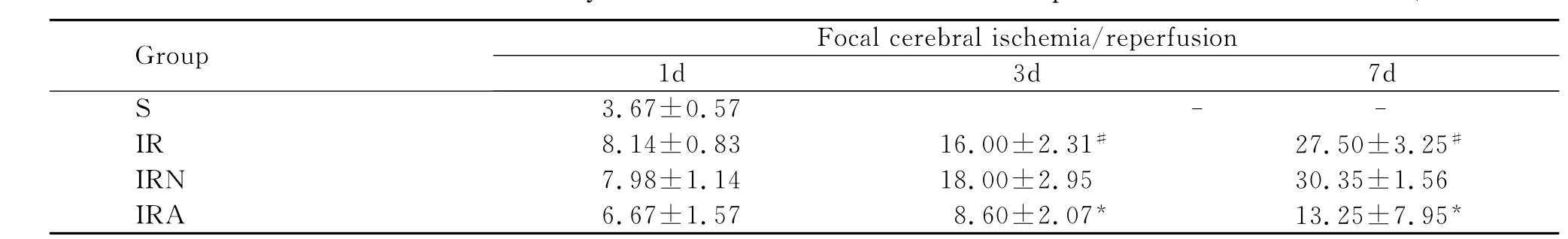
表2 大脑皮质缺血半暗带各时间点CD31阳性新生血管密度±s,n=5)(n/mm2)Table 2 The CD31vessels density in rat cerebral cortex ischemic penumbra(¯x±s,n=5)(n/mm2)
#P<0.01,compare with S group;*P<0.01,compare with IRN 3and 7day
Group Focal cerebral ischemia/reperfusion 1d 3d 7d S 3.67±0.57--IR 8.14±0.83 16.00±2.31# 27.50±3.25#IRN 7.98±1.14 18.00±2.95 30.35±1.56 IRA 6.67±1.57 8.60±2.07* 13.25±7.95*
4.局灶脑缺血/再灌注大鼠大脑皮质病理改变情况
与IRN组比较,HE染色IRA组炎症显得弥散,IRA 7d坏死最严重,梗死区充满泡沫细胞和坏死神经细胞,而IRN组泡沫细胞较少(图3)。
讨 论
以前研究认为组织损伤后血管再生由已存在的血管内皮细胞激活后增殖迁移形成,后续研究发现组织血管形成机制还有血管生成,即来源于骨髓的内皮祖细胞通过增殖分化迁移形成新的有功能的血管[9]。SDF-1是一种由骨髓基质细胞和内皮细胞分泌的对干/祖细胞具有强烈趋化作用的蛋白,能使CXCR4阳性干/祖细胞顺SDF-1浓度梯度迁移。AMD3100阻断SDF-1/CXCR4信号通路后骨髓中干/祖细胞不能迁移归巢到骨髓龛位,从而动员到外周血[10]。IRA 7d脑组织坏死面积比其他组大,梗死部位坏死神经元和泡沫细胞数量较多,这可能因为AMD3100阻断了SDF-1/CXCR4轴的修复过程,加重了梗死部位的病理改变[11]。
CD31是一种特异性较高且只在内皮细胞和白细胞表达的抗原常用来标记血管。AC133mRNA在IRA 12h显著升高,第1d达峰值,第3d下降,这提示连续注射AMD3100后可能引起外周血中表达AC133的内皮祖细胞快速增加,这与其他文献报道AMD3100能快速动员骨髓源性内皮祖细胞进入外周血相符[3,10],但大脑皮质缺血半暗带血管密度却没有随着外周血中内皮祖细胞增加而增加,IRA 3和7d新生血管密度比IRN组显著减少。文献[12]中指出虽然AMD3100大量动员内皮祖细胞到外周血,但其迁移、黏附、克隆能力显著减弱,推测本实验中动员到外周血的内皮祖细胞对大脑缺血皮质血管生成作用较小。AMD3100对第1d血管密度影响较小,可能因为局灶脑缺血/再灌注24h血脑屏障的超微结构开始破坏[13]后更有利于骨髓源性内皮祖细胞通过,所以在这阶段AMD3100对由骨髓内皮祖细胞参与的血管生成影响不大。AMD3100阻断骨髓源性内皮祖细胞归巢的主要信号通路后,IRA 3和7d血管密度显著减少,我们推测骨髓源性内皮祖细胞可能参与局灶脑缺血/再灌注损伤后缺血半暗带血管再生,并发挥着重要作用。
本团队前期研究使用 AMD3100 1.5mg/kg,连续注射4d,第7d发现大脑皮质缺血半暗带新生血管数量比IRN组增多[14],而本研究采用同样方法持续注射7d,第7d时新生血管数量显著减少。这可能因为AMD3100与CXCR4结合是可逆的,AMD3100失去竞争优势后,CXCR4能重新与SDF-1结合恢复促进干/祖细胞迁移、黏附、归巢的能力[15]。因此寻找一种合理的方案,使AMD3100动员到外周血的干/祖细胞发挥其正常生理功能成为未来的研究方向。
图 版 说 明
图2 大脑皮质缺血半暗带各时间点CD31阳性新生血管情况
图3 局灶脑缺血/再灌注7d大脑皮质病理改变
EXPLANATION OF FIGURES
Fig.2The changes of CD31vessels at different time points after focal cerebralischemia/reperfusion in rat cerebral cortex ischemic penumbra(n=5,×200)
Fig.3The Pathologic changes in rat cerebral cortex after focal cerebral ischemia/reperfusion 7day(n=5,×400)
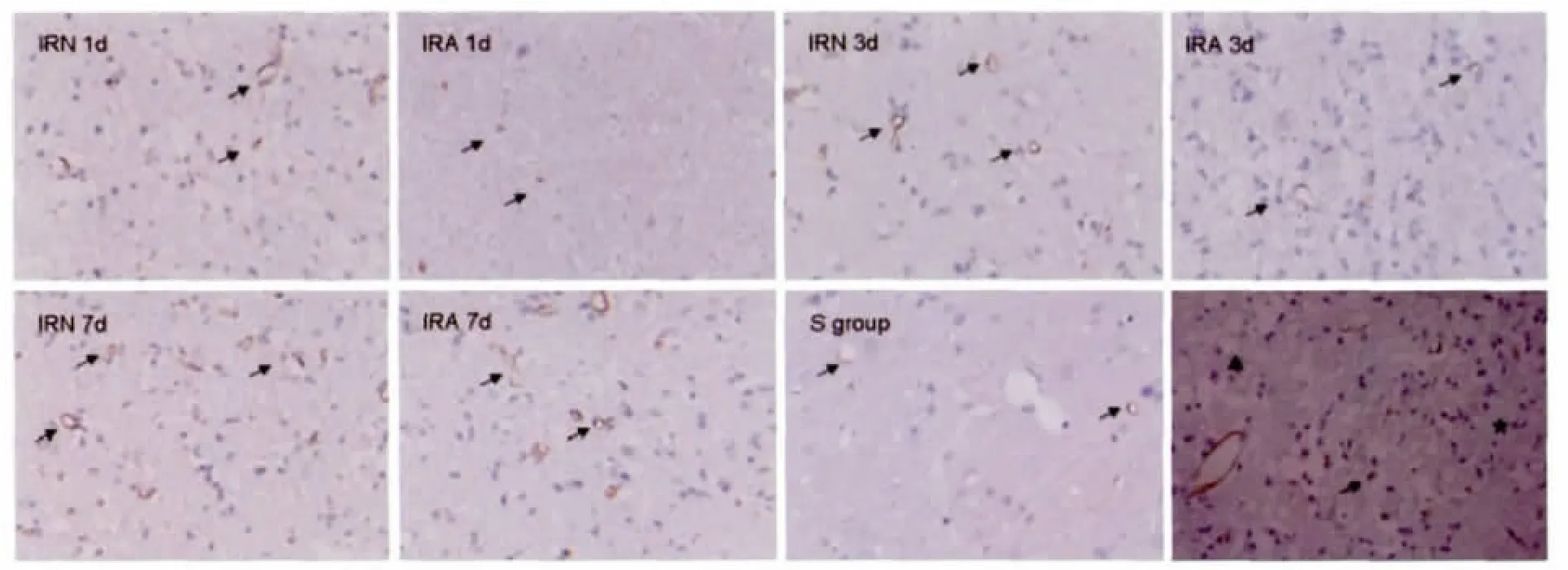
↗CD31vessel;▲Infarction district;★ischemic penumbra
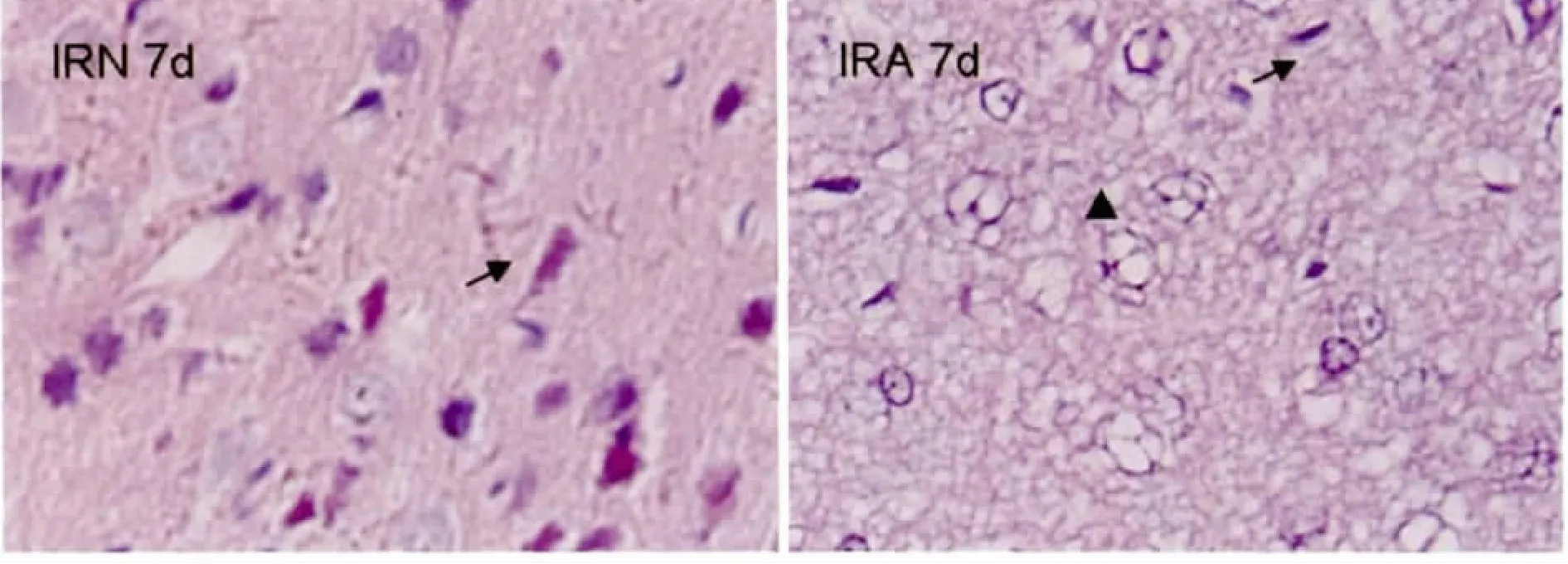
↗necrosis of neurons;▲foam cell
[1]Liu X,Duan B,Cheng Z,et al.SDF-1/CXCR4axis modulates bone marrow mesenchymal stem cell apoptosis,migration and cytokine secretions.Protein Cell,2011,2(10):845-854
[2]王燕宁,徐建民.造血干细胞表面标志物AC133的研究进展.中国新药与临床杂志,2007,26(9):708-714
[3]饶彪锋,黄内红等.AMD3100动员造血干祖细胞作用的量效关系.实验与检验学,2012,30(4):337-340
[4]Takemoto T,Li TS,Kubo M,et al.The mobilization and recruitment of C-Kit + cells contribute to wound healing after surgery.Plos One,2012,7(11):1-9
[5]Nishimura Y,LI M,Qin GJ,et al.CXCR4Antagonist AMD3100Accelerates Impaired Wound Healing in Diabetic Mice.J Invest Dermato,2012,132(3):711-720
[6]罗勇,董为伟.Wistar大鼠插线法局灶性脑缺血/再灌注模型的实验研究.重庆医科大学学报,2002,27(1):1-4
[7]Bederson JB,Pitts LH,Tsuji M,et al.Rat middle cer-ebral artery occlusion:evaluation of the model and development of a neurologic examination.Stroke,1986,17:472-476
[8]Weidner N.Intratumor Microvessel Density as a Prognostic Factor in Cancer.Amercan Journal of Pathology,1995,147(1):9-19
[9]Urbich C,Dimmeler S.Endothelial progenitor cells:characterization and role invascularrbiolgy.Circ Res,2004,95(4):343-353
[10]Broxmeyer HE,Christie M,Clapp W,et al.Rapid mobilization of murine and human hematopoietic stem and progenitor cells with AMD3100,a CXCR4antagonist.J Exp Med,2005,201(8):1307-1318
[11]Wen J,Zhang JQ,Huang W,et al.SDF-1alpha and CXCR4as therapeutic targets in cardiovascular disease.Am J Cardiovasc Dis,2012,2:20-28
[12]王佐,周晓峰,王仁等.AMD3100对apoE-/-小鼠骨髓源行内皮祖细胞增值、迁移和粘附的影响.生物化学与生物物理紧张,2008,35(7):807-813
[13]Ding G,Jiang Q,Li L,et al.Detection of BBB disruption and hem-orrhage by Gd-DTPA enhanced MRI after embolic stroke in rat.Brain Res,2006,1114(1):195-203
[14]赵旺,罗勇.电针对局灶脑缺血再灌注大鼠大脑皮质基质细胞衍生因子-1α表达的影响极其促进脑内血管再生的作用.中华物理医学与康复杂志,2010,32(6):409-413
[15]Simon PF,Anastassov V,Co J,et al.Characterization of the molecular pharmacology of AMd3100:a specific antagonist of the G-protein coupled chemokine receptor,CXCR4.Biochem Pharmacol,2006,72(5):588-596

