选择性环氧合酶-2抑制剂联合奥曲肽诱导人胃癌细胞的凋亡
李 楠 冯振中 赵 艳 谷从友 朱 博 葛 霞
(1蚌埠医学院第一附属医院病理科,蚌埠医学院病理学教研室,安徽,233030;2南京医科大学动脉粥样硬化研究中心,江苏,210029)
胃癌是常见且治疗困难的消化系统恶性肿瘤,发病率和死亡率高居恶性肿瘤前列[1]。许多患者在确诊时,肿瘤已属晚期或已有转移,对失去手术机会的患者,常规细胞毒性化疗药物效果有限,同时易产生严重的毒副反应,包括骨髓抑制、胃肠道反应、肝损害等。近年来研究发现,非细胞毒性抗肿瘤药物,主要是环氧合酶抑制剂和生长抑素(somatostatin,SST)类似物,可以抑制肿瘤生长,副反应较低。本研究观察联合使用选择性COX-2抑制剂NS-398和生长抑素类似物奥曲肽,对胃癌细胞生长的协同抑制作用,为肿瘤临床治疗提供理论依据。
材料和方法
1.材料
1.1主要试剂
NS-398、奥曲肽及 Caspase-3单克隆抗体均为Sigma公司产品,NS-398粉剂以二甲基亚砜(DMSO,美国Sigma)溶解,实验所需终浓度100μmol/L,奥曲肽临用时用RPMI-1640培养液稀释到实验所需终浓度1μmol/L;胎牛血清(FBS)购自杭州四季青生物公司;RPMI 1640培养基购自GIBCO公司;Annexin V-FITC/碘化丙啶(PI)凋亡检测试剂盒为Biouniquer公司产品;COX-2和GAPDH引物合成自美国Invitrogen公司;RNA提取试剂(Trizol法)购自日本TaKaRa公司;RNA逆转录试剂盒购自日本TaKaRa公司。
1.2细胞株
人胃癌细胞株BGC-823,购自中国科学院上海细胞生物学研究所,由本教研室传代保存。
1.3主要仪器
CO2培养箱(Harris HW0301.T-VBA型,美国产),流式细胞计数仪(美国Becton Dickinson公司),倒置相差显微镜(日本Olympus公司产品),GDS-8000型凝胶扫描成像系统(美国UVP公司),GeneQuant核酸定量仪(美国Pharmacia Biotech公司),7500Fast Real-Time PCR System(美国 Applied Biosystems公司),超净工作台为苏州净化设备厂产品。
2.方法
2.1细胞培养
将BGC-823细胞用RPMI-1640培养液加10%FBS,置于37℃、5%CO2培养箱中常规培养,每日换液一次,2-3d传代一次。实验时取对数生长期细胞,于培养瓶内生长至80%时,用胰酶消化后制成细胞悬液备用。
2.2细胞形态学观察
青辰处于天葬场的外围,骷髅鬼阵的余威便已令他胆战心惊。他蜷缩在大树的背后,在呼嚎的黑风与漫天的沙尘中,努力睁眼朝着阵的中心望。那里,天葬刀朝外散发着血色的光芒,将师父干枯的身子笼罩在其中。那团红芒是一个巨大的骷髅头,与天葬刀刀柄处的骷髅彼此呼应。他对天葬刀非常熟悉,他有一种感觉,那个红色的虚影,就是天葬刀的刀魂。就像人有血肉和灵魂,一把刀,也有躯体和刀魂。它用千年来的无数生命和鲜血滋养,让自己的刀魂生出了灵性。
将收集的胃癌BGC-823细胞稀释为单细胞悬液,调整细胞浓度为5×104/ml,加入24孔培养板中,每孔2ml,共8孔,待细胞贴壁后,加入三组药物,不加药的2孔为对照组,培养72h。在24h、48h、72h这3个时间点上分别用倒置相差显微镜观察细胞形态,用WinfaStPVR软件记录结果并直接摄片。
2.3细胞生存曲线
取对数生长期细胞1.0×105于50ml培养瓶内,分4组,每组复设3瓶,37℃、5%CO2培养箱中培养24h。更换培养基,分别加入三组药物,不加药的为对照组,继续培养,分别于1-5d各计数一次加药组及对照组的细胞数,取细胞计数平均值,以作用时间为横坐标,细胞计数为纵坐标绘制细胞生长曲线。
2.4流式细胞仪检测细胞凋亡率(Annexin VPI双染色法)
取对数生长期细胞,以1.0×105/ml的细胞浓度接种于24孔板,每孔2ml,经NS-398、奥曲肽和联合应用组处理后继续培养24h,每组设2个复孔,设不加药为对照组。细胞用0.25%胰蛋白酶消化,吹起后收集,在PBS中离心、清洗2次,用预冷的结合缓冲液重悬细胞,AnnexinV-FITC和PI双染色法,流式细胞仪检测细胞凋亡率。
2.5实时定量(Real-time)PCR测定 COX-2基因表达
取对数生长期细胞,经NS-398、奥曲肽和联合应用组处理后继续培养24h,Trizol法提取总RNA,逆转录为cDNA,测定cDNA浓度。实时定量PCR反应体系测定COX-2mRNA的表达,结果以GAPDH为内参计算相对值。
COX-2:Forward-TTCAAATGAGATTGTGGGAAAATT;
Reverse-AGATCATCTCTGCCTGAGTATCTT ;
GAPDH:Forward-CCATTTGCAGTGGCAAAG;
Reverse-CACCCCATTTGATGTTAGTG。
2.6Western blot检测 Caspase-3蛋白表达
用裂解液处理收集细胞,BCA法测定蛋白浓度,取80μg胞浆蛋白与6×SDS Loading Buffer混合,95℃加热样品5min。以蛋白提取液样品作SDS-PAGE电泳后转膜,封闭后加入一抗,抗体稀释浓度为1∶1000,于4℃摇动下过夜,次日用TBST清洗,10min×3次。将膜与辣根过氧化物酶标记的相应二抗室温孵育2h,抗体稀释浓度为1∶3000,TBS-T清洗10min×3次。临用前将ECL显色液A与B 1∶1混和,均匀滴加至膜表面,用高敏荧光成像系统观察结果。
3.统计学处理
实验结果以均数±标准差(¯x±s)表示,所得数据用SPSS14.0统计软件包 One-Way Anova检验进行统计学处理,显著性检验采用单因素方差分析,P<0.05表示差异有统计学意义。
结 果
1.药物对BGC-823细胞形态的影响
药物作用后,在24h、48h、72h这3个时点上分别用倒置相差显微镜观察细胞形态,对照组细胞生长旺盛,贴壁生长,呈单层鹅卵石样紧密排列,为不规则多边形,胞质均匀透明,核质比较大,伪足较长(图1A);实验组:给予NS-398,细胞生长明显受抑制,大部分细胞伪足回缩,排列杂乱,折光率下降(图1B);给予奥曲肽,细胞变小变圆,或松散或聚集成团(图1C);联合用药大部分细胞固缩、分解,出现细胞碎片和悬浮现象,细胞形态改变明显强于单独用药组(图1D),且存在时间依赖性(图2),即两种药物单独使用或联合使用48h的细胞形态学改变明显强于24h(P<0.05),两种药物单独使用或联合使用72h的细胞形态学改变明显强于48h(P<0.05)。
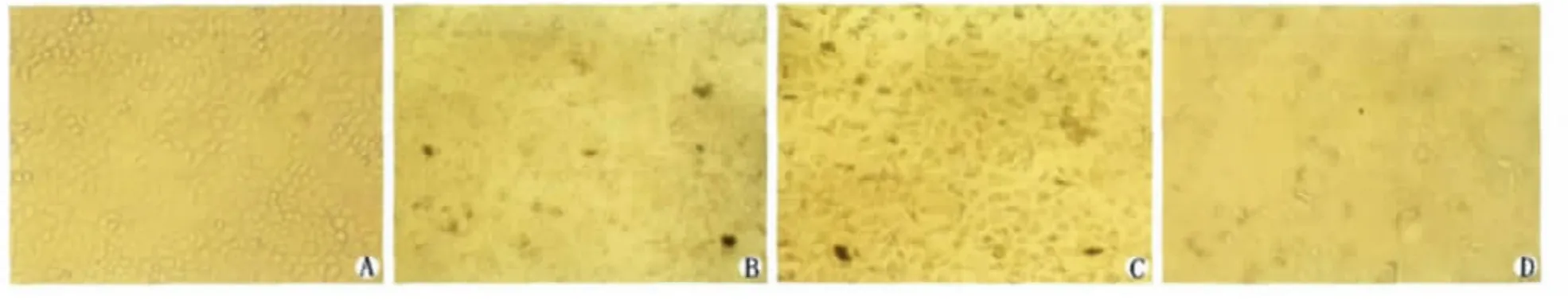
A Control 24h(×100);B 100μmol/L NS-398 24h(×100);C 1μmol/L Octreotide 24h(×100);D 100μmol/L NS-398+1μmol/L Octreotide 24h(×100)图1 四组药物作用24h细胞形态学变化Fig.1Changes in the morphology of BGC-823cells dealed with four-group drugs for 24h
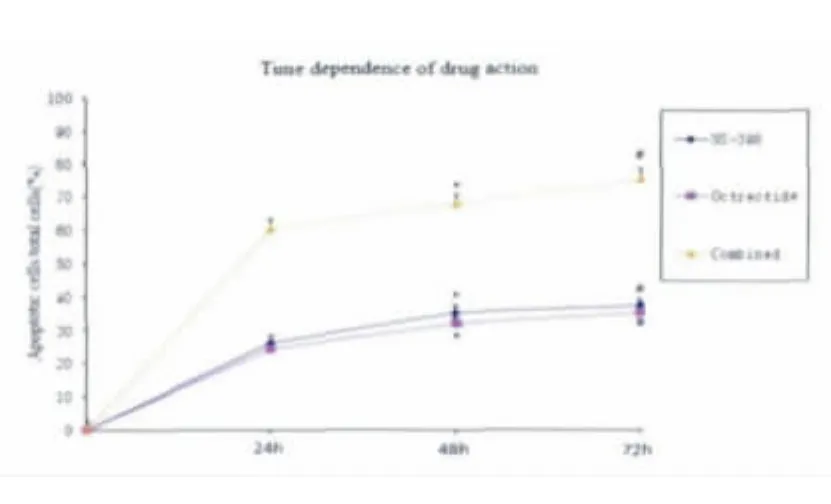
图2 药物作用的时间依赖性Fig.2Time depengence of drug action(*P<0.05vs.24h,#P<0.05vs.48h)
2.药物对BGC-823细胞生长的影响
处于对数生长期的人胃癌细胞株BGC-823在未给予药物干预时细胞分裂增殖旺盛;单独给予100μmol/L NS-398,1μmol/L奥曲肽时,细胞分裂增殖在干预后第3d开始出现明显减缓,第5d甚至出现“负增长”;联合100μmol/L NS-398+1μmol/L奥曲肽时,细胞分裂增殖在干预后第2d开始出现明显减缓,第3d出现“负增长”。结果表明药物不仅抑制细胞的增殖,而且导致细胞死亡,联合组抑制细胞增殖、促进细胞死亡的作用明显强于单独用药组(图3,图4)。

*P<0.05Control vs.NS-398and Octreotide图3 药物对BGC-823细胞生长曲线的影响Fig.3Drugs influence the growth curve of BGC-823cells
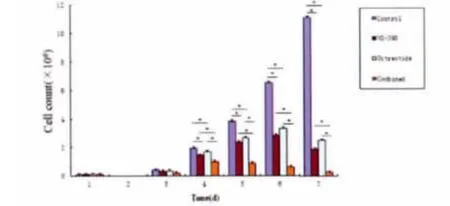
*P<0.05Control vs.NS-398and Octreotide#P<0.05Combined vs.NS-398and Octreotide图4 药物对BGC-823细胞生长的影响Fig.4Drugs influence the growth of BGC-823cells
3.药物诱导BGC-823细胞凋亡
在流式细胞仪的散点图上,1区为坏死细胞群,2区为晚期凋亡细胞群,3区为存活细胞群,4区为早期凋亡细胞群(图5)。FCM检测显示随着作用时间的延长,细胞凋亡率逐渐增加。作用24h时,单纯NS-398组、单纯奥曲肽组、联合组与对照组相比较,差异具有显著性(P<0.01),联合组细胞凋亡率显著高于单一用药组(P<0.01);48h时,单纯 NS-398组、单纯奥曲肽组、联合组与对照组相比较,差异具有显著性(P<0.01),联合组细胞凋亡率显著高于单一用药组(P<0.01),与24h组相比较,凋亡率差异具有显著性(P<0.01)(表1)。

表1 流式细胞仪测定药物诱导BGC-823细胞的凋亡率Table 1 Effect of drugs on apoptosis of BGC-823cells by flow cytometry(FCM)

图5 药物作用48h对BGC-823细胞凋亡率的影响Fig.5Effect of drugs on apoptosis of BGC-823cells for 48h
4.药物处理后BGC-823细胞 COX-2mRNA表达的变化
空白对照组的BGC-823细胞COX-2表达水平较高,分别经三组药物作用24h后,与对照组相比表达均下调(P<0.05),联合用药组COX-2mRNA表达显著低于单一用药组(P<0.01)(表2)。

表2 BGC-823细胞COX-2mRNA表达的比值(%)Table 2 The ratio of COX-2mRNA in BGC-823cells(%)

Values are expressed as mean±SD.*P<0.05vs.control,#P<0.01vs.NS-398,△P<0.01vs.Octreotide
5.药物处理后 BGC-823细胞 Caspase-3蛋白的表达
NS-398、奥曲肽及联合应用组处理BGC-823细胞24h后,Caspase-3蛋白表达率分别为26.14%、33%、67.34%,均较对照组升高(P<0.05),并且联合应用组表达量明显高于单一用药组 (P<0.05)(图6)。

图6 药物对BGC-823细胞Caspase-3蛋白表达的影响Fig.6Effect of drugs on the expressions of Caspase-3protein
讨 论
环氧合酶-2是催化花生四烯酸转化为前列腺素的关键酶,在胃癌、大肠癌、食管癌、肝癌等多种恶性肿瘤组织中高表达,并与肿瘤复发、血行转移和预后密切相关[1],提示以COX-2作为肿瘤治疗的分子靶向,使用COX-2抑制剂防治肿瘤,可能成为肿瘤治疗的新方向。本实验结果表明,选择性COX-2抑制剂NS-398可以显著抑制人胃癌BGC-823细胞的增殖,在一定范围内,具有明确的时间依赖性,而倒置相差显微镜观察和流式细胞仪检测均表明NS-398也具有诱导肿瘤细胞凋亡的作用。奥曲肽是人工合成的SST类似物,SST及类似物与其特异性受体结合后,可降低丝裂原活化蛋白激酶活性,干扰细胞周期,抑制细胞生长,诱导细胞凋亡[2];也可降低肿瘤的血管内皮生长因子水平,减少肿瘤血管形成,抑制肿瘤侵袭和转移[3]。本实验结果提示奥曲肽能直接诱导胃癌细胞凋亡,这是其抗肿瘤作用的重要机制之一。
NS-398和奥曲肽对胃癌BGC-823细胞的增殖均有抑制作用,但两种药物联合治疗对肿瘤的抑制作用及相关机理研究较少。本实验结果显示联合用药对BGC-823细胞的生长呈协同抑制作用,其效果明显高于单一用药组。由于NS-398和奥曲肽抗肿瘤的机制不尽相同,具体在哪些共同环节上产生协同作用尚不清楚,可能的机制包括:①上调Caspase-3蛋白表达:Caspase-3是凋亡的执行者,在细胞凋亡的信号传导中处于最下游,许多凋亡的信号最终会集结到此蛋白[4]。Caspase-3正常以酶原(32KD)的形式存在于胞浆中,在凋亡的早期阶段,它被激活,活化的Caspase-3由两个大亚基(17KD)和两个小亚基(12KD)组成,裂解相应的胞浆胞核底物,最终导致细胞凋亡。在本实验中,NS-398和奥曲肽作用均使BGC-823细胞中Caspase-3蛋白表达上调,联合用药后,Caspase-3蛋白表达增加更为明显,提示NS-398和奥曲肽均能直接诱导胃癌细胞凋亡,这是其协同抗肿瘤的重要机制之一[5]。②环氧合酶途径:恶性肿瘤中COX-2一般呈高表达,COX-2通过促进前列腺素E2(PGE2)的合成,刺激肿瘤新生血管形成,肿瘤新生血管是肿瘤生长和转移的基础,它可以为肿瘤生长提供充足的血供,同时不断地向宿主输出肿瘤细胞,导致恶性肿瘤的生长和侵袭。本研究发现,NS-398和奥曲肽可有效降低BGC-823肿瘤细胞中 COX-2的含量[6],抑制胃癌的血管生成,从而抑制癌细胞增殖,促进肿瘤细胞凋亡,而联合应用时COX-2的表达降低更明显,抑制增殖更有效,提示两者可通过抑制COX-2的表达产生协同抗肿瘤作用。有研究报道,奥曲肽能抑制转录激活蛋白-1(AP-1)的活化,而 COX-2启动子上有 AP-1结合位点[7],当两者联合应用时,可能加强抑制 AP-1的DNA结合活性,降低COX-2及其他生长因子的水平甚至停止,从而产生显著的抑制肿瘤生长、诱导肿瘤死亡的作用[8]。③信号通路途径:MAPK信号传导通路在恶性肿瘤的发生和发展中有着重要的作用,可以促进肿瘤细胞增殖、抑制肿瘤细胞凋亡、诱导肿瘤血管生成等。奥曲肽可通过SSTR的介导激活酪氨酸磷酸化酶(PTP),从而调控 MAPK活性,影响癌基因c-myc、c-jun的转录,抑制 DNA 的合成,使肿瘤细胞进入 G0期而停止增殖[9];Hussin等[10]的研究发现NSAIDs也能抑制 MAPK通路中细胞外信号调节激酶ERK,两者联合应用可能共同抑制了MAPK信号通路的活化,减少肿瘤DNA、蛋白质的合成,抑制肿瘤生长。
综上所述,选择性COX-2抑制剂能够抑制肿瘤生长,同时可避免胃肠道黏膜损伤等不良反应,奥曲肽也具有抗肿瘤的作用,并与生长抑素受体结合抑制胃酸分泌,进一步减少胃肠道黏膜损伤,所以奥曲肽联合NS-398对肿瘤治疗有高效、协同抑制、低副作用等优点,具有良好的临床应用价值。本实验结果来自于体外培养的胃癌BGC-823细胞株,对于药物在体内的效果及机制尚不明确,还需建立动物模型甚至临床研究予以证实。
[1]Gu KS,Chen Y.Mechanism of P-glycoprotein expression in the SGC7901human gastric adenocarcinoma cell line induced by cyclooxygenase-2.Asian Pac J Cancer Prev,2012,13:2379-2383
[2]高峻,许国铭.长效生长抑素类似物在消化系疾病中的应用.中华消化杂志,2008,28:787-789
[3]Grozinsky-Glasberg S,Kaltsas G,Gur C,et al.Longacting somatostatin analogues are an effective treatment for type 1gastric carcinoid tumours.Eur J Endocrinol,2008,159:475-482
[4]Li S,Tian D,Fei P,et al.A cyclooxygase-2inhibitor NS-398-enhanced apoptosis of esophageal carcinoma cell EC9706by adjusting expression of survivin and caspase-3.Cancer Invest,2011,29:102-106
[5]Mao JD,Wu P,Xia XH,et al.Correlation between expression of gastrin,somatostatin and cell apoptosis regulation gene bcl-2/bax in large intestine carcinoma.World J Gastroenterol,2005,11:721-725
[6]Liu JF,Zhu GJ,Jamieson GG,et al.NS-398induces apoptosis in human esophageal cancer cells through inhibition of NF-kappaB downstream regulation of cyclooxygenase-2.Cancer Invest,2009,27:17-23
[7]Ding M,Dong Z,Chen F,et al.Asbestos induces activator protein-1transactivation in transgenic mice.Cancer Res,1999,59:1884-1889
[8]Sun WH,Zhu F,Chen GS,et al.Blockade of cholecystokinin-2receptor and cyclooxygenase-2synergistically induces cell apoptosis,and inhibits the proliferation of human gastric cancer cells in vitro.Cancer Lett,2008,263:302-311
[9]Jia WD,Zhang CH,Xu GL,et al.Octreotide therapy for hepatocellular carcinoma:a systematic review of the evidence from randomized controlled trials.Hepatogastroenterology,2010,57:292-299
[10]Husain SS,Szabo IL,Pai R,et al.MAPK(ERK2)kinase:a key target for NSAIDs-induced inhibition of gastric cancer cell proliferation and growth.Life Sci,2001,69:3045-3054

