X盒子结合蛋白1对肾小管上皮细胞脂质代谢的影响研究
李宏博 朱 琳 赵 松 刘淑霞 赵 雪 郝 军*
(1河北医科大学病理学教研室,石家庄050017;2河北医科大学第三医院肌电图室,石家庄050051)
内质网应激也被称作非折叠蛋白反应 (unfolded protein response,UPR),已被证实参与了糖尿病肾病的发生,内质网应激反应是一个复杂的过程,涉及了多种调控因子和通路[1]。其中,内质网跨膜激酶1/X 盒子结合蛋白-1(inositol requiring 1/X-box binding protein1,IRE1/XBP-1)是经典的内质网应激信号通路,当内质网应激发生时,该通路被激活,进一步避免细胞凋亡的发生[2]。XBP-1有两种状态:非拼接型和拼接型,其中拼接型XBP-1比非拼接型XBP-1有更强的转录活性,通过影响基因转录来调节相关的生理活性[3]。
近年来,有研究发现XBP-1除了参与内质网应激外,还具有调节肝脏脂质代谢的功能。在XBP-1敲除小鼠,影响肝脏脂质代谢,导致血清甘油三酯和胆固醇降低[4]。Nishina等人发现高表达丙型肝炎病毒蛋白的转基因小鼠,喂食过量含铁食物,导致固醇调节元件结合蛋白-1(sterol regulatory element binding protein-1,SREBP-1)、脂肪酸合成酶(fatty acid synthase,FASN)、拼接型和非拼接型 XBP-1、磷酸化真核生物翻译起始因子2α(phosphorylated eukaryotic initiation factor-2alpha, p-eIF2α),CCAAT/增强子结合蛋白同源蛋白(CCAAT/enhancer-binding protein homology protein,CHOP)高表达以及细胞内大量自噬体。然而,抗氧化剂N乙酰半胱氨酸(N-acetyl cysteine,NAC)显著降低了转基因小鼠的拼接型和非拼接型 XBP-1、peIF2α、CHOP和肝脂肪变性[5]。肾脏脂质代谢异常被揭示参与了多种肾脏疾病,例如糖尿病肾病、狼疮性肾炎、原发性肾小球肾炎等。XBP-1是否是导致肾脏细胞出现脂质沉积的机制之一还未见报道。
因此,本研究使用人肾近端小管上皮细胞(human renal proximal tubular cell line,HKC),转染拼接型和非拼接型XBP-1质粒,48h后检测脂质代谢因子脂肪酸合成酶、乙酰辅酶A羧化酶(Acetyl-CoA carboxylase,ACC)和脂肪分化相关蛋白(adipose differentiation related protein,ADRP),以明确高表达的XBP-1对肾小管上皮细胞脂质代谢的影响。
材料和方法
1.试剂
油红O购自美国Sigma公司,脂质体2000、Trizol和逆转录试剂盒购自Invitrogen公司,兔抗XBP-1抗体购自Abcam公司,兔抗β-actin抗体购自Epitomics公司,PCR扩增试剂购自Promega公司。拼接 型 XBP-1 质 粒 (spliced XBP-1plasmid,XBP-1splasmid)和非拼接型XBP-1质粒(unspliced XBP-1plasmid,XBP-1μplasmid)由日本京都大学生物物理研究室的Kazutoshi Mori教授惠赠。
2.细胞
人肾小管上皮细胞株由301医院陈香美教授惠赠,细胞采用含10%胎牛血清的DMEM培养基培养,细胞随机分为三组:未转染组、空质粒转染组(pcDNA3.1)、拼接型 XBP-1 质粒转染组(XBP-1s plasmid)和未拼接型 XBP-1质粒转染组(XBP-1μ plasmid)。
3.方法
3.1瞬时转染
瞬时转染采用脂质体2000,HKC细胞培养于6孔板内,待细胞生长至约90%时,进行转染。4.0μg载体DNA和10μl脂质体2000分别溶解于250μl无血清DMEM培养基内,混合,室温放置20min后加入6孔板内。5h后更换全血培养基,48h后进行相关检测。
3.2免疫印迹
从HKC细胞提取总蛋白,经10%SDS-PAGE凝胶电泳分离蛋白,将蛋白转移至PVDF膜,含5%BSA的TTBS 37℃孵育1h,一抗4℃孵育过夜,XBP-1(1∶500)、β-actin(1∶1000)。PVDF膜用TTBS清洗3次,每次10min,二抗(1∶5000)室温孵育2 h,TTBS洗膜3次后,加ECL发光液孵育1min,红外线凝胶成像仪检测,图像分析采用IPP5.0,以目的基因与β-actin条带的IOD比值作为最终结果。
3.3逆转录PCR
细胞用PBS洗涤2次,尽量将液体吸干,加入Trizol 1ml裂解细胞进行RNA提取,选择波长260nm测RNA总浓度,A260/A280在1.8-2.0之间。在逆转录酶(MLV)催化下合成cDNA,以适量cDNA为模板在TaqDNA聚合酶催化下进行PCR扩增,所用引物均由Invitrogen公司合成(见Tab.1)。扩增条件为:预变性94℃5min,进入循环,94℃50s,55℃50s,72℃50s,30个循环后72℃8min。将PCR产物在2%琼脂糖凝胶中进行电泳,置于凝胶图像分析系统,用LabWorks 4.5软件进行积分光密度值(integrated optical density,IOD)测定,以管家基因GAPDH作为内参照校正,用目的基因的积分光密度值与GAPDH积分光密度值的比值代表目的基因的相对表达含量。

表1 FASN,ACC和GAPDH引物和扩增片段Table 1 Primers and product for FASN,ACC and GAPDH
3.4免疫细胞化学
HKC细胞培养于盖玻片,终止培养后,10%中性福尔马林固定15min,0.3% 曲拉通X-100 37℃孵育20min,山羊血清37℃封闭30min,抗ADRP一抗(1∶100)4℃孵育过夜,PBS洗3次,每次5min,生物素化的二抗37℃孵育30min,PBS洗3次,每次5min,辣根过氧化物酶标记的链霉亲和素37℃孵育30min,PBS洗3次,每次5min,DAB显色。以PBS代替一抗做阴性对照。
3.5油红O染色
HKC细胞培养于盖玻片上,终止培养后,10%中性福尔马林固定15min,油红O染液染色15 min,玻片70%酒精中浸泡5s以去除背景着色。苏木素复染,自来水冲洗干净,晾干后甘油明胶封片。
4.统计学分析
所有数据以均数± 标准差表示,采用SPSS 13.0统计学软件进行分析,均数比较采用单因素方差分析(ANOVA),组间两两比较采用Student-Newman-Keuls法,P<0.05被认为有统计学意义。
结 果
1.拼接型和非拼接型XBP-1质粒转染HKC细胞上调XBP-1表达
拼接型XBP-1质粒转染HKC细胞48h后,拼接型XBP-1(分子量为54kDa)明显升高,分别为空白对照组和空质粒转染组的3.73倍和3.72倍,但对非拼接型XBP-1(分子量为33kDa)的表达未产生明显影响。相似地,非拼接型XBP-1质粒上调了HKC细胞非拼接型XBP-1蛋白的表达,对拼接型XBP-1未见影响(Fig.1)。
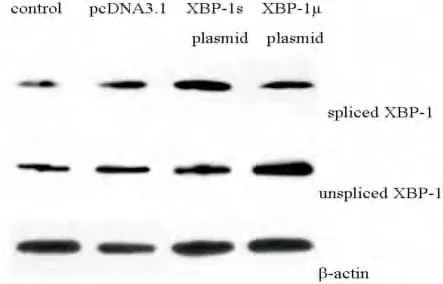
图1 拼接型和非拼接型XBP-1质粒上调HKC细胞XBP-1蛋白表达Fig.1The spliced XBP-1plasmid and unspliced XBP-1 plasmid elevated XBP-1protein in HKC cells
2.拼接型 XBP-1质粒上调 HKC细胞内FASN、ACC mRNA表达
FASN和ACC是脂肪酸代谢中的关键酶,转染拼接型XBP-1质粒的 HKC细胞FASN和ACC mRNA均明显升高,分别是空质粒转染组的2.07倍和1.82倍;然而,非拼接型XBP-1质粒对 HKC细胞FASN和ACC mRNA的表达未产生明显影响(Fig.2)。
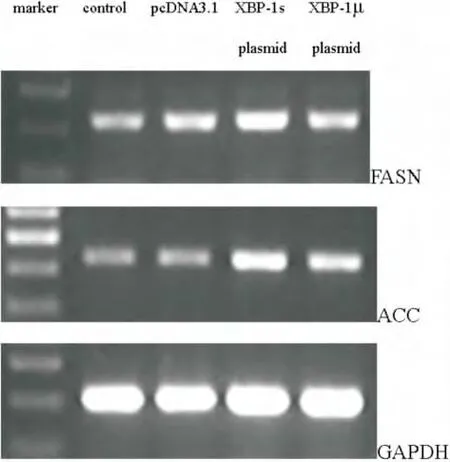
图2 拼接型XBP-1质粒升高了HKC细胞FASN和ACC mRNA的表达Fig.2The spliced XBP-1plasmid increased FASN and ACC mRNA in HKC cells
3.拼接型XBP-1质粒升高了HKC细胞ADRP表达和细胞内脂滴
ADRP是细胞内脂滴的标记蛋白,相比于空质粒转染组和非拼接型XBP-1质粒转染组,拼接型XBP-1质粒显著升高了HKC细胞内ADRP蛋白的表达(Fig.3)。油红O染色被用来检测细胞内脂滴形成情况,结果揭示拼接型XBP-1质粒可明显升高HKC细胞内脂滴(Fig.4)。

图3 免疫细胞化学检测HKC细胞ADRP表达 (×400)A:正常对照组;B:空白质粒组;C:拼接型XBP-1质粒组;D:非拼接型XBP-1质粒组Fig.3ADRP expression in HKC cells of immunocytochemistry(×400)A:normal control group;B:blank plasmid group;C:spliced XBP-1plasmid group;D:unspliced XBP-1plasmid group
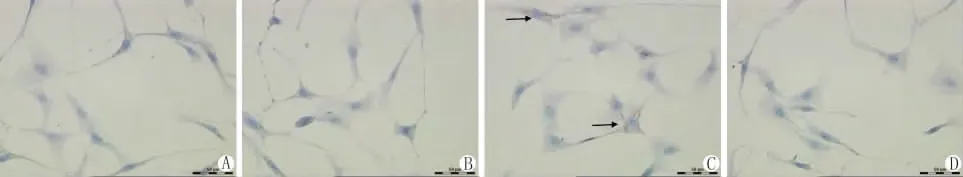
图4 油红O染色检测HKC细胞内脂滴 (×400)A:正常对照组;B:空白质粒组;C:拼接型XBP-1质粒组;D:非拼接型XBP-1质粒组箭头示细胞内脂滴Fig.4Lipid droplet formation of HKC cells by Oil Red O staining(×400)A:normal control group;B:blank plasmid group;C:spliced XBP-1plasmid group;D:unspliced XBP-1plasmid group arrows show cellular lipid droplets
讨 论
X-盒子是位于人类白细胞抗原(human leukocyte antigen,HLA)DR alpha启动子区的保守转录元件,X-盒子结合蛋白1是一种结合于X-盒子的转录因子[6]。由非拼接型XBP1(μ)mRNA翻译而来,分子量为33kDa,XBP1(μ)蛋白具有DNA结合区域,但没有活性区域。XBP1(μ)mRNA 经IRE1拼接后,阅读框发生移位,翻译后形成54kDa大小的蛋白,即拼接型 XBP-1(s)蛋白,含有DNA结合区和活性区[7]。
有研究揭示XBP-1有多种功能,如浆细胞分化[8],病毒复制,内质网应激反应[9],最近有报道证实XBP-1有新的功能,可通过影响肝脏的脂质代谢降低血清甘油三酯和胆固醇的含量[4]。随后陆续有研究也揭示了XBP-1对脂质代谢的影响。So JS等人发现XBP-1缺乏反馈性激活上游的IRE1α,进而启动调节性IRE-1依赖性降解过程(regulated IRE-1-dependent decay,RIDD),导致细胞内 mRNAs的降解,参与调控细胞的脂质代谢。抑制调节性IRE-1依赖性降解过程或IRE1α可逆转XBP-1基因敲除小鼠的低脂血症。而在高血脂的动物模型,抑制XBP-1可有效改善肝脏脂肪变性、肝脏损伤和高胆固醇血症[10]。Gregor MF等人在哺乳期的小鼠发现,敲除脂肪细胞的XBP-1减少了奶的产量,幼鼠生长缓慢,提示脂肪细胞XBP-1对哺乳期的脂质代谢有重要影响[11]。
肾脏脂质沉积见于多种疾病,如糖尿病肾病,肾小球肾炎,狼疮性肾炎,是引起肾脏硬化和功能不全的重要因素之一[12]。ADRP首先由Ginette等人克隆[13],是一种脂滴标记蛋白。目前,XBP-1蛋白是否对肾脏固有细胞ADRP表达和脂质代谢有影响还未见研究。本研究针对肾小管上皮细胞,研究了XBP-1蛋白对细胞内脂质代谢的影响,结果揭示非拼接型XBP-1质粒和拼接型XBP-1质粒转染人肾小管上皮细胞后,分别升高了非拼接型XBP-1蛋白和拼接型XBP-1蛋白表达。然而,只有拼接型XBP-1蛋白升高可增强FASN、ACC mRNA表达,继而使ADRP表达升高,细胞内脂滴增多,提示XBP-1蛋白的拼接是引起肾小管上皮细胞脂质合成增多的机制之一。Sha等人的研究也证实XBP-1基因敲除小鼠胚胎成纤维细胞和3T3-L1细胞均呈现明显的脂质生成障碍[14]。综上所述,肾小管上皮细胞拼接型XBP-1蛋白升高可导致细胞内脂质合成相关基因表达增强,细胞内脂滴增多,可能是多种肾脏疾病出现脂质沉积的机制之一。
[1]Hummasti S,Hotamisligil GS.Endoplasmic reticulum stress and inflammation in obesity and diabetes.Circ Res,2010,107(5):579-591
[2]Walter P,Ron D.The unfolded protein response:from stress pathway to homeostatic regulation.Science,2011,334(6059):1081-1086
[3]Yoshida H,Matsui T,Yamamoto A,et al.XBP1mRNA is induced by ATF6and spliced by IRE1in response to ER stress to produce a highly active transcription factor.Cell,2001,107(7):881-891
[4]Lee AH,Scapa EF,Cohen DE,et al.Regulation of hepatic lipogenesis by the transcription factor XBP1.Science,2008,320(5882):1492-1496
[5]Nishina S,Korenaga M,Hidaka I,et al.Hepatitis C virus protein and iron overload induce hepatic steatosis through the unfolded protein response in mice.Liver Int,2010,30(5):683-692
[6]Liou HC,Boothby MR,Finn PW,et al.A new member of the leucine zipper class of proteins that binds to the HLA DR alpha promoter.Science,1990,247(4950):1581-1584
[7]Lee AH,Iwakoshi NN,Glimcher LH.XBP-1regulates a subset of endoplasmic reticulum resident chaperone genes in the unfolded protein response.Mol Cell Biol,2003,23(21):7448-7459
[8]Hu CC,Dougan SK,McGehee AM,et al.XBP-1regulates signal transduction,transcription factors and bone marrow colonization in B cells.EMBO J,2009,28(11):1624-1636
[9]Iwakoshi NN,Lee AH,Vallabhajosyula P,et al.Plasma cell differentiation and the unfolded protein response intersect at the transcription factor XBP-1.Nat Immunol,2003,4(4):321-329
[10]So JS,Hur KY,Tarrio M,et al.Silencing of lipid metabolism genes through IRE1α-mediated mRNA decay lowers plasma lipids in mice.Cell Metab,2012,16(4):487-499
[11]Gregor MF,Misch ES,Yang L,et al.The role of adipocyte XBP1in metabolic regulation during lactation.Cell Rep,2013,3(5):1430-1439
[12]Sun L,Halaihel N,Zhang W,et al.Role of sterol regulatory element-binding protein 1in regulation of renal lipid metabolism and glomerulosclerosis in diabetes mellitus.J Biol Chem,2002,77(21):18919-18927
[13]Jiang HP,Serrero G.Isolation and characterization of a full-length cDNA coding for an adipose differentiation-related protein.Proc Natl Acad Sci USA,1992,89(17):7856-7860
[14]Sha H,He Y,Chen H,et al.The IRE1alpha-XBP1 pathway of the unfolded protein response is required for adipogenesis.Cell Metab,2009,9(6):556-564
——疾病防治的新靶标

