MMP-7和Survivin在结直肠癌中的表达及其临床意义
景桂英 欧玉荣 承泽农 董修琴
(蚌埠医学院第一附属医院病理科,安徽233030)
结直肠癌(colorectal cancer,CRC)是消化系统常见的恶性肿瘤之一,近年来,其发病率和死亡率仍呈上升趋势,目前结直肠癌患者的治疗通常以手术和放化疗为主,尽管具有一定的疗效,但大多数患者预后仍然较差。结直肠癌发生的机制很复杂,近年来许多学者研究发现经典的Wnt信号通路即Wnt/β-catenin/Tcf信号通路是在生物的细胞分化、形态发生、结构形成和肿瘤演进等方面起着重要作用[1],特别是与结直肠癌的关系非常密切。Wnt信号通路由一系列的癌基因与抑癌基因组成,通路上任何一个成员的异常将会导致通路的传导异常。研究发现MMP-7和Survivin是 Wnt信号通路核内转录因子TCF的下游靶基因,二者的激活对肿瘤细胞的失控性增殖具有促进作用。本研究通过检测MMP-7和Survivin在结直肠癌及癌旁正常黏膜组织中蛋白的表达情况,并分析两者与结直肠癌临床病理特征的关系,探讨其在结直肠癌发生、发展、侵袭和转移中的作用,为其在结直肠癌中的早期诊断、临床进展和靶点治疗提供科学的理论依据。
材料和方法
1.研究对象和标本来源
收集蚌埠医学院第一附属医院病理科2012年9月-2013年4月结直肠癌存档标本(石蜡包埋)100例,男60例,女40例;年龄27-78岁,中位年龄60岁;≤60岁46例,>60岁54例;结肠癌65例(包括右半结肠癌37例和左半结肠癌28例),直肠癌35例;肿瘤大小以5cm 作为分界值[2]:≤5cm 57例,>5cm 43例;组织学类型:腺癌75例(包括乳头状腺癌和管状腺癌),粘液癌25例(包括粘液腺癌和印戒细胞癌);浸润深度以浆膜层为界[3]:未及浆膜层21例,侵及浆膜层79例;组织分化程度:高分化腺癌16例,中分化腺癌58例,低分化腺癌26例;无淋巴结转移58例,有淋巴结转移42例;无远处转移80例,有远处转移20例;按全国结直肠癌病理研究规范分类Dukes分期[4]:A+B期45例,C+D期55例。在该组病例中,随机选取60例结直肠癌两端切缘组织为正常对照组。所有病例均满足以下标准:1)组织块按常规经10%中性福尔马林溶液固定、石蜡包埋,4μm连续切片数张;2)所有病例术前均未接受放疗或化疗,术后均经常规组织病理证实;3)外科治疗均为根治性切除,存在无瘤切缘。
2.主要试剂
鼠抗人MMP-7单克隆抗体(工作液,克隆号:ID2)及兔抗人Survivin单克隆抗体(工作液,克隆号:EP119),均购自北京中杉金桥生物技术有限公司;EliVisionTM plus KIT-9903(A、B)检测试剂盒、液体DAB(二氨基联本胺)、酶底物显色试剂盒均购自福州迈新生物技术开发公司。
3.免疫组化染色方法
免疫组化EliVision两步法按试剂盒说明书操作,经高压锅煮沸抗原修复,实验步骤如下:
(1)烤片:将切好的结直肠癌组织和正常黏膜组织的切片置于65℃烤箱2h,防止脱片;
(2)脱蜡透明:二甲苯瓶3瓶(先放入预热好的二甲苯试剂瓶中,再放入后面的2个二甲苯瓶中)、梯度酒精瓶4瓶(依次是95%→85%→75%→50%),一般在每个试剂瓶中浸泡5min,清水冲洗3遍,蒸馏水冲洗2遍;
(3)封闭:将脱蜡后的切片放入0.3%过氧化氢液(以阻断内源性过氧化物酶活性)10min,蒸馏水冲洗3遍,后0.01mol/L PBS冲洗3遍;
(4)抗原修复:放入盛有pH=6.0 1.0%柠檬酸盐修复液的高压锅里加热煮沸(切片要没入修复液中),待蒸煮冒气2min将切片取出,自然冷却,蒸馏水冲洗2遍,PBS缓冲液冲洗2遍,吸去切片上多余的PBS;
(5)加一抗:切片上滴加一抗,滴加的液体要均匀分布在组织表面,范围要大于组织边缘1-2mm且没有气泡产生,37℃孵育60min后,PBS冲洗3遍,吸去切片上多余的PBS;
(6)加增强剂:切片上滴加增强剂,37℃孵育30min;PBS冲洗3遍;
(7)加二抗:切片上滴加二抗,37 ℃ 孵育30min;PBS冲洗3遍;
(8)加DAB显色剂:切片上滴加新鲜配置的DAB溶液,显色3-5min,控制反应时间,然后自来水冲洗,终止显色;
(9)复染:将显色后的片子浸泡于苏木素中复染细胞核1min,然后放入1%的盐酸中分化一下,即可取出,自来水冲洗3遍后,放入温水中返蓝;
(10)脱水:依次将切片放入梯度酒精瓶(依次是50%→75%→85%→95%,4瓶)脱水干燥,再放入二甲苯(2瓶)透明,每瓶中放置2min;
(11)封片:中性树胶封片。
4.结果判断
4.1MMP-7染色结果判定
MMP-7阳性物质主要定位于细胞质,以肿瘤细胞质出现黄色或棕黄色颗粒为阳性反应。阳性结果判定按照Volm等[5]的判断标准综合计分:①选染色均匀的肿瘤区,在高倍视野(×400)下计数5个视野,每个视野随机计数100个细胞,计算阳性着色细胞占视野细胞总数的百分数,取平均值:<5%为0分;5%-25%为1分;26%-50%为2分;51%-75%为3分;>75%为4分;②按照肿瘤细胞着色强度计分:不着色为0分;淡黄色为1分;棕黄色为2分;深棕黄色或棕褐色为3分;按①、②计分值之和判断结果:0-1分为阴性(-);≥2分为阳性(+)。
4.2Survivin染色结果判定
Survivin阳性物质主要定位于细胞核,以肿瘤细胞核出现黄色或棕黄色颗粒为阳性反应。参照Caide等[6]的计数方法,在高倍镜(×400)下计数5个视野,每个视野随机计数100个细胞,阳性细胞率=阳性细胞数/总细胞数×100%,取平均值,采用半定量积分法判断阳性结果,即根据肿瘤细胞着色强度和阳性细胞率两方面记分值相乘的总分判断结果。以阳性细胞百分率计分:小于5%为0分;5%-25%为1分;26%-50%为2分;51%-75%为3分;大于75%为4分;再依照细胞着色强度计分:未着色为0分;浅黄色为1分;棕黄色为2分;棕褐色为3分;据染色强度与阳性细胞百分率相乘判断结果:0-1分为阴性(-);≥2分为阳性(+)。
为了减少人为因素造成的判断误差,以上均由2名高年资病理医师逐一观察同一切片,2人观察结果核对后作为最终评定结果。
5.统计学处理
采用SPSS19.0统计软件分析:MMP-7和Sruvivin蛋白在结直肠癌组织和正常黏膜组织之间、MMP-7和Sruvivin与结直肠癌患者临床病理特征之间的表达关系均采用χ2检验;MMP-7和Sruvivin蛋白之间的相关性采用Spearman秩相关检验;检验水准α=0.05。
结 果
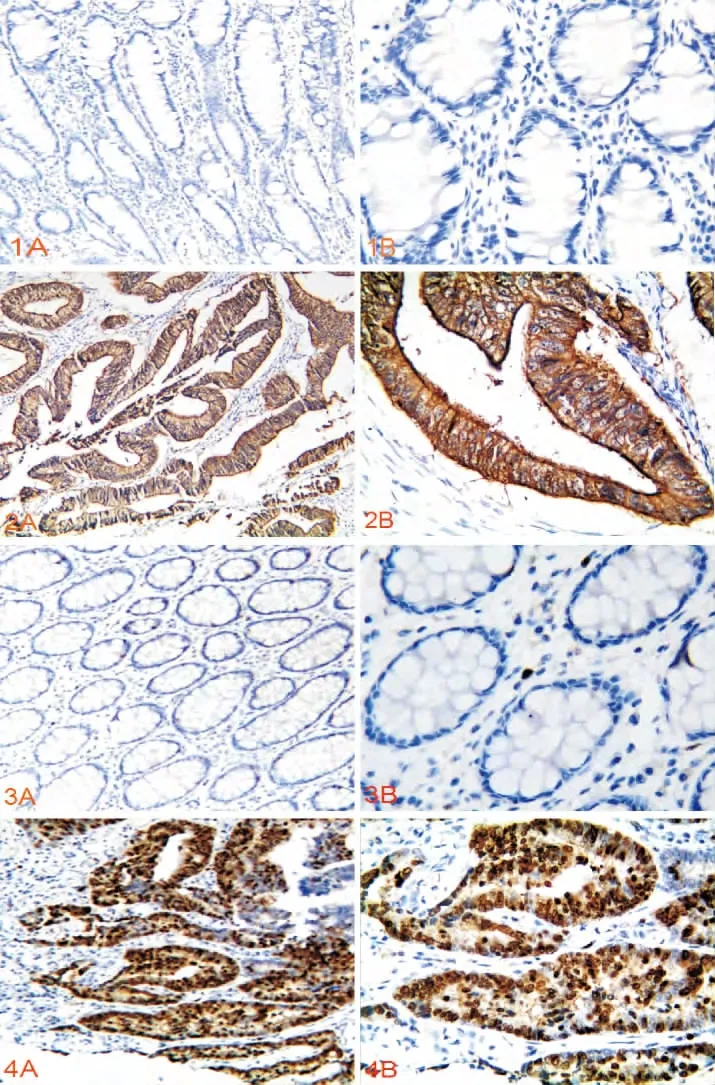
1.MMP-7和Survivin蛋白在结直肠癌及癌旁正常黏膜组织中的表达MMP-7蛋白主要定位于细胞质,在结直肠癌组织中为高表达,免疫组化染色呈黄色或棕黄色颗粒(图1A、1B)。MMP-7在结直肠癌组织和癌旁正常黏膜组织中阳性率分别为77.00%(77/100)和13.33%(8/60),两组间差异有统计学意义(P<0.01,表1)。
Survivin蛋白定位于细胞核,在结直肠癌组织中为高表达,免疫组化染色呈黄色或棕黄色颗粒(图2A、2B)。Survivin蛋白在结直肠癌组织和癌旁正常黏膜组织中阳性率分别为65.00%(65/100)和15.00%(9/60),两组间差异有统计学意义(P<0.01,表1)。

表1 MMP-7和Survivin蛋白在结直肠癌及癌旁正常黏膜组织中的表达Table 1 The expression of MMP-7and Survivin protein in colorectal cancer and normal mucosa
2.MMP-7和Survivin蛋白表达与结直肠癌临床病理特征的关系
MMP-7在结直肠癌中的表达与肿瘤浸润深度、淋巴结转移和Dukes分期相关(P<0.05,表2);Survivin在结直肠癌中的表达与淋巴结转移和Dukes分期相关(P<0.05,见表2)。
3.MMP-7与Survivin蛋白在结直肠癌中表达的关系
用Spearman秩相关分析后显示:MMP-7与Survivin蛋白表达无相关性(r=0.097,P>0.05,表3)。
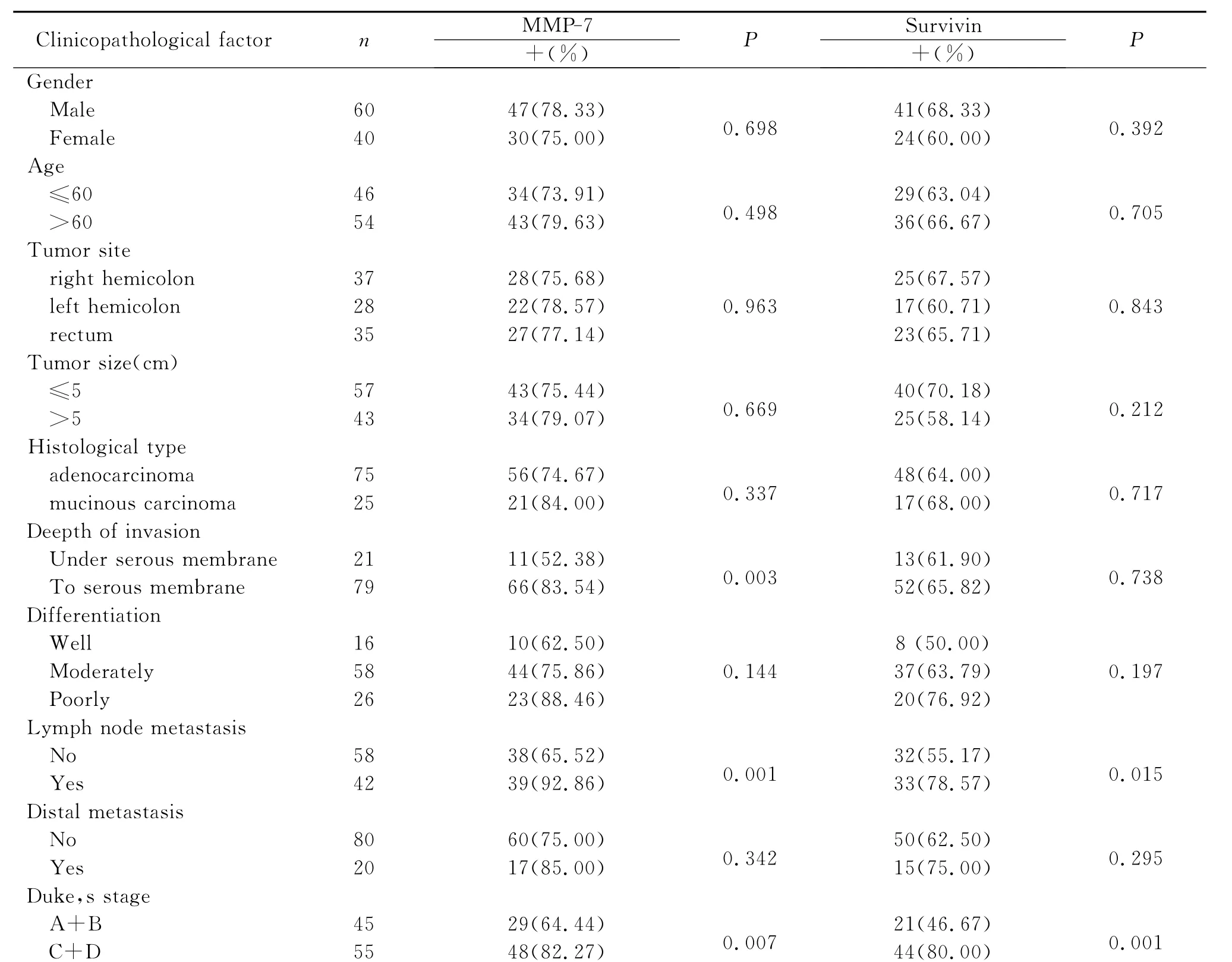
表2 MMP-7和Survivin蛋白表达与结直肠癌临床病理特征的关系Table 2 The relationship between MMP-7and Survivin protein expression and clinicopathological factors
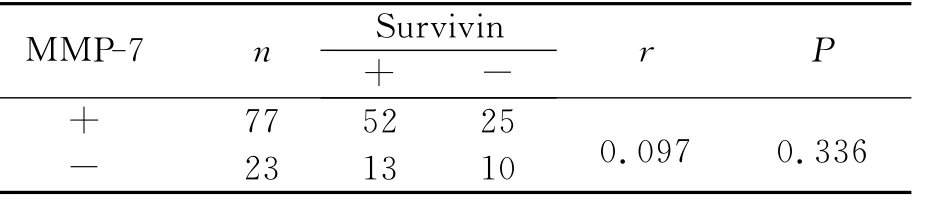
表3 结直肠癌中MMP-7与Survivin蛋白表达的关系Table 3 The relationship between MMP-7and Survivin protein expression in colorectal cancer
讨 论
结直肠癌的癌变机制涉及多条信号传导通路异常、原癌基因激活、抑癌基因失活、细胞凋亡机能受限、端粒酶活化等,它是一个多基因、多阶段、多步骤、渐进性演化累积的复杂过程。细胞信号转导通路是当今生物医学领域最前沿、最活跃的主题之一[7]。Wnt信号通路是由一系列癌基因和抑癌基因编码的蛋白质组成,各种信号蛋白之间彼此制约并且相互联系,形成一个复杂的网络结构。目前,大量研究表明,Wnt信号转导通路在胚胎发育与肿瘤发生、发展以及侵袭转移等关键过程中起着重要作用,备受广大研究者的关注[8]。多数结直肠癌患者的转化细胞在Wnt信号通路上存在抑癌基因的缺失、突变或失活和/或癌基因的激活,最终导致βcatenin在核内的累积,从而影响相关基因的转录,这是导致结直肠癌发生、发展的关键因素之一。当细胞受到刺激后,Wnt信号分子与细胞膜上相应的受体相结合,激活 Wnt信号通路,降解β-catenin复合体的功能受到破坏,最终β-catenin由于被降解的减少,从细胞质迁移到细胞核内,与核内的转录因子TCF相结合,进而启动下游一系列靶基因(如MMP-7、Survivin、cyclin-D1、c-myc、gastrin、ASEF和VEGF等)的转录,结果导致肿瘤的失控性生长。
Ajisaka等[9]运用免疫组化和 RT-PCR的方法研究了MMP-7在胃癌中的表达情况,结果显示其高表达与浸润深度、淋巴结转移及TNM分期呈显著性正相关,提示MMP-7表达增高与胃癌的进展有关。Lu等[10]研究 MMP-7在透明细胞肾癌中和苏赓等[11]研究了MMP-7在涎腺腺样囊性癌中的表达情况,结果显示MMP-7在这些癌组织中表达均高于相应的正常组织,均与淋巴结转移有关(P<0.05),提示MMP-7参与了恶性肿瘤的发生、发展、侵袭和转移。据最近Yoshida等[12]研究报道,在转移性脑肿瘤中,MMP-7可能也是其转移的重要危险因素之一。Pierre等[13]基于DNA芯片技术对多种转移性肿瘤细胞在基因水平所作的Meta分析证实,MMP-7是肿瘤转移的重要影响因素之一。了解MMP-7在肿瘤侵袭转移中的作用机制就显得十分重要。本实验研究结果显示:MMP-7蛋白在结直肠癌组织中的表达显著高于癌旁正常黏膜组织,其阳性率分别为77.00%(77/100)、13.33%(8/60),两组之间差异有统计学意义(P<0.01);MMP-7蛋白在结直肠癌组织中的表达与患者的浸润深度、淋巴结转移和Dukes分期有相关性(P<0.05),这与李志娟等[14]和李霞等[15]的研究结果一致,提示结直肠癌的进展与MMP-7有关。
恶性肿瘤的本质特征是侵袭和转移,肿瘤细胞通过降低细胞之间的粘附力,降解基底膜和细胞外基质,向周围或远处移动,这是肿瘤恶性转化的必经步骤。实验证明,肿瘤细胞侵袭转移的能力与其产生的蛋白酶、降解基底膜和细胞外基质的能力密切相关。MMP-7是蛋白酶家族中相对分子质量最小的一种特异性酶,主要降解Ⅳ型、Ⅶ型胶原、糖蛋白、纤维素和钙黏素等;有高度的上皮特异性表达与多种癌症的发病有密切的关系,特别在结直肠癌的发生、浸润和转移等各个环节中起着非常重要的作用。研究发现MMPs可促进肿瘤细胞分泌各类生长因子,这些因子具有促进肿瘤细胞有丝分裂的能力和血管生成的作用,结直肠癌组织中MMP-7的高表达与肿瘤的血管形成密切相关,有可能是结直肠癌转移和预后不良的重要标志之;MMP-7还可能诱导肿瘤细胞发生凋亡耐受,使其逃避免疫监视而抑制其凋亡,使肿瘤细胞长期存活,加速肿瘤的生长、侵袭和转移。因此,MMP-7可能通过多种作用机制导致多种恶性肿瘤的发生和转移,特别是与结直肠癌的发生发展及侵袭转移密切相关。
Survivin是目前发现的最强的凋亡抑制因子,是凋亡 蛋 白 抑 制 因 子 (inhibitor of apoptosis pro-tien,IAP)家族中倍受青睐的成员之一,它与细胞生长周期密切相关。Tamm等[16]对此基因进行了深入的研究,发现Survivin基因含有一个杆状病毒凋亡抑制蛋白重复序列(BIR)分子,BIR分子中含有对抑制凋亡有重要作用的氨基酸残基,Survivin通过这些残基与Caspase-3和Caspase-7结合抑制Caspases的活性;在羧基(COOH-)端有一个由40个氨基酸组成的α-螺旋结构,Survivin基因通过这个α-螺旋结构与细胞分裂微管(Microtube)结合,通过调节G2/M期,参与细胞周期有丝分裂的调控,最终抑制细胞凋亡。研究认为,Survivin是肿瘤组织中表达上调最为普遍的基因,在肿瘤发生过程中起重要作用。Lin等[17]用免疫组化的方法研究了Survivin蛋白在正常大肠黏膜、腺瘤及大肠癌中的表达情况,结果显示从正常大肠黏膜到腺瘤到最终癌变的发展过程中Survivin表达逐渐增加。陆娜娜等[18]采用免疫组化的方法对65例大肠癌组织和25例正常黏膜组织中的Survivin蛋白表达进行了检测,结果显示癌组织的表达显著高于正常黏膜组织,差异有统计学意义,与肿瘤淋巴结转移和Dukes分期有关。Zhang等[19]研究了Survivin在胃癌中高表达与患者临床病理特征的淋巴结转移相关。文献还报道了Survivin在肝癌、宫颈癌及甲状腺癌等[20-22]多种恶性肿瘤中高表达,并认为其与淋巴结转移和临床分期有相关性,可作为临床进展和预后判断的参考指标。本实验研究结果显示:Survivin蛋白在结直肠癌组织中的表达均显著高于癌旁正常黏膜组织,其阳性率分别为65.00%(65/100)、15.00%(9/60),差异有统计学意义(P<0.01);Survivin蛋白与患者的淋巴结转移和Dukes分期有关(P<0.05),与患者的性别、年龄、肿瘤部位、肿瘤大小、组织学类型、浸润深度、分化程度、远处转移无相关性(P>0.05),本实验研究结果与上述文献报道一致。根据一些体内、外试验研究[23]报道,在Survivin阳性表达的患者或细胞株中,对化疗或放疗产生抵抗现象时,封闭Survivin的表达或使用Survivin抑制剂则会增加肿瘤对放、化疗的敏感性。因此,从临床角度讲,Survivin阳性表达的肿瘤患者其治疗效果可能不佳,化疗耐药现象可能和一些凋亡抑制基因如生存素Survivin的大量存在有关。
本实验研究结果经Spearman秩相关分析后发现,在100例结直肠癌样本中,MMP-7与Survivin之间的表达无相关性(r=0.097,P>0.05)。但目前同时检测二者在结直肠癌中的表达及其相互关系的文献报道罕见。总之,本实验MMP-7与Survivin在结直肠癌中的表达都显著高于正常黏膜组织,均与淋巴结转移和Dukeks分期有关(P<0.05),这与文献报道是一致的。MMP-7和Survivin在结直肠癌中的高表达可能是结直肠癌发生的两个独立危险因素。Survivin在结直肠癌细胞增殖失调及凋亡异常中发挥了作用,MMP-7具有强大的对细胞间质降解作用,推测二者共同参与并促进了结直肠癌的发生发展,对于结直肠癌的恶性生物学行为和预后的判断可能有一定的价值。但MMP-7和Survivin之间在结直肠癌的发生发展过程中具体作用机制如何,是否具有相互协同作用的关系,尚需进一步探讨。相信随着先进技术和实验手段的提高,二者在结直肠癌中的作用机制及其相互关系将会有更为深刻的认识,为结直肠癌的筛查、早发现、早治疗以及临床进展和预后判断提供帮助。
图 版 说 明
图1A (Elivision×100)、1B(Elivision×400)MMP-7在结直肠正常黏膜组织中的阴性表达
图2A (Elivision×100)、2B(Elivision×400)MMP-7在结直肠癌组织中的阳性表达
图3A (Elivision×100)3B、(Elivision×400)Survivin在结直肠正常黏膜组织中的阴性表达
图4A (Elivision×100)、4B(Elivision×400)Survivin在结直肠癌组织中的阳性表达
EXPLANATION OF FIGURES
Fig.1A(Elivision×100)、1B(Elivision×400)Negative expression of MMP-7in normal colorectal mucosa
Fig.2A (Elivision ×100)、2B(Elivision ×400)Positive expression of MMP-7in colorectal cancer
Fig.3A (Elivision×100)、3B(Elivision×400)Negative expression of Survivin in normal colorectal mucosa
Fig.4A (Elivision ×100)、4B(Elivision ×400)Positive expression of Survivin in colorectal cancer
[1]顾娟,王学东,潘兆麟等.Wnt信号通路与肿瘤的研究进展.国际肿瘤学杂志,2012,39(11):827-829
[2]周珩,吴云飞.大肠癌组织 MMP-7表达与淋巴结和肝转移相关性的探讨.山东医药,2008,48(35):58-59
[3]顾国利,魏学明,王石林等.大肠癌 E-cadherin,βcatein,MMP-7表达及其临床意义.世界华人消化杂志,2007,15(4):375-380
[4]全国结直肠癌病理研究协作组.全国结直肠癌病理研究统一规范.中华肿瘤杂志,1986,8(2):156
[5]Volm M,Koomagi R,Mattern J.Prognostic value of vascular endothelial growth factor and its receptor Flt-1 in squamous cell lung cancer.Int J Cancer,1997,74(2):64-68
[6]Caide Lu,Dario CA,Nobuhiko T .Expression of a novel antiapoptosis gene,survivin,correlated with tumor cell apoptosis and P53accumulation in gastric carcinoma.Cancer Res,1998,58(9):1808-1812
[7]Heasley LE,Han SY.JNK regulation of oncogenesis.Mol Cells,2006,21(2):167-173
[8]Bryja V,Cajanek,Grahn A,et al.Inhibition of endocytosis blocks Wnt signaling to beta-catenin by promoting disheveled degradation.Acta Physiol(Oxf),2007,190(1):55-61
[9]Ajisaka H,Yonemura Y,Miwa K,et al.Correlation of lymph node metastases and expression of matrix metalloproteinase-7in patients with gastric cancer.Hepatogastroenterology,2004,51(57):900-905
[10]Lu H,Yang Z,Zhang H ,et al.The expression and clinical significance of matrix metalloproteinase 7and tissue inhibitor of matrix metalloproteinases 2in clear cell renal cell carcinoma.Exp Ther Med,2013,5(3):890-896
[11]苏赓,莫秋荣,温伟.涎腺腺样囊性癌中CyclinD1 MMP-7和PRB2/p130表达及意义.临床与实验病理学杂志,2013,29(1):36-39
[12]Yoshida S,Takahashi H.Expression of extracellular matrix molecules in brain metastasis.J Surg Oncol,2009,100(1):65-68
[13]Pierre M,Dehertogh B,Gaigneaux A ,et al.Meta-analysis of archived DNA microarrays identifies genes regulated by hypoxia and involved in a metastatic phenotype in cancer cells.BMC Cancer,2010,10(1):176
[14]李志娟,蒋卫国,王劲欧等.CD151和 MMP-7在结直肠癌中的表达及其临床意义.中国肿瘤临床,2012,39(7):392-395
[15]李霞,朱尤庆,罗峻等.血管生成素-2与基质金属蛋白酶-7在大肠癌中的表达及意义.世界华人消化杂志,2006,14(4):434-437
[16]Tamm I,Wang Y,Sausville E,et al.IAP-family protein Survivin inhibits caspase activity and apoptosis induced by Fas(CD95),Bax,caspases,and anticancer drugs.Cancer Res,1998,58(23):5315-5320
[17]Lin LJ,Zheng CQ,Jin Y,et al.Expression of survivin protein in human colorectal carcinogenesis.World J Gastroenterol,2003,9(5):974-977
[18]陆娜娜,尹玉,曹立宇等.大肠癌中Livin和Survivin的表达及相关性研究.中国组织化学与细胞化学杂志,2012,21(3):250-254
[19]Zhang J1,Zhu Z1,Sun Z,et al.Survivin gene expression increases gastric cancer cell lymphatic metastasis by upregulating vascular endothelial growth factor-C expression levels.Mol Med Rep,2014,9(2):600-606
[20]Liu JL,Zhang XJ,Zhang Z,et al.Meta-analysis:prognostic value of survivin in patients with hepatocellular carcinoma.PLoS One,2013,8(12):e83350
[21]Lu D,Qian J,Yin X,et al.Expression of PTEN and survivin in cervical cancer:promising biological markers for early diagnosis and prognostic evaluation.Br J Biomed Sci,2012,69(4):143-146
[22]Chen Z,Liu N,Zhu G,et al.Targeting of the anti-apoptotic gene survivin in human thyroid carcinoma.Int J Mol Med,2012,30(3):465-472
[23]Chakravarti A,Noll E,Black PM,et al.Quantitatively determined survivin expression levels are of prognostic value in human gliomas.J Clin Oncol,2002,20(4):1063-1068

