应用组织芯片技术检测果糖二磷酸醛缩酶在肝癌与胰腺癌组织中的表达
迟鑫明 胡 军 张丽媛 赵皓琦 郝立宏
(大连医科大学,1辽宁省高校蛋白质组学重点实验室,2组织胚胎学教研室,大连116044)
果糖二磷酸醛缩酶A(Fructose-bisphosphate aldolase A,aldolase A,ALDOA)是一种糖酵解酶,同时也是ATP合成所必需的酶。ALDOA存在于红细胞和骨骼肌中,与肌动蛋白丝结合从而促进肌动蛋白丝束的形成。ALDOA在糖酵解过程中,主要通过使C3、C4间的键断裂而导致己糖磷酸果糖-1,6-二磷酸分解形成3-磷酸甘油醛和磷酸二氢丙酮。以往对ALDOA的研究主要着重于其参与糖酵解过程和细胞形态维持以及与自身免疫性疾病发生相关方面。随着研究不断的深入,越来越多的研究结果显示糖代谢异常在肿瘤的发生过程中起到至关重要的作用,与糖代谢相关的糖酵解酶与肿瘤之间的关系也逐渐成为研究热点之一[1]。本研究采用免疫组织化学染色法检测ALDOA在肝癌及胰腺癌组织芯片中的表达,探讨其在癌组织中表达的意义,为后期进一步研究其在肿瘤中的作用及机制提供实验基础。
材料和方法
1.材料
1.1试剂
PV-9000两步法试剂盒、柠檬酸盐缓冲液、DAB显色试剂盒均购自北京中杉金桥生物技术有限公司;兔抗人ALDOA多克隆抗体购自武汉三鹰生物技术有限公司。
1.2组织芯片
组织芯片包含30例肝癌组织及6例对照(肝脏正常组织);30例胰腺癌组织及6例对照(胰腺正常组织)。其中肝癌患者男性26例,女性4例,年龄38-70岁,平均55岁。按照分化程度将病例分为三组,其中高分化组患者4例,中分化患者19例,低分化患者7例。胰腺癌患者男性18例,女性12例,年龄43-74岁,平均60岁。高分化患者6例,中分化患者21例,低分化患者3例,有淋巴结转移6例,无淋巴结转移患者20例。
2.免疫组织化学染色
将组织石蜡切片置于60℃烤箱中烤45min,常规脱蜡至水,然后用蒸馏水洗片。将切片置于湿盒中,室温下用3%H2O2孵育10min阻断内源性过氧化物酶,蒸馏水洗片。将切片置于0.01mol/L、pH6.0的柠檬酸钠抗原修复液中,置于微波炉中用高火加热5min,关火放置5min;中火加热5min,关火放置5min;再中火加热5min,关火放置5min。凉至室温后PBS洗片。血清封闭20min。加入Ⅰ抗(1∶100稀释),4℃过夜。次日37℃温育45min,PBS洗片。滴加PV9000-Ⅱ抗-1,湿盒中室温放置20min,PBS洗片。滴加PV9000-Ⅱ抗-2,同上。加入适量新鲜配置的DAB溶液,显微镜下观察显色。蒸馏水洗片。苏木素复染8min,蒸馏水洗片。盐酸乙醇10s,蒸馏水洗片,氨水返蓝15s,洗片。最后,常规脱水、透明、封片,显微镜下观察并摄片,SPSS统计数据。
3.结果判定
免疫组织化学结果判定标准如下:①细胞中的染色强度评分:0分(阴性)、1分(浅黄色颗粒)、2分(棕黄色颗粒)、3分(棕黑色颗粒)。②阳性细胞所占细胞数量的百分率计分:0分(阳性细胞百分率≤25%)、1分(26%≤阳性细胞百分率≤50%)、2分(51%≤阳性细胞百分率≤75%)、3分(76%≤阳性细胞百分率≤100%)。
每块组织蛋白表达强度的总评分=染色强度的分数+阳性细胞百分率的分数,0-2分即为阴性(-)、3-4分为阳性(+)、5-6分为强阳性(++)。阳性及强阳性的总和计算阳性率。
4.统计学分析
实验数据均采用SPSS 13.0统计学软件进行统计分析。两个样本之间的临床病理参数分析采用χ2检验,所有的统计检验均采用双侧检验,P<0.05被认为差异具有统计学意义,P<0.01被认为差异具有显著性统计学意义。
结 果
1.ALDOA在肝癌组织中的表达情况
ALDOA大部分定位在细胞质中,少量定位在细胞核中。ALDOA在肝癌中的阳性表达率为80%(24/30),在正常肝组织中的阳性表达率为33.3%(2/6)。经统计学分析,ALDOA在肝癌组织中的阳性表达显著高于正常肝组织,二者差异具有统计学意义(P<0.05)(图1-1,表1)。
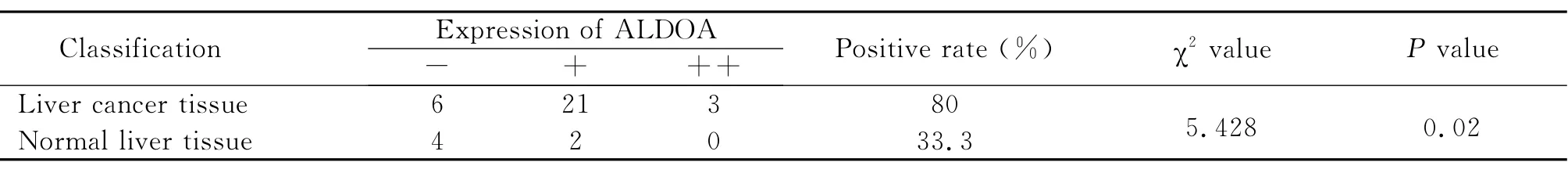
表1 ALDOA在肝癌组织和正常肝组织中的表达Table 1 The expression of ALDOA in liver cancer tissues and the normal control
2.ALDOA的表达与肝癌临床病理特征的关系
我们将30例肝癌患者临床病例资料中的各项指标与ALDOA的表达情况进行统计学分析,结果显示见表2,ALDOA的表达与性别、年龄、分化程度均无相关性(P>0.05)。
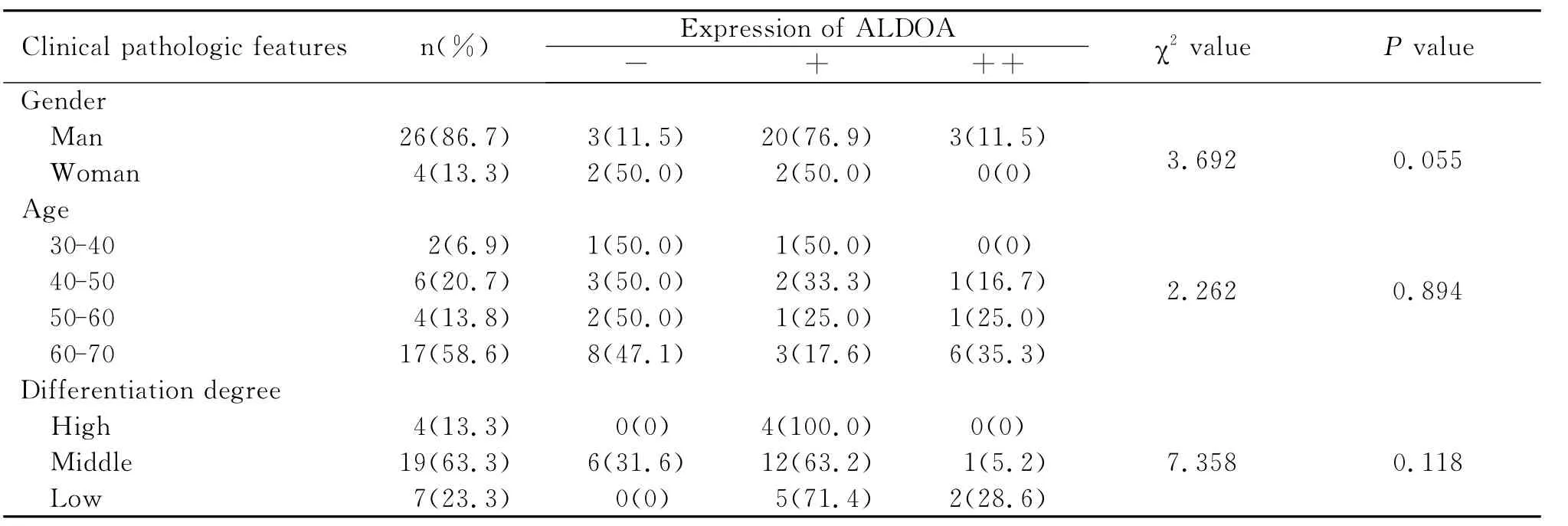
表2 肝癌组织中ALDOA的表达与临床病理特征的关系Table 2 The relationship between expression of ALDOA in liver cancer tissues and clinical pathologic features
3.ALDOA在胰腺癌组织中的表达情况
ALDOA在胰腺癌中的阳性表达率为为66.7%(20/30),在正常胰腺组织中的阳性表达率为0%(0/6),ALDOA在胰腺癌组织中的阳性表达显著高于正常胰腺组织,二者差异具有显著性统计学意义(P<0.01)(图2,表3)。
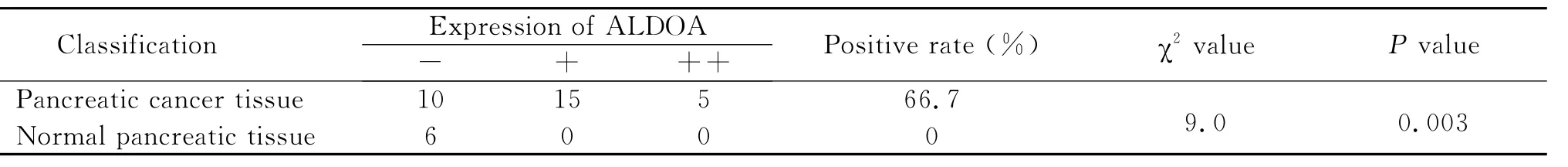
表3 ALDOA在胰腺癌组织和正常组织中的表达Table 3 The expression of ALDOA in pancreatic cancer tissues and the normal control
4.ALDOA的表达与胰腺癌临床病理特征的关系
我们将30例胰腺癌患者临床病例资料中的各项指标与ALDOA的表达情况进行统计学分析,结果显示ALDOA的表达与性别、年龄、淋巴结转移、分化程度均无相关性(P>0.05)(表4)。

表4 胰腺癌组织中ALDOA的表达与临床病理特征的关系Table 4 The relationship between expression of ALDOA in pancreatic cancer tissues and clinical pathologic features
讨 论
肝癌和胰腺癌同属于消化腺肿瘤,恶性程度很高。全世界每年有100万肝癌新发病例,而每年因肝癌死亡至少有50万人。肝癌发展迅速,若治疗不及时或治疗方案选择不当,平均生存时间为半年。胰腺癌诊断和治疗都很困难,5年生存率<5%,是预后最差的恶性肿瘤之一。因此,临床上早期明确诊断肝癌、胰腺癌是获治的关键[2,3]。
有研究表明,高表达ALDOA可加速糖酵解的进程,其在细胞中表达上调与增殖相关,ALDOA表达下调可引起糖酵解异常,使细胞内ATP减少,使细胞膜缺损,ALDOA异常表达还与许多种肿瘤的发生及发展等相关[4,5]。Du S等研究发现,ALDOA在肺鳞癌组织中高表达,并与肺鳞癌转移、分期、分化程度及预后差相关,是潜在的肺鳞癌转移相关标记物[6]。Chen X等经过综合蛋白质组学各方面的数据分析并验证,认为ALDOA在骨肉瘤中高表达与患者生存时间短密切相关,可做为临床预后判断的指标[7]。Long F等研究发现,ALDOA在骨肉瘤细胞中高表达后,可以增高MMP-2表达,因而促进细胞侵袭能力,并抵抗顺铂诱导的凋亡;裸鼠体内实验证明ALDOA高表达后,移植瘤体积增大,可促进肺转移,原发瘤中细胞凋亡减少[8]。Caspi M 等研究认为,ALDOA是新的 Wnt信号通路调控者,可以GSK-3β依赖的机制激活经典的 Wnt信号通路,而Wnt信号通路与肿瘤发生、发展密切相关[9]。
本实验我们应用组织芯片检测ALDOA在肝癌及胰腺癌组织及正常组织中的表达差异,结果显示:ALDOA主要定位于细胞质中。ALDOA在肝癌、胰腺癌组织中的阳性表达显著高于正常组织,差异具有统计学意义。该结果提示高表达的ALDOA可能与肝癌、胰腺癌的发生、发展有关,尚有待更深入的实验研究。但是,实验未检测到ALDOA与肝癌、胰腺癌患者的性别、年龄、分化程度有关,也未检测到与胰腺癌淋巴结转移有关。下一步,我们将扩大样本,并增加正常对照组织的样本量,进一步探讨ALDOA高表达与临床病理参数的关系,如能明确ALDOA在肝癌、胰腺癌等肿瘤发生及进展中的作用,将有助于认识肝癌及胰腺癌发生的分子机制,并可能成为临床检测的重要肿瘤标志物,起到预警作用,从而实现其临床价值。
图 版 说 明
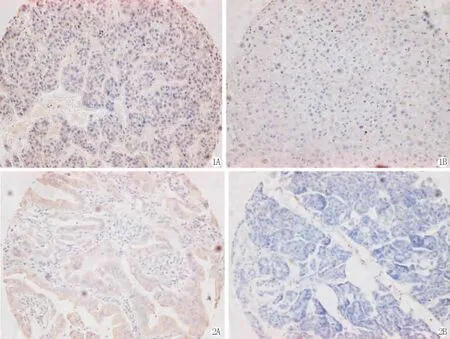
图1 ALDOA的表达 ×200 A:肝癌组织;B:正常肝组织
图2 ALDOA的表达 ×200 A:胰腺癌癌组织;B:正常胰腺组织
EXPLANATION OF FIGURES
Fig.1The expression of ALDOA ×200 A:liver cancer tissue;B:normal liver tissue
Fig.2The expression of ALDOA ×200 A:pancreatic cancer tissue;B:normal pancreatic tissue
[1]Kramerova I,Kudryashova E,Wu B,et al.Novel role of calpain-3in the triad-associated protein complex regulating calcium release in skeletal muscle.Hum Mol Genet,2008,17(21):3271-3280
[2]Costa PE,Vasconcelos JB,Coelho GR,et al.Ten-year experience with liver transplantation for hepatocellular carcinoma in a federal university hospital in the northeast of Brazil.Transplant Proc,2014,46(6):1794-1798
[3]Lee ES,Lee JM.Imaging diagnosis of pancreatic cancer:a state-of-the-art review.World J Gastroenterol,2014,20(24):7864-7877
[4]Hamaguchi T,Iizuka N,Tsunedomi R,et al.Glycolysis module activated by hypoxia-inducible factor l alpha is related to the aggressive phenotype of hepatocellular carcinoma.Int J Oncol,2008,33(4):725-731
[5]Rho JH,Roehrl MH,Wang JY.Glycoproteomic analysis of human lung adenocarcinomas using glycoarrays and tandem mass spectrometry:differential expression and glycosylation patterns of vimentin and fetuin A isoforms.Protein J,2009,28(3-4):148-160
[6]Du S,Guan Z,Hao L,et al.Fructose-bisphosphate aldolase a is a potential metastasis-associated marker of lung squamous cell carcinoma and promotes lung cell tumorigenesis and migration.PLoS One,2014,23,9(1):e85804
[7]Chen X,Yang TT,Zhou Y,et al.Proteomic profiling of osteosarcoma cells identifies ALDOA and SULT1A3 as negative survival markers of human osteosarcoma.Mol Carcinog,2014,53(2):138-144
[8]Long F,Cai X,Luo W,et al.Role of aldolase A in osteosarcoma progression and metastasis:In vitro and in vivo evidence.Oncol Rep,2014,3473
[9]Caspi M,Perry G,Skalka N,et al.Aldolase positively regulates of the canonical Wnt signaling pathway.Mol Cancer,2014,13:164

