鸡CSE多克隆抗体制备及硒缺乏对鸡肝脏内源性硫化氢生成酶的影响
林洪金,王从武
(东北农业大学动物医学学院,哈尔滨 150030)
鸡CSE多克隆抗体制备及硒缺乏对鸡肝脏内源性硫化氢生成酶的影响
林洪金,王从武
(东北农业大学动物医学学院,哈尔滨 150030)
硒与硫化氢生成酶均在动物生理活动中起重要作用。为探讨硒缺乏对鸡内源性硫化氢生成酶的影响,在建立鸡低硒模型后,分别于15、25、35、45、55、65 d采集肝组织,应用实时荧光定量PCR法检测H2S生成酶(CSE、CBS、3-MST)mRNA表达量。结果表明,低硒可诱导CSE、CBS和3-MST mRNA表达量升高,但无时间效应,揭示H2S生成酶在硒缺乏导致的损伤中有重要作用。制备CSE多克隆抗体,为今后CSE蛋白水平研究奠定基础。
硒;鸡;肝脏;硫化氢生成酶;多克隆抗体
硒是人和动物体内重要微量元素,肝脏是缺硒的靶器官之一,低硒会引起肝组织损伤[1]。王志兰等研究表明,硒缺乏大鼠表现出肝细胞坏死,这种坏死类似于大量饮用酒精后产生的结果,肝细胞内质网产生结构变化导致微粒体过氧化反应[2]。肝脏也是含硒量较多器官之一,硒可以发挥抗氧化能力预防肝纤维化[3]。H2S是继NO和CO之后发现的第三类信号分子,在体内主要通过胱硫醚β合酶(Cystathionineβ-synthase,CBS)、胱硫醚γ裂解酶(Cystathionineγ-lyase,CSE)、3-巯基丙酮酸硫转移酶(3-mercaptopyruvatesulfurtransferase, 3-MST)生成,H2S生成酶在机体系统中发挥生理作用[4]。当机体发生疾病时,内源性H2S生成酶的表达量发生改变。如张宁等在大鼠肝硬化中发现肝组织中CSE mRNA表达量低于正常对照组[5]。Kim等发现,在乙醇喂养大鼠1周后引起肝脏纤维化以及肝脂肪变性,此时CBS mRNA表达量有所下降[6]。本试验通过建立鸡缺硒模型,检测硒缺乏对CSE、CBS、3-MST mRNA的影响,制备鸡CSE多克隆抗体,为后续研究提供依据。
1 材料与方法
1.1 试验鸡的饲养
选择健康1日龄雏鸡120只,随机分为对照组和低硒组,每组60只,雌雄各半,对照组饲喂全价饲料,饲料中硒含量为0.15 mg·mL-1;低硒组饲喂缺硒日粮,饲料硒含量为0.033 mg·mL-1。均常规饲养,自由采食和饮水。饲喂期为65 d,分别在15、25、35、45、55、65 d时,将雏鸡静脉放血处死后采集肝脏组织,迅速放于液氮中进行预冷,于-80℃保存备用。
1.2 主要试剂
核酸内切酶BamHⅠ和XhoⅠ、T4DNA连接酶等购自大连宝生物公司;胶回收纯化试剂盒、反转录试剂盒、DNA质粒提取试剂盒、荧光定量PCR染料等购自北京全式金生物技术有限公司;Trizol购自Invitrogen中国(英潍捷基)公司;β-actin抗体、羊抗兔和羊抗鼠酶标二抗(辣根过氧化物酶)购自北京中杉金桥生物技术有限公司;弗氏完全佐剂(FCA)和弗氏不完全佐剂(FIA)均购自西格玛奥德里奇(中国)公司;Troziol购自大连宝生物公司;M-MLV反转录酶、RNA酶抑制剂、dNTP等常规试剂购自北京全式金生物技术有限公司。
1.3 肝组织中CSE、CBS、3-MST基因mRNA表达的检测
1.3.1 肝组织总RNA提取
按照Trizol法提取肺组织总mRNA。取100 mg肺组织加1 mL Trizol于冰浴下进行匀浆,后经氯仿处理,异丙醇沉淀,75%乙醇洗涤后,略干燥,溶于DEPC处理水。经核酸紫外分析仪检测,根据OD260/OD280值,确定样品中RNA纯度和含量。
1.3.2 肝组织总mRNA反转录
在总mRNA中,分别加入Oligo dT 4 μL、5× Buffer 16 μL、dNTP 4 μL、RNase Inhibitor 2 μL、M-MLV 4 μL以及由DEPC处理的灭菌水50 μL,混匀,共80 μL,42℃水浴60 min,85℃水浴5 min灭活反转录酶,-20℃保存备用。
1.3.3 荧光定量PCR扩增
根据已知基因序列应用Primer Premier 5.0软件设计引物,验证引物特异性。
采用SYBR GreenⅠ荧光染料法进行实时扩增。20 μL反应体系如下:
SYBR Premix ExTaq10 μL,Rox Reference DyeⅡ0.4 μL,上游引物(10 pmol·μL-1)0.4 μL,下游引物(10 pmol·μL-1)0.4 μL,cDNA模板2.0 μL,灭菌双蒸水6.8 μL。反应在ABI 7500 Real Time PCR System上进行。反应条件为:95℃预变性30 s,95℃5 s,60℃34 s,40个循环,最后为融解反应。
计算方法采用2-ΔΔCt方法。

1.4 CSE多克隆抗体的制备
1.4.1 鸡CSE基因序列的克隆与鉴定
1.4.1.1 鸡CSE基因的扩增与鉴定
根据GenBank中已经公布的鸡CSE cds区基因序列(XM_422542.3)设计特异性克隆表达引物:
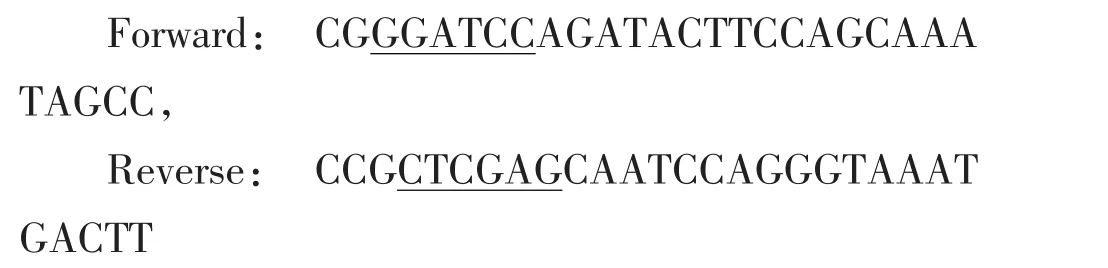
应用PCR技术扩增目的条带,反应体系(25 μL)如下:2×PCR SuperMix 12.5 μL,上下游特异性引物各1 μL,反转录模板1 μL,灭菌水9.5 μL,混匀后进行PCR反应。反应条件为:94℃预变性5 min,94℃变性30 s,52℃退火30 s,72℃延伸1 min,34个循环,72℃延伸10 min,4℃终止反应。反应结束后取5 μL PCR产物,在0.8%琼脂糖凝胶中电泳20 min。电泳后在紫外凝胶成像仪观察条带。
1.4.1.2 鸡CSE重组表达载体的构建与鉴定
电泳后大小与预测大小一致的PCR产物,用胶回收试剂盒纯化和回收PCR产物。将获得的PCR产物与pMD18-T载体相连,加入的试剂如下:4 μL胶回收产物,solution I 5 μL,pMD18-T载体4 μL,16℃连接过夜。取10 μL加到100 μL感受态细胞中,冰浴30 min,混匀。42℃水浴45 s后再冰浴1 min。加入500 μL无氨苄青霉素(Amp)的LB培养基中,37℃振荡培养1 h,取出后3 000 r·min-1离心1 min,留200 μL液体,混匀后涂于含100 μg·mL-1氨苄的LB平板上,37℃培养12 h,挑取白色单个菌落,于5 mL含Amp的液体LB培养基中,37℃摇床振荡过夜。利用质粒小提试剂盒,按照说明书操作提取质粒,进行质粒PCR反应,核酸电泳比对片段大小。为进一步核对目的基因是否连接到克隆载体,对阳性克隆的质粒经BamHⅠ和XhoⅠ双酶切鉴定,进行核酸电泳分析,观察与预期大小的基因片段是否一致。经质粒PCR及酶切鉴定正确后,将疑似阳性克隆的质粒送序列测定公司进行测序。应用序列比对软件将测序结果与已知序列进行比对分析。
1.4.2 鸡CSE基因在大肠杆菌中的表达、纯化和鉴定
取pET-32a-CSE质粒转化到DH5α感受态细胞,涂布LB(含Amp 60 μg·mL-1)平板,37℃培养箱培养过夜。挑取菌体并接种于10 mL LB(含Amp 60 μg·mL-1)中培养过夜。1∶10比例稀释过夜菌,37℃振荡培养至OD600在0.4~1.0(最好为0.6,大约需4 h)。取部分培养液作为未诱导的对照组,余下的加入IPTG诱导剂到终浓度为1 mmol·L-1作为试验组。每隔1 h在试验组中取出1 mL培养液,检测OD值并加入上样缓冲液煮沸15 min,进行聚丙烯酰胺凝胶电泳(SDS-PAGE)分析。然后诱导100 mL菌液并收集菌体,经过破碎后离心分离上清和沉淀。分别加入上样缓冲液进行蛋白鉴定。然后用预冷的18.625 g·L-1KCl进行染色,当出现宽变色条带时,切下白色条带并碾碎,加入PBS约400 μL,反复冻融3次后离心取上清,蛋白电泳检测融合蛋白纯度。
1.4.3 抗鸡CSE多克隆抗体制备
将纯化单一条带的原核表达蛋白用PBS稀释到1 mg·mL-1,与弗氏完全佐剂(首次免疫)或者弗氏完全佐剂(除首次免疫)进行1∶1混合,形成稳定乳剂,即可用于动物接种。
免疫前从兔耳缘静脉采血,作为阴性对照。免疫结束后收集血清,纯化的CSE原核表达蛋白经SDS-PAGE电泳后,应用湿转电转移方法,将蛋白转印至NC膜上,依次经过5%脱脂乳孵育2 h、制备的血清孵育2 h、羊抗兔酶标二抗(1∶2 000)孵育1 h。然后在膜上加入约400 μL DAB显色液,避光孵育5 min,观察膜上条带并扫描。
2 结果与分析
2.1 临床症状和肝脏剖检变化
与正常组相比,低硒组可见鸡精神沉郁,体重较正常组低,有渗出性素质,剖检肝脏时发现轻度萎缩,质地脆弱,有的肝脏由深红色变成灰黄色,局灶性坏死。
2.2 肝脏中CSE、CBS、3-MST mRNA表达水平
图1~3分别显示对照组和低硒组鸡肝脏组中CSE、CBS、3-MST基因mRNA表达的对比,从图中可以发现,从15 d开始到65 d,各低硒组中CSE、CBS、3-MST基因mRNA表达量均高于对照组,且差异性显著(P<0.05)。CSE mRNA水平在15 d时增长幅度最小,为82%;在65 d时增长幅度最大,为228%。CBS mRNA水平在45 d时增长幅度最小,为96%;在65 d时增长幅度最大,为222%。3-MST mRNA水平在15 d时增长幅度最小,为88%;在65 d增长幅度最大,为232%。鸡肝脏CSE蛋白表达水平结果与mRNA水平相似,从15~65 d时所有低硒组CSE蛋白表达量均大于对照组。

图1 硒缺乏对鸡肝脏CSE mRNA表达量的影响Fig.1 Effects of Se-deficiency on CSE mRNA level in chicken liver
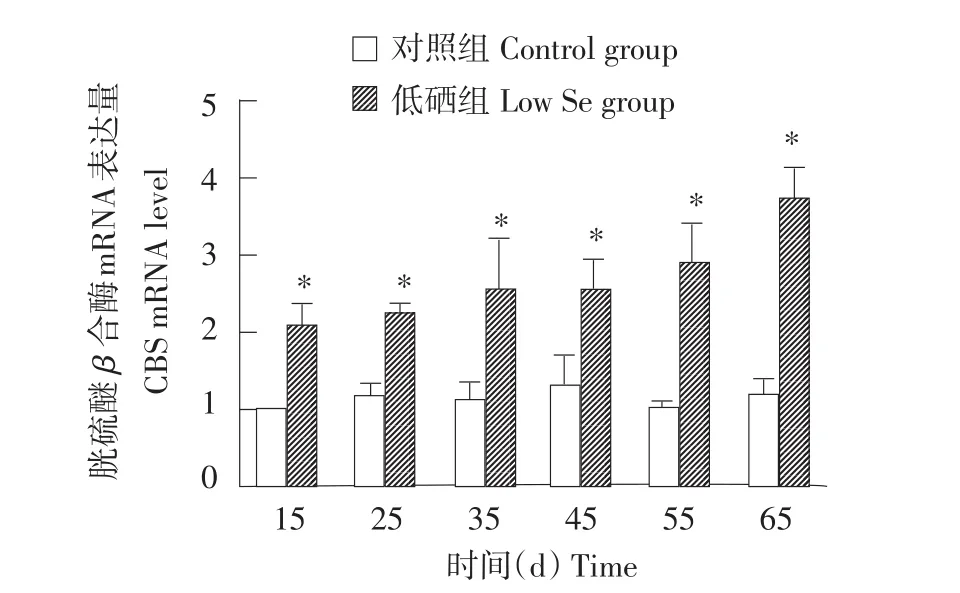
图2 硒缺乏对鸡肝脏CBS mRNA表达量的影响Fig.2 Effects of Se-deficiency on CBS mRNA level in chicken liver
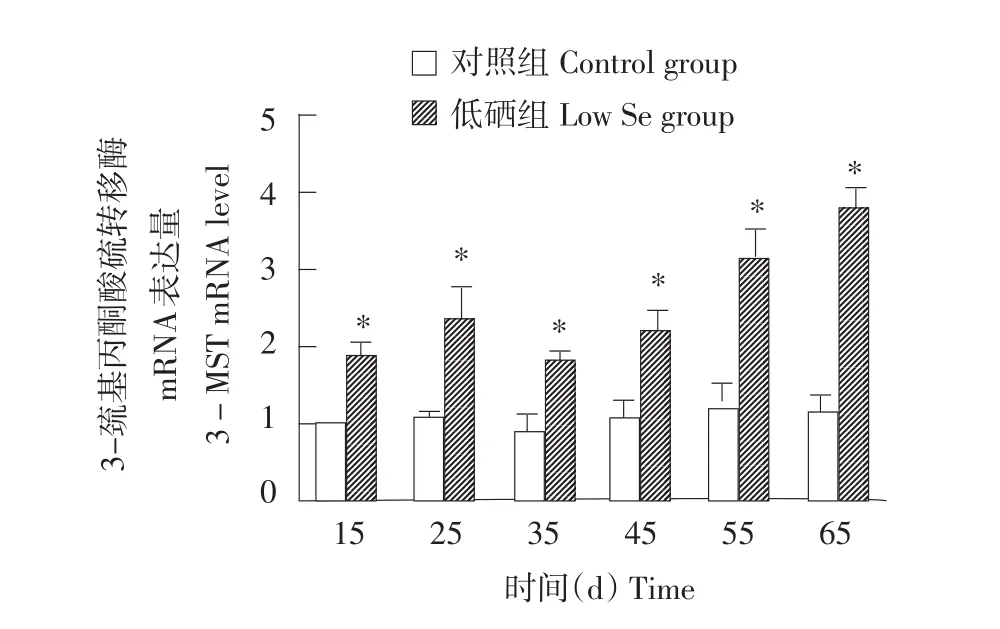
图3 硒缺乏对鸡肝脏3-MST mRNA表达量的影响Fig.3 Effects of Se-deficiency on 3-MST mRNA level in chicken liver
2.3 鸡CSE多克隆抗体制备
2.3.1 鸡CSE基因的PCR扩增结果
对鸡CSE基因应用DNAstar软件分析亲水区和抗原区等并设计克隆表达引物,以鸡肝脏组织cDNA为模板,扩增目的基因CSE,PCR产物经1%琼脂糖凝胶电泳分析(见图4),在约528 bp处有特异性带,与预期产物大小相符。

图4 应用克隆表达引物扩增鸡CSE基因Fig.4 Amplification of CSE gene by using clone and expression primers
2.3.2 鸡CSEmRNA基因序列测序结果
胶回收纯化的目的片段与克隆载体连接后,转化到大肠杆菌感受态细胞中。质粒经PCR和双酶切进行鉴定。被鉴定为阳性克隆的进行测序分析,测序结果通过分子生物学软件与CSE mRNA基因序列进行比对,核苷酸同源性比对为99.8%,氨基酸同源性比对为100%,证明成功克隆鸡CSE基因。
2.3.3 重组表达载体构建与鉴定
构建克隆载体和空表达载体双酶切及胶回收试剂盒纯化后,用T4DNA连接酶连接,转化后挑取单个菌落培养,提取质粒,经PCR和双酶切鉴定。琼脂糖凝胶电泳显示,PCR扩增产物及酶切插入片段长528 bp,符合预测分子质量。重组质粒酶切及测序鉴定表明成功构建CSE基因表达载体(见图5)。
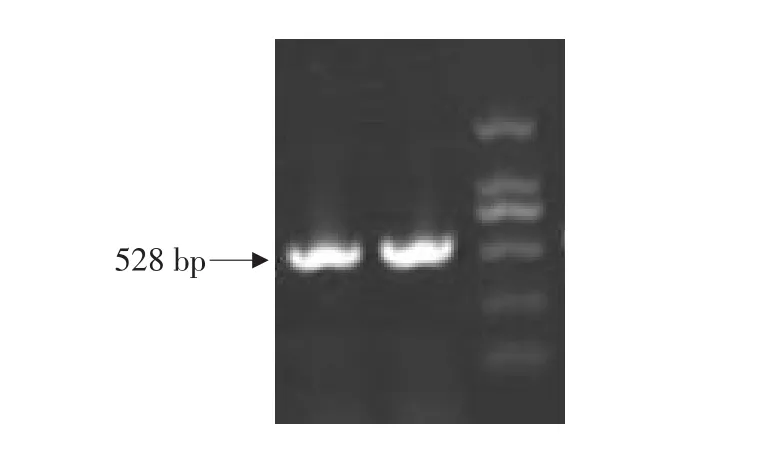
图5 CSE重组原核表达质粒PCR扩增产物电泳图谱Fig.5 Electrophoresis of the PCR product from the recombinant plasmid of CSE
2.3.4 融合蛋白表达、鉴定与纯化
2.3.4.1 基因表达产物SDS-PAGE分析
鸡CSE的阳性重组质粒转化E.coliRosetta后,经1 mmol·L-1IPTG在37℃诱导,蛋白表达量随着时间逐渐增加,最佳诱导时间为4 h,表达产物大小与预期一致,CSE约为41 ku,见图6。
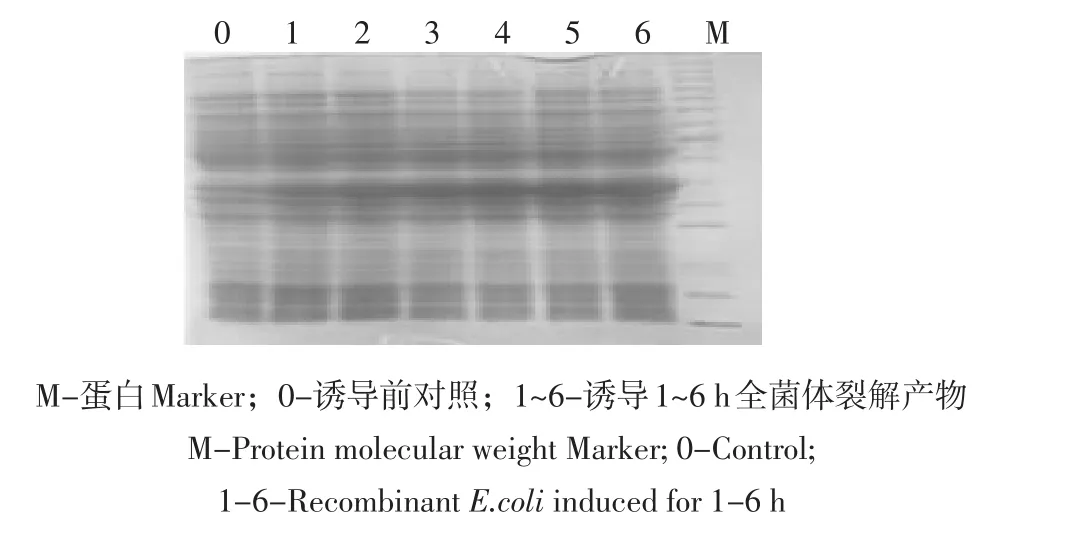
图6 重组原核表达质粒pET32a-CSE,1.0 mmol·L-1IPTG不同诱导时间SDS-PAGE分析结果Fig.6 SDS-PAGE analysis of the pET32a-CSE with 1.0 mmol·L-1IPTG
2.3.4.2 融合蛋白纯化
将纯化的CSE的原核表达蛋白取10 μL进行蛋白电泳,得到单一蛋白条带,大小与预期大小相符,经测定纯化蛋白浓度,可达2.4 mg·mL-1(见图7)。
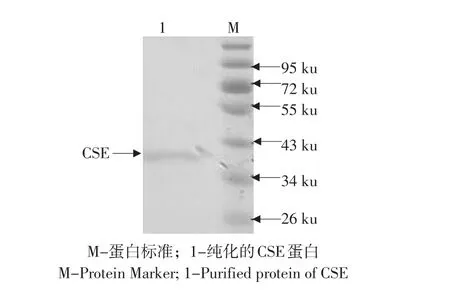
图7 融合蛋白纯化Fig.7 Purification of fusion protein
2.3.5 多克隆抗体制备和鉴定结果
2.3.5.1 ELISA法测定多克隆抗体效价结果
ELISA检测结果显示CSE原核表达蛋白能被制备的兔多克隆抗体血清识别,其中免疫目的蛋白的兔多克隆抗体血清效价为1∶25 600。
2.3.5.2 Western Blot的检测结果
鸡CSE基因原核表达蛋白经蛋白凝胶电泳后,转印至NC膜上,制备的兔多克隆抗体血清稀释倍数为1∶1 000,加入酶标二抗后,DAB显色,NC膜上在41 ku的位置出现单一条带,证明成功制备鸡CSE基因兔多克隆抗体,是目的蛋白诱导产生特异性抗体。
3 讨论与结论
多克隆抗体应用广泛,相对于单克隆抗体而言,多克隆抗体具有制备技术简单、试验周期短价格低等优点。首先用引物设计软件尽量在抗原性强及亲水性强的基因序列区域设计特异性引物。PCR扩增,连接到克隆载体后进行测序。试验得到鸡CSE基因序列与NCBI公布的鸡CSE基因序列核苷酸同源性为99.8%,氨基酸同源性为100%。表达载体选用pET-32a,因为pET-32a表达载体在大肠杆菌中可高效稳定表达外源性蛋白质[7]。本试验表达菌株选用BL21(DE3),BL21属于蛋白酶缺陷型菌株,蛋白酶在菌株内含量过多使外源表达产物稳定性较差,所以选用这种蛋白酶缺陷型的菌株使得表达产物更加稳定。
本试验选择的免疫动物是新西兰白兔,免疫效果较好,每2周免疫1次,共免疫4次。免疫结束后,经Western Blot分析,本试验制备的CSE多克隆抗体能与其融合蛋白结合,条带与预期大小一致且条带单一,说明本试验利用原核表达系统成功制备特异性强的兔抗鸡CSE抗体,为进一步研究鸡CSE在日粮低硒中变化奠定基础。
CSE、CBS、3-MST是动物机体内促进内源性H2S生成酶,在多数组织中存在,在肝脏表达量较高。但CSE和CBS具有组织特异性,有些组织中只存在其中一种。比如在大鼠平滑肌、主动脉、肺动脉、肠系膜动脉中只发现CSE表达,无CBS表达;在小脑中一般只有CBS表达,无CSE表达。CSE、CBS、3-MST在内源性H2S的生成途径中有不同作用。
在多数情况下促进H2S生成酶类是共同作用结果。比如在慢性肾脏疾病中,导致CSE、CBS、3-MST表达同时降低[8]。在肝脏缺血再灌注和功能紊乱引起损伤中,机体通过对CSE、CBS、3-MST的调控直接影响内源性H2S的生成继而发挥对肝脏保护作用[9]。其对肝脏的氧化应激有一定作用。Robert等发现,在CBS基因敲除的大鼠肝脏中,大量氧化应激基因表达上升[10]。CBS基因的敲除可提升肝脏中蛋白质氧化和脂质过氧化30%,由于肝星状细胞激活,使肝损伤增加50倍[11-12]。在CSE基因敲除后,出现类似CBS基因敲除现象,机体产生氧化损伤,抗氧化能力下降[13]。在大鼠肾小管间质纤维化,CBS和CSE的mRNA及蛋白水平均降低,用NaHS处理后又可同时上调肾组织CBS和CSE的mRNA和蛋白表达量[14]。CSE、CBS、3-MST在肝脏中均可促进H2S生成,所以当肝脏受到损伤时,其表达水平可能会被同时升高或降低。这与本次试验结果一致。
综上所述,日粮低硒可导致鸡肝脏中CSE、CBS、3-MST mRNA表达量显著升高,这可能是由于机体自发调控来保护肝脏引起,其作用机制有待进一步研究。
[1]杜立芹,程五凤,史奎雄,等.硒对小鼠免疫功能的影响[J].上海第二医科大学学报,2000,20(1):29-31.
[2]王志兰.实验性缺硒病仔猪肝脏功能试验[J].东北农学院学报,1986(4):11-12.
[3]陈国栋.神奇的护肝因子硒[J].医药世界,2004(10):34-35.
[4]Du J,Hui Y,Cheung Y,et al.The possible role of hydrogen sul⁃fide as a smooth muscle cell proliferation inhibitor in rat cultured cells[J].Heart Vessels,2004,19:75-80.
[5]张宁,郑勇,李睿,等.不同时期肝硬化大鼠门静脉血与下腔静脉血中内源性硫化氢的比较[J].石河子大学学报,2009(1): 32-33.
[6]Kim S K,Seo J M,Jung Y S,et al.Alterations in hepatic metabo⁃lism of sulfur-containing amino acids induced by ethanol in rats [J].Amino Acids,2003,24(1-2):103-110.
[7]吴一凡,张双全.乳糖诱导pET载体表达重组蛋白的研究[J].南京师大学报,2002,25(1):89-93.
[8]Aminzadeh M A,Vaziri N D.Downregulation of the renal and he⁃patic hydrogen sulfide(H2S)-producing enzymes and capacity in chronic kidney disease[J].Nephrology Dialysis Transplantation, 2012,27(2):498-504.
[9]Jha S,Calvert J W,Duranski M R,et al.Hydrogen sulfide attenu⁃ ates hepatic ischemia-reperfusion injury:Role of antioxidant and antiapoptotic signaling[J].American Journal of Physiology-Heart and Circulatory Physiology,2008,295(2):801.
[10]Robert K,Chassé J F,Santiard-Baron D,et al.Altered gene ex⁃pression in liver from a murine model of hyperhomocysteinemia [J].Journal of Biological Chemistry,2003,278(3-4):31504-31511.
[11]Robert K,Nehmé J,Bourdon E,et al.Cystathionine β synthase deficiency promotes oxidative stress,fibrosis,and steatosis in mice liver[J].Gastroenterology,2005,128(5):1405-1415.
[12]Dong X B,Yang C T,Zheng D D,et al.Inhibition of ROS-activat⁃ed ERK1/2 pathway contributes to the protection of H2S against chemical hypoxia-induced injury in H9c2 cells[J].Molecular and cellular biochemistry,2012,362(1-2):149-157.
[13]Mani S,Li H,Untereiner A,et al.Decreased endogenous produc⁃tion of hydrogen sulfide accelerates atherosclerosis[J].Circula⁃tion,2013,127(25):2523-2534.
[14]赵德安,刘君,黄倩,等.硫化氢在单侧输尿管梗阻大鼠肾小管间质纤维化中的水平变化及其干预影响[J].中国当代儿科杂志,2013,15(10):903-908.
Preparation of polyclonal antibody of chick CSE and the effect of sele⁃nium deficiency on endogenous hydrogen producing enzymes in chicks
LIN Hongjin,WANG Congwu(School of Veterinary Medicine,Northeast Agricultural University,Harbin 150030,China)
Both selenium and sulfide-producing enzyme play important roles in the physiological activity of the animals.The aim of this investigate revealed the effect of generate hydrogen sulfide enzyme induced by the chicken model of selenium deficiency.Liver tissue were collected on 15,25,45,55,65 d. Real-time PCR was used to detect the expression of mRNA H2S producing enzyme(CSE,CBS,3-MST). The results showed that the expression level of selenium could induce the mRNA in CSE,CBS and 3-MST, but there was no effect of time,suggesting that H2S generation enzymes played an important role in the injury in selenium deficiency.At the same time,the preparation of CSE polyclonal antibody was prepared, providing a reference research on the level of CSE protein in the future.
selenium;chick;liver;hydrogen sulfide-producing enzymes;polyclonal antibody
S831
A
1005-9369(2014)09-0095-05
2014-04-02
国家自然科学基金(31272626)
林洪金(1970-),男,副教授,博士,研究方向为临床兽医学。E-mail:linhongjin_2000@163.com
时间2014-9-18 10:49:23[URL]http://www.cnki.net/kcms/detail/23.1391.S.20140918.1049.014.html
林洪金,王从武.鸡CSE多克隆抗体制备及硒缺乏对鸡肝脏内源性硫化氢生成酶的影响[J].东北农业大学学报,2014,45(9): 95-99.
Lin Hongjin,Wang Congwu.Preparation of polyclonal antibody of chick CSE and the effect of selenium deficiency on endogenous hydrogen producing enzymes in chicks[J].Journal of Northeast Agricultural University,2014,45(9):95-99.(in Chinese with English abstract)

