异黏蛋白在宫颈癌中的表达及意义
王明娟,齐洁敏,王 闯,毕红东
(承德医学院,河北承德 067000)
宫颈癌是女性常见的恶性肿瘤之一,浸润、转移不仅是宫颈癌的主要生物学行为,也是影响患者预后的主要因素,因此,如何控制宫颈癌的浸润、转移成为了当今宫颈癌研究的重点和热点。宫颈癌的浸润、转移是宿主细胞和肿瘤细胞之间相互作用的多步骤过程,作为能够调控该过程的相关基因—MTDH基因在宫颈癌的浸润、转移中具有重要作用。MTDH基因已经被证实为原癌基因,但在宫颈癌中的表达及意义尚未见报道。本研究采用免疫组化法检测了MTDH蛋白在宫颈癌组织中的表达情况,探讨其在宫颈癌的发生、发展中的作用。
1 资料与方法
1.1 一般资料 2010年10月至2013年9月承德市多家医院手术切除并经病理诊断确诊为宫颈癌的组织50例(鳞癌30例、腺癌20例),年龄30-65岁,其中高分化13例、中分化22例,低分化15例。宫颈正常组织30例,为子宫平滑肌瘤等良性病变行全子宫切除的宫颈正常组织,年龄28-65岁。所有病例术前均未行放疗、化疗,临床及病理资料完整。所取标本经甲醛固定后常规石蜡包埋,5 μ m厚连续切片。
1.2 试剂与方法
1.2.1 主要试剂:兔抗MTDH多克隆抗体,北京博奥森生物技术有限公司;免疫组化试剂盒,北京四正柏生物科技有限公司。
1.2.2 免疫组化染色:免疫组化染色采用SP法,抗体浓度1:80,用PBS代替一抗作阴性对照。MTDH阳性产物为棕黄色颗粒,主要定位于细胞浆。MTDH蛋白的表达水平采用染色强度和阳性细胞数评分综合判定[1]。染色强度评分标准:0分,阴性,与背景色完全一致;1分,弱阳性染色,呈淡黄色,略深于背景色;2分,阳性染色,呈中等黄色,明显深于背景色;3分,强阳性染色,呈棕黄色或棕褐色。阳性细胞数评分标准:0分,阳性细胞数<10%;1分,阳性细胞数11%-25%;2分,阳性细胞数36%-50%;3分,阳性细胞数≥50%。以染色强度评分+阳性细胞数评分判定结果,0分为阴性表达(-),1-2分为低表达(+),3-4分为中度表达(++),5-6分为高表达(+++)。
1.3 统计分析 采用SPSS 17.0统计软件进行分析,计数资料的比较采用卡方检验,P<0.05为差异有统计学意义。
2 结果
2.1 MTDH蛋白的表达情况 MTDH蛋白阳性产物定位于细胞浆,呈棕黄色颗粒。宫颈癌组织MTDH的阳性表达率为78.0%,明显高于宫颈正常组织,差异具有统计学意义(P<0.05)。见表1:

表1 宫颈癌组织和宫颈正常组织MTDH蛋白的表达情况
2.2 MTDH蛋白的表达与宫颈癌临床病理参数的关系MTDH蛋白表达与宫颈癌的分化程度、浸润深度、淋巴结转移、临床分期有关(P<0.05);与年龄、病理类型无关(P>0.05)。见表2:
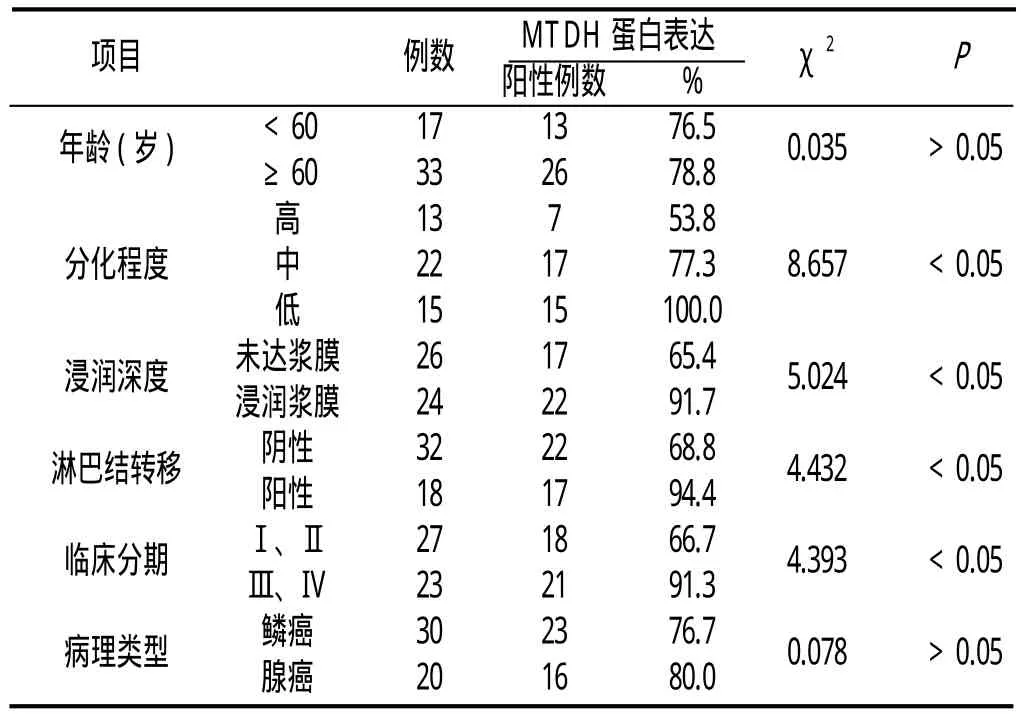
表2 MTDH蛋白表达与宫颈癌临床病理参数的关系
3 讨论
恶性肿瘤的发生、发展是一个多步骤、多因素参与的复杂过程,该过程主要包括细胞黏附、基质降解和肿瘤细胞转移3个步骤。在此过程中MTDH具有重要作用。
MTDH的编码基因是在感染了人免疫缺陷病毒(HIV-1)的人原始胚胎星形细胞(PHFA)中被首次克隆出来的,已经被证实是一种原癌基因,其功能主要是调节与肿瘤发生发展密切相关的分子信号途径[2-3]。Song等[4]采用蛋白印迹法对子宫内膜组织的研究中发现,正常子宫内膜组织、不典型增生组织、子宫内膜癌组织MTDH的阳性表达率逐渐升高,且其表达与子宫内膜癌的组织学分级、临床分期、子宫壁浸润深度、淋巴结转移等密切相关。并且研究发现,MTDH蛋白在多种人肿瘤组织中呈现过表达,如结肠癌、卵巢癌、膀胱癌等[5-7]。Yoo等[8]将QGY-7703肝癌细胞株异种移植于裸鼠,发现抑制MTDH基因的表达有助于肝癌的治疗;杜成等[9]研究发现,MTDH基因下调后,乳腺癌细胞株的增殖受到明显抑制,且黏附率及转移率均下降;上述研究为临床肝癌、乳腺癌的治疗提供了实验依据。本研究在蛋白水平观察了宫颈癌组织MTDH的表达情况,进一步证实宫颈癌组织MTDH蛋白的表达明显高于正常宫颈组织,且其表达与宫颈癌的分化程度、浸润深度、淋巴结转移以及临床分期有关。
综上所述,本研究亦提示MTDH参与了宫颈癌的发生、发展过程,尤其是宫颈癌的浸润、转移过程。因此,随着对MTDH研究的不断深入,寻找一个能阻碍MTDH作用的分子,有望成为合理有效的抗宫颈癌浸润和转移的新方法;并且,深入研究MTDH与宫颈癌临床病理特征的关系,也将为指导临床宫颈癌的治疗和预后评估提供新的理论依据。
[1] 李桃,齐洁敏.整合素α5β1和乙酰肝素酶在胃癌中的表达及意义[J].广东医学,2012,33(19):2974-2976.
[2] Su ZZ, Kang DC, Chen Y, et al. Identification and cloning of human astrocyte genes displaying elevated expression after infection with HIV-1 or exposure to HIV-1 envelope glycoprotein by rapid subtraction hybridization, RaSH[J]. Oncogene, 2002,21(22): 3592-3602.
[3] Guohong Hu, Yong Wei, Yibin Kang. The multifaceted role of MTDH/AEG-1 in cancer progression[J]. Clin Cancer Res, 2009,15(18): 5615-5620.
[4] Song H, Li C, Lu R, et al. Expression of astrocyte elevated gene-1: a novel marker of the pathogenesis, progression, and poor prognosis for endometrial cancer[J]. Int J Gynecol Cancer, 2010,20(7): 1188-1196.
[5] Song H,Li C,Li R,et al.Prognostic significance of AEG-1 expression in colorectal carcinoma[J].Colorectal Dis,2010,25(10): 1201-1209.
[6] Li C, Liu J, Lu R, et al. AEG-1 overexpression: a novel indicator for peritoneal dissemination and lymph node metastasis in epithelial ovarian cancers [J]. Int J Gynecol Cancer, 2011, 21(4):602-608.
[7] 周健,王增军,殷长军,等.膀胱移行细胞癌中MTDH和Ki-67的表达及临床意义[J].江苏医药,2012,38(11):1282-1284.
[8] Yoo BK, Emdad L, Su ZZ, et al. Astrocyte elevated gene-1 regulates hepatocellular carcinoma development and progression[J]. J Clin Invest, 2009, 119(3): 465-477.
[9] 杜成,刘兆喆,马东初,等.MTDH基因下调抑制人乳腺癌MDA-MB-453细胞增殖同黏附和迁移的研究[J].中国肿瘤临床,2012,39(8):425-428.

