天门冬水提液体外抗氧化及抑菌作用观察
谭 娟, 黄 静, 欧立军
(生命科学系湘西药用植物与民族植物学湖南省高校重点实验室 民族药用植物资源研究与利用湖南省重点实验室怀化学院,湖南怀化418008)
天门冬Asparagus cochinchinensis (Lour. )Merr. ,百合科天门冬属植物,在我国分布较广,其块根有养阴润燥、清肺生津的作用,是多个民族使用的中药材,同时可以作为滋补品使用[1]。目前对天门冬抗氧化能力的研究主要集中在体内,有研究发现,天门冬醇提液和水提液均可显著降低小鼠肝细胞膜MDA 水平[2],醇提取液能显著提高小鼠脑组织中NOS 和SOD 活性,使NO 水平增加[3],水提液能显著增强小鼠血清中NOS 活性,提高NO 水平[4]。天门冬属植物被报道有一定的抑菌作用,如芦笋[5]和长刺天门冬[6-7],而对该属中的主要药用植物天门冬的体外抗氧化和抑菌的研究少见报道。本实验通过分析天门冬水提液体外对DPPH、ABTS、羟基自由基和超氧阴离子等的清除及对金黄色葡萄球菌、大肠杆菌、苏云金芽孢杆菌和铜绿假单胞菌的抑制作用,探讨天门冬水提液体外抗氧化和抑菌能力,为开发天门冬深加工产品提供依据。
1 材料和方法
1.1 材料 天门冬,实验室自产,经曾汉元教授鉴定为百合科天门冬属天门冬物种。将天门冬烘干后,粉碎成粗粉。取20 g,加水160 mL 煮提3 次,1 h/次,合并3 次提取液,抽滤后用旋转蒸发仪浓缩得天门冬水提液,冷藏备用。参照《中国药典》[8]和熊大胜等[9],以人体实际所用天门冬生药剂量为标准,设定天门冬水提液的生药低、中和高质量浓度分别为1.0、2.0 和4.0 mg/mL。以BHT、Vc、青霉素和罗红霉素作为阳性对照,其配制方法如下:分别称取1g BHT 和Vc 溶于10 mL 的酒精中得到100 mg/mL 的BHT和Vc 溶液;分别称取0.1 g 罗红霉素和青霉素溶于10 mL的酒精中得到10 mg/mL 溶液,用10 倍稀释法稀释得到10 μg/mL罗红霉素和青霉素溶液。
1.2 方法
1.2.1 体外抗氧化作用
1.2.1.1 DPPH 自由基清除作用的测定 参考Jiang 等[10],取样品溶液2 mL,加入2 mL 1.25 ×10-4mol/L 的DPPH 溶液,迅速混匀后,室温下避光静置30 min,在517 nm 下测定溶液的吸光值,以无水乙醇代替样品作为空白,BHT 和Vc 作为阳性对照,根据公式,测出清除率:D% = [1 -(Ai-Aj)/Ac] ×100%,Ai为加入样品后的吸光值,Aj为样品本底吸光值,Ac为空白吸光值。
1.2.1.2 ABTS 自由基清除作用的测定 参考程超等[11],稍做修改,用2.45 mmol/L 的过硫酸钾配制7 mmol/L 的ABTS 贮备液,室温、避光条件下静置12 ~16 h,将ABTS贮备液用10 mmol/L pH 7.4 磷酸缓冲液稀释制备ABTS 测试液,使其在734 nm 的吸光度为(0.7 ±0.02),取4 mL ATBS 测试液,加入40 μL 样品溶液,振摇30 s,反应6 min 后,测定734 nm 波长处的吸光度,根据公式,测出清除率:清除率/% = (1 -A样品/0.700) ×100)。
1.2.1.3 羟基自由基和超氧阴离子的测定 按照南京建成生物工程研究所研制的试剂盒进行。
1.2.2 天门冬提取液抑菌作用
1.2.2.1 菌种活化 将融化的培养基装入试管,灭菌后摆斜面。在无菌条件下用划线法将供试菌种移接入相应的斜面培养基上,于37 ℃下培养18 ~24 h,进行菌种斜面活化。
1.2.2.2 供试菌株悬浮液的制备 麦氏比浊法制作菌悬液(9.8 mL 的1%的硫酸和0.2 mL 的0.25%的氯化钡溶液,制得的菌悬液含菌量为2.0 ×108CFU/mL):将活化好的菌种,在无菌条件下,每种分别挑取两环菌苔,各用生理盐水稀释,再与麦氏比浊液对比(调节生理盐水的用量),使菌液的浑浊度与麦氏比浊液浑浊度基本一样。
1.2.2.3 含菌平板制作 将新鲜配制的培养基于121 ℃条件下灭菌,当培养基冷至50 ~60 ℃时,超净工作台上将培养基倒入灭菌的90 mm 培养皿中,每皿15 ~20 mL 培养基,待平板冷却后,每皿中加入0.1 mL 菌悬液,用三角玻璃涂棒均匀涂成薄板备用。
1.2.2.4 抑菌作用测定 无菌操作,用镊子取无菌滤纸片在各个药液中浸湿,在容器壁沥去多余的溶液,在标记的相应位置的平板上贴好滤纸片(每组平行3 次,取平均值),37 ℃培养24 h,观察并测量抑菌环直径,比较抑菌效果(注:抑菌圈在15 mm 以上,抑菌能力强;抑菌圈在10 ~15 mm,抑菌能力较强;抑菌圈在10 mm 以下,抑菌能力弱)。
2 结果与分析
2.1 天门冬水提液体外抗氧化作用分析
2.1.1 天门冬水提液对DPPH 自由基的清除作用 天门冬水提液对DPPH 自由基的清除作用随着质量浓度的提高而增强,低、中和高质量浓度天门冬水提液对其的清除效果存在显著差异,但3 个质量浓度的提取液的清除效果都不如BHT 和Vc,这表明天门冬水提液有一定的DPPH 自由基的清除效果,但清除能力不如BHT 和Vc (表1)。

表1 天门冬水提液对DPPH 自由基的清除作用
2.1.2 天门冬水提液对ABTS 自由基的清除作用 天门冬水提液对ABTS 自由基的清除作用随着质量浓度的提高而增强,低和中质量浓度提取液的清除效果无明显差异,高质量浓度的水提液的清除效果与Vc 的清除效果接近,但低于BHT 的作用效果,这说明高质量浓度天门冬提取液对ABTS 自由基的清除作用较强,但不如BHT (表2)。
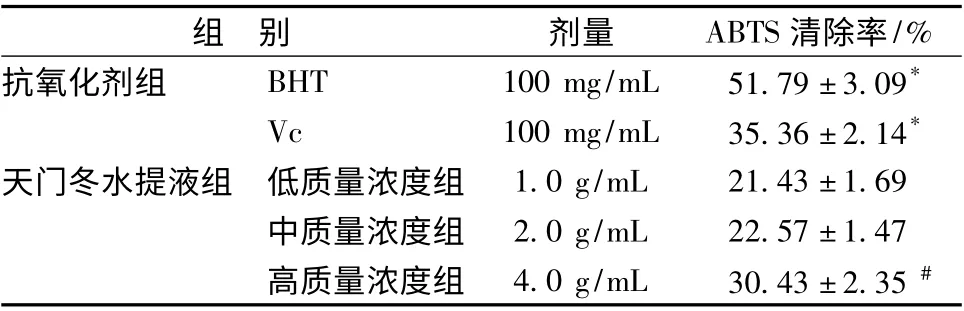
表2 天门冬水提液对ABTS 自由基的清除作用
2.1.3 天门冬水提液对羟基自由基的清除作用 天门冬水提液对羟基自由基的清除能力随着质量浓度的提高而增强,且不同质量浓度提取液的清除效果存在显著差异,高质量浓度水提液的清除效果显著高于BHT 和Vc,中质量浓度水提液的清除效果显著高于Vc,低质量浓度提取液的清除效果与Vc 接近,这说明天门冬提取液对羟基自由基的清除作用较强(表3)。

表3 天门冬水提液对羟基自由基的清除作用
2.1.4 天门冬水提液对超氧阴离子的清除作用 天门冬水提液对超氧阴离子的清除能力随着质量浓度的提高而增强,且不同质量浓度提取液的清除效果存在显著差异,高质量浓度水提液的清除效果显著高于BHT 和Vc,中质量浓度水提液的清除效果显著高于Vc,低质量浓度提取液的清除效果弱于Vc,这说明天门冬提取液有较强的清除超氧阴离子能力(表4)。

表4 天门冬水提液对超氧阴离子的清除作用
2.2 天门冬水提液体外抑菌作用分析 天门冬水取液对供试的细菌都有抑菌活性,且其随质量浓度的提高,抑菌作用增强,其中对金黄色葡萄球菌的抑制作用较强,最低抑菌质量浓度为0.5 g/mL,对大肠杆菌、苏云金芽孢杆菌和铜绿假单胞菌抑制作用较差,最低抑菌质量浓度为2 g/mL(表5)。
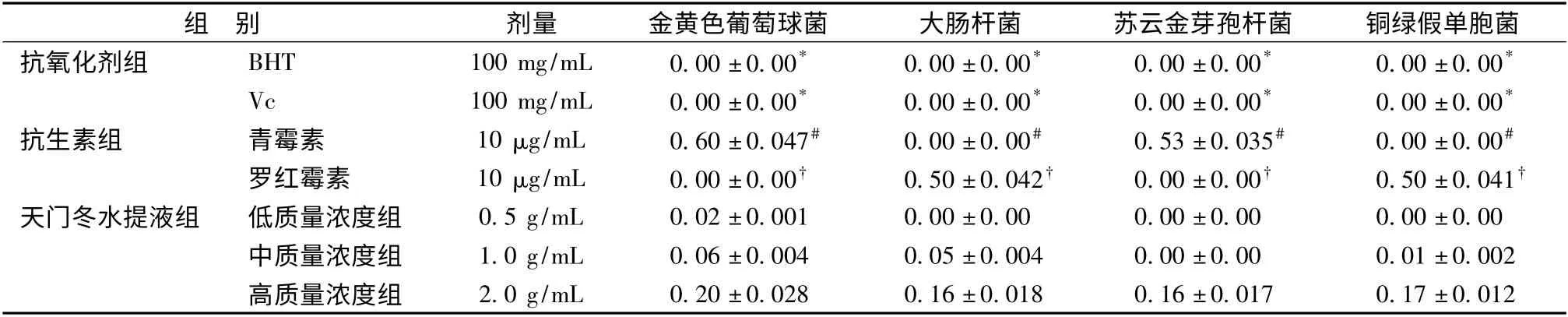
表5 不同浓度的天门冬水提液对细菌生长的抑制(抑菌圈直径单位cm)
3 讨论
有研究报道,天门冬的70%乙醇提取液对金黄色葡萄球菌、大肠杆菌、黑曲霉有较强的抑制作用[12]。本研究却表明,天门冬水提液对金黄色葡萄球菌抑菌效果相对较好外,对其他3 种菌的抑制效果都较差,可能与天门冬的提取溶剂有关,这与严寒静等[13]对金樱子,欧阳蒲月等[14-15]对顶芽狗脊茎、华南十大功劳的不同提取物体外抑菌活性研究结果类似,即不同提取物的抑菌效果不一致,且有研究认为,天门冬水提液的体内抗氧化效果优于其他提取液的效果[16],这可能与不同提取方法对不同化学成分的提取效果不一相关。同时,本研究认为,天门冬水提液的自由基清除能力随质量浓度的增加而增强;高质量浓度提取液对DPPH 和ABTS 自由基清除能力低于BHT 和Vc,中和高质量浓度提取液对羟基自由基和超氧阴离子自由基的清除能力不低于BHT 和Vc。
综上所述,天门冬水提液虽然抑菌能力较差,但有较强的体外抗氧化能力。因此天门冬作为药食兼用保健植物,可以与其他食物一起食用,达到清除体内自由基,抗氧化和预防衰老的作用。
[1] 姚念环,孔令义. 天门冬属植物化学成分及生物活性研究进展[J]. 天然药物研究与开发,1999,11(2):67.
[2] 曲凤玉,毛金军. 天门冬对D-半乳糖衰老模型小鼠红细胞膜、干细胞膜MDA 影响的实验研究[J]. 中草药,1999,30(10):763-764.
[3] 张鹏霞,曲凤玉. 天冬醇提取液对D-半乳糖致衰小鼠脑抗氧化作用的实验研究[J]. 中国老年学杂志,2000,20(1):42.
[4] 赵玉佳,孟祥丽. 天门冬水提液及其纳米中药对衰老模型小鼠NOS、NO、LPF 的影响[J]. 中国野生植物资源,2005,24(3):49-51.
[5] 冯翠萍,王亚琴. 芦笋皮抑菌作用的研究[J]. 食品科学,2007,28(12):105-109.
[6] Mandal S C,Nandy A,Pal M,et al. Evaluation of antibacterial activity of Asparagus racemosus root[J]. Phytother Res,2000,14(2):118-119.
[7] Uma B,Prabhakar K,Rajendran S. Anticandidal activity of Asparagus racemosus[J]. India J Pharm Sci,2009,71(3):342-343.
[8] 国家药典委员会. 中华人民共和国药典:2010 年版一部[S]. 北京:中国医药科技出版社,2010:52.
[9] 熊大胜,许云香,郭春秋. 天冬块根药用成分对小鼠抗氧化延缓衰老的影响[J]. 湖南文理学院学报,2009,21(4):40-43,46.
[10] Jiang S H,Li H Q,Ma H L,et al. Antioxidant activities of selected Chinese medicinal and edible plants[J]. Int J Food Sci Nutr,2011,62(5):441-444.
[11] 程 超,朱玉婷,田 瑞,等. 喷雾冷冻干燥对葛仙米藻胆蛋白抗氧化特性的影响[J]. 食品科学,2012,33(13):36-39.
[12] 方 芳,张 恒,赵玉萍,等. 天门冬的体外抑菌作用[J]. 湖北农业科学,2012,51(5):931-934.
[13] 严寒静,王振伟,田素英. 金樱子茎提取物体外抑菌活性研究[J]. 亚热带植物科学,2012,41(3):7-10.
[14] 欧阳蒲月,杨 斌,陈功锡,等. 顶芽狗脊提取物抑菌活性的初步研究[J]. 中药材,2012,35(1):111-115.
[15] 欧阳蒲月,黄智璇,莫端峰. 华南十大功劳提取物抑菌活性初步研究[J]. 亚热带植物科学,2012,41(3):1-6.
[16] 欧立军,赵丽娟,刘良科,等. 天门冬不同提取液对D-半乳糖衰老小鼠部分生理指标的影响[J]. 中成药,2013,35(11):2520-2522.

