莲房中原花青素的药理作用研究进展
陈超群, 吴春艳, 刘 霞, 杨兴伟, 马伟光* ,许 刚*
(1. 云南中医学院,云南 昆明650500;2. 中国科学院昆明植物研究所,云南 昆明650201)
莲房是莲科植物莲Nelumbo nucifera Gaertn. 的成熟花托,俗称“莲房”、“莲蓬”。李时珍在《本草纲目》中记载,“莲房,消瘀散血。治血胀腹痛及产后胎衣不下,酒煮服之”。民间常将莲房制成莲房炭作为一种止血药使用,并借此增加其保存时限。现代研究表明,莲房中的化学成分主要包括了生物碱、蛋白质、脂肪、糖类、纤维、胡萝卜素、维生素B2、维生素C、鞣质以及尼古酸等。
花青素(cyanidins)是广泛存在于植物中的水溶性天然色素,也是植物花瓣中的主要呈色物质,其母核为2-苯基苯并吡喃氧离子(图1),多以糖苷形式存在。由于A、B 环上的取代基有所不同,形成了目前已知的20 多种花青素。研究表明,花青素含量较高的植物包括葡萄、山楂、紫薯、银杏、苹果、沙棘等,其生理活性主要包括了抗氧化、抗突变、减轻肝机能障碍、降低心血管疾病的发病几率、抗肿瘤、抗辐射等[1-2]。
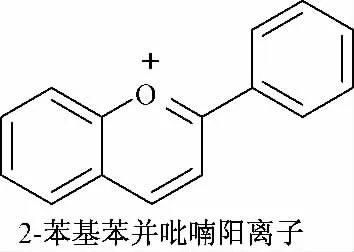
图1 花青素基本母核结构
原花青素(Procyanidins)[3]是由不同数量的表儿茶素或儿茶素(图2)通过C4 ~C6 或C4 ~C8 缩合而成的,最简单的原花青素是由儿茶素或表儿茶素自身缩合或儿茶素与表儿茶素共同形成的二聚体,此外还可以相互形成三聚体、四聚体等直至十聚体,通常将二聚体~四聚体称为低聚体(图3),五聚体以上称为高聚体。1961 年,德国人Karl 在新鲜山楂的乙醇提取物中首先分离得到两种多酚类成分,1976 年,美国人Joslyn 又从葡萄皮和葡萄籽中分离得到4 种多酚类化合物,这些多酚类化合物在酸性介质中加热均可产生花青素,因此将这类多酚成分命名为原花青素。
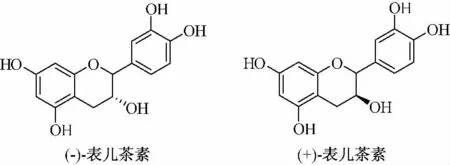
图2 表儿茶素结构
莲房中含有丰富的原花青素,凌智群[4]采用紫外光谱、红外吸收光谱、电喷雾电离质谱及超导核磁共振氢谱和碳谱分析技术对莲房原花青素(Lotus Seedpod Procyanidins,LSPC)进行了较为全面的分析,结果显示莲房原花青素在莲房中的含有量高达7.8%,其相对分子质量范围从291.1 ~1 155.3,包括了单体至四聚体和原花青素二聚体剖酸单酯与三聚体剖酸单酯,其中又以二聚体为主。Xiao 等[5]测定其低聚物和聚合物的平均聚合度为3.2和15.4。
近年来,鉴于莲房被认为可作为原花青素重要来源之一,对于莲房原花青素的药理研究也有了较大程度的进展。本文就其抗氧化、抗肿瘤、对中枢神经系统的作用、对心脑血管疾病的影响以及对免疫系统方面的作用等进行综述。
1 抗氧化

图3 原花青素低聚体结构图
1.1 清除自由基 周芸[6]研究表明,LSPC 对DPPH·(N,N-二苯基三硝基苯肼自由基)清除能力的IC50值为119.3 μg/mL,对·OH 自由基清除能力的IC50值为153.4 μg/mL,均强于维生素C (Vc)作用;其总还原能力与Vc 基本持平。相同浓度的莲房原花青素与葡萄籽原花青素的抗氧化能力无显著差异。凌智群等[7]证实LSPC 对活性氧自由基O2和·OH 的抑制率与LSPC 的浓度呈正相关。体外LSPC对肝脂质过氧化物(LPO)的生成有不同程度的抑制作用;口服中、低剂量LSPC 能显著降低CCl4中毒小鼠体内LPO水平,提高超氧化物歧化酶(SOD)、谷胱甘肽S-转移酶(GST)活性(P <0.01),提示适量的LSPC 具有抗活性氧自由基和脂质过氧化的作用。与此同时,体系酸碱度、金属离子(Cu2+、Ca2+、Al3+、Mg2+)对LSPC 清除·OH都有较大影响,其中以pH6 偏酸环境效果最佳,·OH 清除率高达99.9%;金属离子中又以Al3+的作用最为明显,可能与鳌合金属离子使其对轻基自由基清除作用增效有关[8]。
除此之外,LSPC 还对DNA 损伤有剂量依赖性抑制作用,最大抑制率达81.36%,IC50值为7.43 μg/mL。但是在不同体系中LSPC 的抗氧化能力存在差异[9]。
吴俊等[10]研究表明,利用莲房原花青素在清除自由基以及抗脂质过氧化方面所表现的出来的生理活性,能够有效减轻大强度运动训练致小鼠组织的炎症反应,缓解氧化应激损伤,对大强度运动训练小鼠的骨骼、心脏、肝脏及肾脏有明显的保护作用,并呈现出一定的剂量性依赖关系。
1.2 延缓衰老 老龄化可导致心脏、肝脏、肺、肾、骨骼肌等抗氧化能力的衰退,脂质过氧化反应显著增加,许继取等[11]通过测定老年大鼠上述组织内超氧化物歧化酶(SOD)、过氧化氢酶 (CAT)、谷胱甘肽过氧化物酶(GPX)、谷胱甘肽酶(GSH)的水平证实,LSPC 对由于年龄引起的抗氧化能力衰退有明显的改善作用。
蒋文等[12]研究表明,口服LSPC 能减少衰老小鼠脑组织中一氧化氮(nitric oxide,NO)的生成量(P <0.05),降低总一氧化氮合酶(NOS)的活性(P <0.01),高剂量组可明显降低神经元型一氧化氮合酶(neuronal nitric oxide synthase,nNOS)活性(P <0.05)。口服中高剂量LSPC 均可不同程度减少衰老小鼠脑组织中nNOS 的表达。表明LSPC 可保护神经元,延缓衰老,可能通过减少NO 和NOS生成起到此作用。
陈戈等[13]研究表明,LSPC 能够抑制小鼠衰老模型脑组织中的脂质过氧化,提高其SOD 和GSH-Px 活性(P <0.01),降低MDA 水平(P <0.01),对D-半乳糖造成的氧化损伤有一定的保护作用,提示提高抗氧化酶的活性和减少自由基的产生可能为其延缓衰老机制之一。
1.3 保护皮肤 LSPC 对于极低频电磁场(ELF-EMF)导致的星形胶质细胞氧化损伤引起的SOD 活力下降,MDA、星形胶质细胞内活性氧(ROS)、Ca2+水平上升有明显的阻止作用(P <0.05),提高细胞生长率(P <0.05),证实LSPC 对ELF-EMF 导致的星形胶质细胞氧化应激损伤有明显的预防作用[14]。LSPC 灌胃35 d 能明显降低大鼠血清和皮肤组织中MDA 水平(P <0.05),提高血清和皮肤组织中的SOD 活性、谷胱甘肽过氧化物酶(GSH-Px)活性和羟脯氨酸(Hyp)的水平,提高大鼠机体的抗氧化能力,抑制脂质过氧化作用的发生,促进胶原蛋白的合成并提高皮肤组织含水分量[8,15]。
1.4 对大鼠红细胞膜维生素E (VE)及膜脂流动性的影响 段玉清等[16]采用Fenton 反应体系产生·OH,诱导大鼠红细胞膜过氧化,测定LSPC 对红细胞膜中丙二醛(MDA)和VE 水平的影响,同时用荧光偏振度法观察LSPC 对膜脂流动性的影响。结果表明LSPC 能降低膜中MDA 的水平,减少VE 消耗,显著增加膜脂的流动性(P <0.05 和P <0.01);显著抑制膜脂质过氧化,与膜中天然VE 有协同作用且能使其再生,保持膜的完整性和功能性。LSPC 质量浓度为5.0 μg/mL 时能使氧化膜的荧光偏振度(P 值)接近正常红细胞膜P 值水平[8]。
1.5 对油脂的抗氧化作用 LSPC 对油酸和动植物油脂均显示不同程度的抗氧化效果,可将茶籽油的氧化诱导期延长2.2 倍;与维生素E 的复配能将油酸的诱导期延长14.7倍,猪油的诱导期延长3.6 倍。对脂肪氧合酶呈剂量依赖性抑制作用提示LSPC 可对油脂类食品风味的保存起到重要作用[17-18]。凌智群等[19]研究表明,0.1%的原花青素在大豆油中具有强烈的抗氧化作用,效果优于同剂量的BHT(butylated hydroxytoluene);质量浓度为62.5 μg/mL 时对于脂肪氧化酶的抑制活性可达90%,IC50为21.6 μg/mL。
2 抗肿瘤
2.1 抗肝癌 适量LSPC 可有效地拮抗乙醇诱导的L-02 肝细胞氧化损伤作用,提高肝细胞生存率,使细胞内MDA 水平降低(P <0.01),SOD、过氧化氢酶(CAT)、GSH 水平增加(P <0.01),有效降低细胞DNA 损伤程度(P <0.05)[20]。梁慧敏等[21]研究表明,LSPC 能对人肝癌细胞SMMC-7721 的生长起到抑制以及诱导其凋亡的作用。与此同时,LSPC 还可降低人肝癌细胞HepG2 的DNA 合成能力,使其停在G2 期;对HepG2 的凋亡作用以及生长抑制损伤基因GADD45β、GADD153、GADD34 的表达水平都与LSPC 呈剂量依赖性,80 mg/L 时细胞凋亡达到高峰[22]。
2.2 抗黑色素瘤 适量LSPC 可使黑色素瘤B16 细胞膜破损,细胞形态改变,黑色素水平增加,S-100 蛋白阳性表达细胞数下降,黑色素瘤细胞减少。表明LSPC 对B16 细胞有形态上和功能上的诱导分化作用[23-24]。段玉清等[25-26]研究表明,LSPC 对小鼠黑色素瘤B16 细胞的生长集落形成都具有与剂量与时间有依赖关系的抑制作用,其最大抑瘤率可达55.3%。同时,LSPC 可以显著降低脂质过氧化(LPO)水平,增加肝脏中超氧化物歧化酶(SOD)、过氧化氢酶(CAT)和谷胱甘肽过氧化物酶(GSH-Px)的活性。LSPC 对于肿瘤增长的预防作用通过包括细胞周期阻滞、诱导肿瘤细胞死亡的细胞凋亡和钙离子的增加,抗氧化酶的活性以及免疫调节作用等机制实现。
酪氨酸酶是黑色素生物合成的关建酶,LSPC 对酪氨酸酶最大抑制率可达99.9%,该抑制作用属于可逆的竞争性抑制;LSPC 对黑色素的中间产物L-多巴色素转化黑色素的半抑制浓度IC50为1.750 g/L,最大抑制率69.8%。表明LSPC 对于黑色素的体外生物合成有较强的抑制作用[27]。
2.3 预防口腔癌 杜晓芬等[28]研究表明,适量LSPC 对人口腔表皮样癌(KB)细胞的生长有明显的抑制作用,可使细胞形态发生明显的变化,诱导KB 细胞凋亡并引起KB 细胞坏死,且具有较小的细胞毒性。同时,LSPC 可改变KB细胞表面豁附分子CD44v 和CD44s 蛋白的表达量,从而抑制肿瘤的浸润和转移[29]。
对于二甲基苯芘蒽(DMBA)诱发的金黄地鼠口腔癌,LSPC 灌胃给药和涂布地鼠颊囊给药都有预防作用,可明显延迟出现的病理变化且使变化程度较轻,其机制可能与两种方式都能降低机体内脂质过氧化,提高机体GSH-Px 和T-SOD 活性,增强机体的抗氧化能力有关[30]。涂布LSPC又直接隔离了DMBA 对地鼠颊囊勃膜的激癌作用,预防效果更优[29],而灌胃方式的抗氧化能力增强效果更好,但对于DMBA 诱发的金黄地鼠颊囊癌变治疗作用并不明显[29]。
2.4 抗其它肿瘤 适量LSPC 对荷瘤小鼠腹腔巨噬细胞吞噬功能、细胞免疫功能、体液免疫功能等有明显的增强作用。抑瘤实验证实LSPC 对小鼠S180 肉瘤具有明显的抑制作用,剂量达120 mg/kg 时抑制率可达67%,为提高荷瘤小鼠免疫器官增长指数的最佳效果值[31]。
在12.5 ~100 μg/mL 质量浓度范围内,LSPC 对人肺癌细胞LETP-2、人胃腺癌细胞SGC-7901、人黑色素瘤细胞A375 均有较强的抑制作用。其中LSPC 质量浓度为100 μg/mL作用72 h 对于3 种瘤细胞的生长抑制率分别为62.6%、49.8%、77.0%,集落形成抑制率分别为77.0%、43.2%、95.3%[32]。王威[33]研究表明,LSPC 通过线粒体通路引起细胞凋亡,继而抑制细胞增殖,起到抑制人结肠癌细胞增殖的作用。王小红等[34]研究表明,适量LSPC 对于Hela 宫颈癌细胞有细胞毒作用,通过抑制细胞DNA 的复制,对肿瘤细胞生长周期产生影响,从而诱导癌细胞凋亡,IC50为190.8 μg/mL,最高抑制率可达57.16%。
3 改善记忆
东莨菪碱可使小鼠产生学习记忆障碍,张丽等[35]研究表明LSPC 与银杏内酯联用能够改善此障碍,Morris 水迷宫可缩短潜伏期,减少游泳距离,跳台实验可延长平台停留期,显著减少错误机会,乙酰胆碱酯酶活性检测显示LSPC能显著抑制乙酰胆碱酯酶的活性[36],可减少小鼠脑中MDA 的水平、提高SOD 活性和降低MAO-B 活性[37]。许继取[38-41]进一步研究表明,LSPC 对大鼠学习记忆能力的改善机制主要通过改善抗氧化系统、胆碱能系统和NO 系统功能以及增加CREB (cAMP 反应元件结合蛋白)活性等环节共同完成。提示LSPC 对阿尔茨海默式症以及衰老引起的极易损伤有修复作用,但不能回到正常水平[42]。
中枢神经系统对于ELF-EMF 的高度敏感性导致了ELF-EMF 能够抑制神经元的增殖、海马椎体细胞数量的减少以及钙调神经磷酸酶的活性增加,这些都被认为记忆力下降的重要因素。张海晖等[43]证实,LSPC 对正常海马神经元细胞无毒副作用,但对于ELF-EMF 所造成的海马神经元损伤,具有明显的预防作用,其作用机理可能与保护细胞膜完整性以及清除细胞内ROS 自由基有关。
4 保护心脑血管
LSPC 能够显著调节血清、心肌瘦素以及肿瘤坏死因子(tumor necrosis factor-α,TNF-α)水平,增强机体的抗氧化作用,一定程度改善血管内皮功能及血液流变,起到控制炎症、保护心血管系统的作用。但无明显降脂作用[44-46]。
张晓晖等[47]研究表明,LSPC 可有效降缺血再灌注时低内皮素(ET)和血管紧张素Ⅱ(AngⅡ)的水平,保持心肌细胞的超氧化物歧化酶(SOD)活性,减少丙二醛(MDA)的生成,显著提高大鼠心肌缺血再灌注后血清的NO 水平。心脏复灌以后冠脉流量和心率明显恢复,冠脉流出液磷酸肌酸激酶(CK)和乳酸脱氢酶(LDH)释放明显减少,心肌组织黄嘌呤氧化酶(XO)的活性降低,心肌超微结构的病理变化得到改善等。表明LSPC 对心肌缺血再灌注损伤有明显的保护作用。
张晓辉、凌智群等[48-49]研究表明,LSPC 可保护Iso 所致的心肌损伤,使有关心肌缺血损伤的指标以及结扎冠脉所引起的心肌梗死范围都得到显著改善,升高超氧化物歧化酶(SOD)与丙二醛(MDA)的比值,降低血清中CK和LDH 的活性,拮抗Iso 引起的大鼠心肌酶释放量、心肌钙水平增加、缩小心肌梗死面积,ECG 的J 点压低程度减轻,心肌病理损伤程度减轻。LSPC 通过清除氧自由基或抑制氧自由基的产生,防止细胞内酶的释放,稳定了细胞膜和细胞内环境,在一定程度上提高了心肌组织的耐缺氧能力。其疗效优于钙通道阻滞剂diltiazem (10 mg/kg)和复方丹参(8 mg/kg),表明LSPC 对于实验性心肌损伤具有保护作用并与其中多项指标呈剂量依赖性。提示LSPC 对Iso 所致的大鼠心肌损伤具有保护作用的机制可能与防止心肌钙超载、减轻脂质过氧化、稳定细胞膜和提高SOD 活性有关。
低剂量的LSPC 能够有效降低脂肪乳剂导致的高血脂家兔血清和肝中的甘油三酯(TG)值(P <0.05),高剂量LSPC 能显著降低血清中肝总胆固醇(TC)以及血清低密度脂蛋白-胆固醇(LDL-C)水平(P <0.01)。LSPC 能够显著增高高密度脂蛋白-胆固醇(HDL-C)值,与剂量无关[50]。
5 增强免疫功能
段玉清等[51]研究表明,适量LSPC 对小鼠体内腹腔巨噬细胞吞噬功能以及二硝基氟苯(DNFB)诱导的迟发型反应都有显著的增强作用,除此之外,血清溶血素含量的显著升高,抗体形成能力、NK 细胞活性以及T、B 细胞增值作用的加强,都证实LSPC 对免疫功能有较强的调节作用。
60Co-γ 射线辐射可致外周血中白细胞 (white blood cell,WBC)、红细胞 (red blood cell,RBC)、血小板(platelets,PLT)和血红蛋白(haemoglobin B,Hb)水平明显增高。200 mg/ (kg·bw)LSPC 对辐射21 d 小鼠血象中各类细胞含量的恢复作用最佳,提示LSPC 对于60Co-γ 射线辐射导致的小鼠血像损伤具有明显的防护或恢复效应。LSPC 还显著提高了小鼠的平均存活时间,100 mg/(kg·bw)和200 mg/(kg·bw)LSPC 组分别较对照组提高了49.2%和58.3%,保护指数均≥1.0[52]。
Duan 等[53]以瑞士白化小鼠为研究对象,200 mg/kg LSPC 灌胃15 d 可降低辐射诱发死亡率,增加平均存活时间并将半数致死量(LD50)从8.9 增加至10.5 Gy,剂量修正因子(DMF)为1.18,可有效地保持脾指数正常,维持嗜多染红细胞(PCE)与嗜正染红细胞(NCE)的比值(P/N 比率),显著降低骨髓染色体损伤和过氧化脂质(LPO)水平,提升照射后肝脏内源性抗氧化酶的活性,被认为预防γ-射线辐射相关疾病的最佳剂量。另外,适量LSPC 可有效保护小鼠免受60Co-γ 射线辐照引起的肝脏肥大,提高小鼠脾脏和胸腺的增长指数,且与辐射对照组间有显著性差异(分别为P <0.01 和P <0.05)。表明LSPC对免疫器官组织损伤有一定的保护或恢复作用,同时也有提高机体抗辐射能力的作用[54],其机制主要与其抗氧化活性、调节和增强细胞免疫功能以及促进或改善骨髓造血功能有关[8]。
6 结语
莲房中富含原花青素,而在民间除作药用,多将莲房丢弃,造成了资源的大量浪费。原花青素药理作用的多样性,使其在多个领域都具有广阔的应用前景。如何将两者结合起来,同时对莲房中原花青素的的药理作用及其机制进行深入全面的研究,还需要进一步地探讨。
[1] 赵云荣,王世雷. 植物花青素研究进展[J]. 安徽农业科学,2008,36(8):3095-3097.
[2] 孙建霞,张 燕,胡小松,等. 花青素的提取、分离以及纯化方法研究进展[J]. 食品与发酵工业,2008,34(8):111-117.
[3] 张 妍,吴秀香. 原花青素研究进展[J]. 中药药理与临床,2011,27(6):112-116.
[4] 凌智群. 莲房原花青素及其生物、药理活性研究[D]. 武汉:华中农业大学,2002.
[5] Xiao J S,Xie B J,Cao Y P,et al. Characterization of oligomeric procyanidins and identification of quercetin glucuronide from lotus (Nelumbo nucifera Gaertn.)seedpod[J]. J Agric Food Chem,2012,60:2825-2829.
[6] 周 芸. 莲房原花青素制备工艺及抗氧化活性研究[D].杭州:浙江大学,2012.
[7] 凌智群,谢笔钧. 莲房原花青素对氧自由基和脂质过氧化的作用[J]. 营养学报,2002,24(2):121-125.
[8] 段玉清. 莲原花青素对皮肤的保护作用及其分子机制研究[D]. 武汉:华中农业大学,2004.
[9] 邓乾春,陈春艳,田斌强,等. 化学发光法研究莲房原花青素的体外抗氧化活性和对DNA 损伤的保护作用[J]. 天然产物研究与开发,2007,19:563-567,613.
[10] 吴 俊,姚 平,高 超. 莲房原花青素对大强度运动小鼠器官与组织的保护作用[J]. 食品科学,2013,34(5):260-263.
[11] Xu J Q,Rong S,Xie B J,et al. Procyanidins extracted from the lotus seedpod ameliorate age-related antioxidant deficit in aged rats[J]. J Gerontol Ser A,2010,65A(3):236-241.
[12] 蒋 文,唐 瑛,王晓昆,等. 莲房原花青素对衰老小鼠脑组织中一氧化氮及一氧化氮合酶的影响[J]. 华南国防医学杂志,2009,23(4):22-24.
[13] 陈 戈,唐 瑛,杨 李,等. 莲房原花青素对D-半乳糖衰老小鼠脑组织抗氧化的作用[J]. 中国药师,2009,12(8):1023-1025.
[14] 张 瑞,段玉清,武 妍,等. 莲房原花青素对极低频电磁场致星形胶质细胞氧化损伤的预防作用[J]. 食品工业科技,2013,34(5):49-53.
[15] 段玉清,谢笔钧. 莲房原花青素体内抗氧化研究[J]. 营养学报,2003,25(3):306-308.
[16] 段玉清,王小红,谢笔钧,等. 莲房原花青素对大鼠红细胞膜维生素E 及膜脂流动性的影响[J]. 营养学报,2005,27(1):30-33.
[17] 禹华娟. 莲原花青素的酶辅助提取技术及其在油脂中的抗氧化活性研究[D]. 武汉:华中农业大学,2010.
[18] 禹华娟,孙智达,谢笔钧. 莲原花青素在油脂体系中的抗氧化 作 用[J]. 中 国 农 业 科 学,2010,43 (10):2132-2140.
[19] Ling Z Q,Xie B J,Yang E L. Isolation,characterization,and determination of antioxidative activity of oligomeric procyanidins from the seedpod of Nelumbo nucifera Gaertn[J]. J Agric Food Chem,2005,53:2441-2445.
[20] 唐 瑛,李文华,唐忠志,等. 莲房原花青素对乙醇诱导肝细胞凋亡的拮抗机制[J]. 华中科技大学学报 (医学版),2005,34(6):674-677.
[21] 梁慧敏,时小燕,随裕敏,等. 莲房花青素诱导人肝癌细胞SMMC-7721 凋亡的研究[J]. 中国实用医药,2011,6(19):37-38.
[22] 杜 宏,张 娜,高 霞,等. 莲房原花青素对人肝癌细胞HepG2 生长及凋亡的作用[J]. 实用医学杂志,2008,24(6):891-893.
[23] 周 密,段玉清,王文兵,等. 莲原花青素抗黑色素瘤的研究[J]. 食品科学,2009,30(11):223-226.
[24] 段玉清,张海晖,吴 佳,等. 莲房原花青素对黑色素瘤B16 细胞的诱导分化作用[J]. 癌变·畸变·突变,2007,19(5):377-380.
[25] 段玉清,周 密,张海晖,等. 莲房原花青素对黑色素瘤B16 细胞的抑制作用[J]. 中国药学杂志,2009,44(2):103-106.
[26] Duan Y Q,Zhang H H,Xu F F,et al. Inhibition effect of procyanidins from lotus seedpod on mouse B16 melanoma in vivo and in vitro[J]. Food Chem,2010,122:84-91.
[27] 段玉清,刘 睿,谢笔钧. 莲房原花青素对酪氨酸酶活力和黑色素生物合成影响的初步研究[J]. 食品科学,2004,25(3):169-174.
[28] 杜晓芬,谢笔钧,张玲珍,等. 莲房原花青素对人口腔表皮样癌(KB)细胞生长及形态的影响[J]. 现代口腔医学杂志,2005,19(4):384-386.
[29] 杜晓芬. 莲房原花青素对口腔癌的药理作用及其机制研究[D]. 武汉:华中农业大学,2004.
[30] 杜晓芬,谢笔钧,杨尔宁,等. 莲房原花青素对二甲基苯芘蒽诱发金黄地鼠口腔癌的预防作用[J]. 营养学报,2005,27(3):241-244.
[31] 张海晖,段玉清,邓乾春,等. 莲房原花青素对小鼠S180肉瘤及其免疫功能影响的研究[J] 食品科学,2005,26(11):220-223.
[32] 张海晖,段玉清,陈 乾,等. 莲房原花青素体外抗肿瘤作用研究[J]. 食品科技,2007,10:251-254.
[33] 王威. 原花青素抑制人结肠癌细胞增殖及分子机制研究[D]. 广州:暨南大学,2011.
[34] 王小红,王一娴,曹艳妮,等. 几种植物多酚对Hela 细胞抑制作用的初步研究[J]. 现代食品科技,2009,25(1):10-14.
[35] 张 丽,许继取,荣 爽,等. 莲房原花青素和银杏内酯联用对东莨菪碱所致小鼠记忆获得性障碍的改善作用[J].华中科技大学学报(医学版),2009,38(3):355-358.
[36] 张 丽,许继取,荣 爽,等. 莲房原花青素对东莨菪碱所致小鼠记忆获得性障碍的改善作用[J]. 中国神经免疫学和神经病学杂志,2009,16 (6):406-410.
[37] 龚玉石,唐 瑛,肖俊松,等. 莲房原花青素改善小鼠学习记忆障碍的研究[J]. 营养学报,2006,28 (4):318-321.
[38] 许继取. 莲房原花青素对老年认知障碍大鼠记忆功能的改善作用及其研究机制[D]. 武汉:华中农业大学,2010.
[39] Xu J Q,Rong S,Xie B J,et al. Rejuvenation of antioxidant and cholinergic systems contributes to the effect of procyanidins extracted from the lotus seedpod ameliorating memory impairment in cognitively impaired aged rats[J]. Eur Neuropsychopharmacol,2009,19:851-860.
[40] Xu J Q,Rong S,Xie B J,et al. Memory impairment in cognitively impaired aged rats associated with decreased hippocampal CREB phosphorylation:Reversal by procyanidins extracted from the lotus seedpod[J]. J Gerontol Ser A,2010,65A(9):933-940.
[41] Xu J Q,Rong S,Xie B J,et al. Changes in the nitric oxide system contribute to effect of procyanidins extracted from the lotus seedpod ameliorating Memory impairment in cognitively impaired aged rats[J]. Rejuv Res,2011,14(1):33-43.
[42] Xu J Q,Rong S,Xie B J,et al. Procyanidins extracted from the lotus seedpod ameliorate scopolamine-induced memory impairment in mice[J]. Phytother Res,2009,23 (12):1742-1747.
[43] 张海晖,武 妍,张 瑞,等. 莲房原花青素对低级频电磁场致海马神经元损伤的预防作用[J]. 食品科学,2013,34(13):229-233.
[44] 唐 瑛,黄光华,吴建军,等. 莲房原花青素对高脂血症大鼠瘦素及TNF-α 的影响[J]. 华南国防医学杂志,2008,22(4):5-7.
[45] 唐 瑛,黄光华,吴建军,等. 莲房原花青素对高脂血症大鼠脂质过氧化及内皮素1 的影响[J]. 华南国防医学杂志,2008,22(4):9-11.
[46] 唐 瑛,黄光华,吴建军,等. 莲房原花青素对高脂血症大鼠血液流变学的影响[J]. 华南国防医学杂志,2008,22(4):12-14.
[47] 张晓晖,张 斌,龚培力,等. 莲房原花青素对大鼠心肌缺血再灌注损伤的保护作用[J]. 药学学报,2004,39(6):401-405.
[48] 凌智群,谢笔钧,江 涛,等. 莲房原花青素对大鼠实验性心肌缺血的保护作用[J]. 中国药理学通报,2001,17(6):687-690.
[49] 张晓晖,张 斌,龚培力,等. 莲房原花青素对心肌缺血的保护作用及其机制的研究[J]. 中国药学杂志,2004,39(10):747-750.
[50] 凌智群,谢笔钧,周顺长,等. 莲房原花青素对家兔血脂及肝组织形态的影响[J]. 天然产物研究与开发,2001,13(4):62-64.
[51] 段玉清,张海晖,邓乾春,等. 莲房原花青素对免疫功能的影响[J]. 食品研究与开发,2007,28(12):1-4.
[52] 段玉清,张海晖,唐 瑛,等. 莲房原花青素对60Co-γ 射线致亚急性辐射损伤防护的研究[J]. 营养学报,2005,27(6):491-493.
[53] Duan Y Q,Zhang H H,Xie B J,et al. Whole body radioprotective activity of an acetone-water extract from the seedpod of Nelumbo nucifera Gaertn. seedpod[J]. Food Chem Toxicol,2010,48:3374-3384.
[54] 段玉清,张海晖,唐 瑛,等. 莲房原花青素对60Co-γ 射线致免疫器官损伤的防护作用[J]. 食品科学,2006,27(1):220-222.

