大孔吸附树脂纯化无柄金丝桃茎部总黄酮工艺研究
郭 飞,胡晓旭,雷红菲,黄 薇,谭 伟,王红斌*
1云南民族大学民族药资源化学国家民委教育部重点实验室;2 云南民族大学化学与生物技术学院,昆明 650500;3 大理市农产品质量安全检测站,大理 671000
无柄金丝桃[1](Hypericum augustinii N.Robson)是藤黄科金丝桃属植物,在云南省主要分布在红河、文山等地。金丝桃属植物主要成分有二蒽酮、间苯三酚衍生物、口山酮、黄酮等类型的化合物,此外,还含有甾醇、萜类、脂肪酸挥发油等[2],其主要有镇痛、抗抑郁、抗肿瘤、抗菌、抗炎、抗病毒等多种药理活性[3]。黄酮类化合物生物活性多样,具有对心肌缺血保护、抗癌、对内分泌系统的免疫、降血脂、解热、镇痛、抗炎、降血糖等作用[4],尤其是近年来,黄酮类化合物在抗病毒(如艾滋病毒、流感病毒等)、逆转肿瘤细胞多药耐药性、诱导肿瘤细胞凋亡等[5,6]研究中表现出显著活性。无柄金丝桃在中药中以全株入药,用于治疗肝炎和肿痛,其药效与黄酮类化合物药效有相似之处,因此,纯化无柄金丝桃中总黄酮对于进一步研究无柄金丝桃的药理作用有重要意义。
大孔吸附树脂[7]在中草药的有效成分的纯化分离中有着广泛的应用[8],作为一类有机高聚物吸附剂,大孔吸附树脂具有物理及化学特性稳定、吸附选择性好、解吸容易、可反复利用、操作简便、安全、对有机物选择性较好、不受无机盐类及低分子化合物的影响等优点,近年来,大孔吸附树脂纯化植物中黄酮类化合物的工艺研究[9-11]报道很多,但对纯化无柄金丝桃提取物总黄酮很少有报道,本文将研究大孔吸附树脂纯化无柄金丝桃茎部总黄酮工艺条件。
1 材料、试剂与仪器
材料:无柄金丝桃茎(于2009年8 月采自云南省文山州广南县经中国科学院昆明植物研究所鉴定);树脂:D101 树脂、S8 树脂、AB8 树脂、ADS17 树脂(天津南开大学化工厂提供);试剂:芦丁标准品(中国药品及生物制品检定所)、无水乙醇、亚硝酸钠、硝酸铝、氢氧化钠等均为分析纯试剂。
仪器:WFJ7200 型可见分光光度计(尤尼柯仪器有限公司),AL204 电子天平(梅特勒托利多仪器有限公司),AS10200AD 医用数控超声波清洗器(天津奥特赛恩斯仪器有限公司),OSB—2100 旋转蒸发仪(上海爱朗仪器有限公司),SHZ—D(Ⅲ)循环水式真空泵(巩义市英峪予华仪器厂),HY—2 振荡器,HH—4 电子恒温水浴锅,pHs—3 酸度计。
2 实验方法
2.1 总黄酮粗提物的制备
称取300.00 g 无柄金丝桃茎粉于烧杯中,在乙醇浓度61%,料液比52∶1(mL/g),超声时间21 min的条件下提取,将提取液离心除杂、过滤,干燥,得到粗提物,备用。
2.2 标准曲线的绘制
参照文献[12],将芦丁标准品在干燥箱内于120℃条件下恒重1.5 h,然后精确称取其0.0100 g 用60%的乙醇溶液配制成50.00 mL 的溶液。精确吸取黄酮对照品芦丁标准溶液0.00、1.00、2.00、3.00、4.00、5.00 mL 于6 支10.00 mL 的比色管中,用质量分数为30%的乙醇稀释到5.00 mL 处,加入5%的亚硝酸钠溶液0.30 mL,混匀,放置6 min,加入10%硝酸铝溶液0.30 mL,混匀,放置6 min,再加入4%的氢氧化钠溶液4.00 mL,混匀,加入30%的乙醇溶液至刻度,摇匀,10 min 后于波长510 nm 处测定吸光度(以第一瓶为空白溶液),然后以芦丁溶液浓度(mg/mL)为横坐标和吸光度(A)为纵坐标作图,分析得到回归方程为:A=9.8393C +0.0021,R=0.9998,结果表明在10~50 μg/mL 之间有良好的线性关系,可作为无柄金丝桃茎部提取物总黄酮含量的测定依据。
2.3 总黄酮含量的测定
取一定量总黄酮粗提物,按照标准曲线法于波长510 nm 处测定吸光度,计算总黄酮的质量分数。
式中:C—溶液中总黄酮的浓度(mg/mL);V—定容体积(mL);M—粗提物的质量(mg);W—总黄酮质量分数(%)。
2.4 大孔吸附树脂的预处理
取D101 树脂、S8 树脂、AB8 树脂、ADS17 树脂4 种树脂各50 g,用蒸馏水浸泡24 h 后装柱,分别用无水乙醇浸泡4 种树脂待充分溶胀,用无水乙醇冲柱至加入适量蒸馏水无浑浊,随后用蒸馏水洗尽无水乙醇,备用。
2.5 大孔吸附树脂的选择
2.5.1 树脂吸附率和解吸率的测定
称取经预处理D101 树脂、S8 树脂、AB8 树脂、ADS17 树脂4 种干树脂[13]各1.00 g,分别置于100 mL 具塞锥形瓶中,各加入一定量已知浓度的无柄金丝桃茎部总黄酮溶液,振摇吸附24 h 后,过滤,测定平衡浓度,计算静态吸附率;将上述饱和吸附的树脂滤出,吸干表面水分,加入无水乙醇20 mL,振摇解吸24 h 后,过滤,测定平衡浓度,计算静态解吸率。计算公式如下:
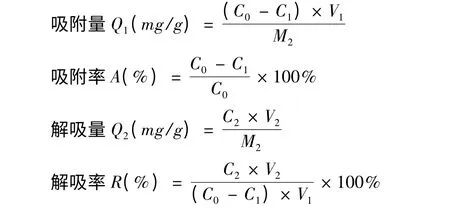
式中:Q1—吸附量;Q2—解吸量;A—吸附率(%);R—解吸率(%);C0—起始浓度(mg/mL);C1—平衡浓度(mg/mL);V1—吸附液体积(mL);M2—树脂重量(g);C2—解吸液浓度(mg/mL);V2—解吸液体积(mL)。
2.5.2 静态吸附解吸动力学研究
取预处理的D101、AB8 两种树脂各1.00 g,置于2 个具塞三角瓶中,加入相同量的总黄酮粗提取物溶液,25 ℃下恒温振荡。按间隔时间1、2、4、6、8、10、12、24 h 取样测定,根据测定结果计算吸附量和解吸率,并绘制吸附动力学曲线和解吸动力学曲线。
2.6 AB8 树脂纯化无柄金丝桃茎部总黄酮的工艺参数研究
分别考察上样溶液的pH 值、上样液浓度、上样液流速、上样液体积、树脂柱径高比、洗脱剂乙醇浓度、洗脱剂乙醇pH 值对树脂纯化无柄金丝桃茎部总黄酮效果的影响。
2.7 验证试验
在最佳工艺参数的条件下,取无柄金丝桃茎部总黄酮粗提液进行3 组平行试验纯化,并与未经AB8 大孔吸附树脂纯化的总黄酮粗提液3 组平行试验进行比较。
3 结果与分析
3.1 大孔吸附树脂的选择
3.1.1 树脂吸附率和解吸率的测定
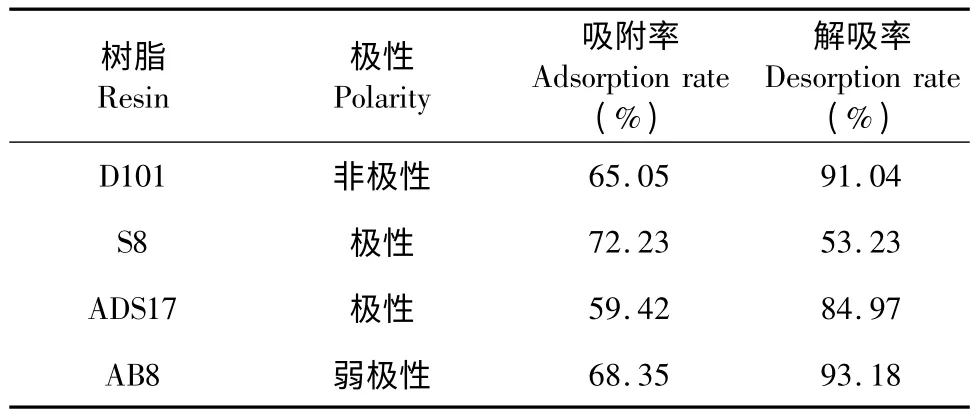
表1 不同型号树脂物理性能及对总黄酮的吸附和解吸情况Table 1 Adsorption and desorption conditions of flavonoids and physical properties of different types of resins

图1 D101、AB8 树脂静态吸附动力学曲线(A)和静态解吸动力学曲线(B)(25 ℃)Fig.1 Static adsorption kinetic curves (A)and static desorption kinetic curves (B)of D101 and AB8 at 25 ℃
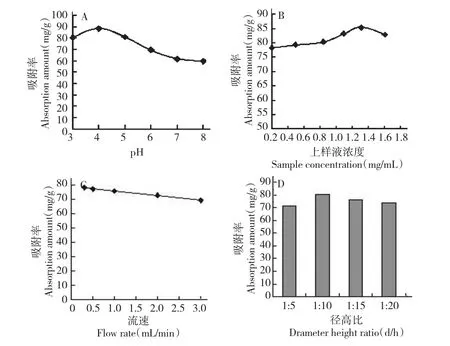
图2 上样液pH 值(A)、上样液浓度(B)、上样液流速(C)和径高比(D)对AB8 树脂吸附率的影响Fig.2 Effects of pH (A),concentration (B),flow rate of sample solution (C)and diameter/height ratio of resin column (D)on adsorption rate of AB8
不同类型的大孔吸附树脂对无柄金丝桃茎部总黄酮的吸附率和解吸率如表1,S8 的吸附率最大,但是解吸率却很小;ADS17 的吸附率最小,且解吸率小于D101、AB8 树脂,可排除。D101、AB8 两种树脂的吸附率和解吸率相当,需通过吸附解析动力学研究,对D101、AB8 树脂做进一步筛选。
3.1.2 静态吸附解吸动力学研究
由图1(A)可知,在25 ℃下,在吸附初期,D101、AB8 大孔吸附树脂对无柄金丝桃茎部总黄酮的吸附率随时间的增加迅速增大,这是由于树脂提供的活性吸附位点多、总黄酮的浓度高和克服传质阻力的推动力大的原因[14]。当吸附时间达到13 h后,吸附量增加已不明显,但AB8 树脂的吸附量比D101 大。由图1(B)知,D101、AB8 树脂都能在短时间内解吸出无柄金丝桃茎中的黄酮类化合物,相比之下,AB8 树脂的解吸率稍高,D101 树脂次之,这与树脂的极性与无柄金丝桃茎部总黄酮化合物的结构相关,遵从结构相似吸附原则。故本实验选择AB8 树脂为纯化无柄金丝桃茎部总黄酮的树脂。
3.2 AB8 树脂纯化无柄金丝桃茎部总黄酮的工艺参数研究
3.2.1 上样液pH 值的选择
在上样溶液的pH 值分别为3、4、5、6、7、8 的条件下,经预处理的1.00 g AB8 树脂进行吸附,10 h后测平衡液浓度,计算不同pH 值的吸附率,如图2(A)所示,pH 值对AB8 树脂的吸附影响显著,主要是不同的pH 值的溶液有不同的电离程度,表现出对吸附物质不同的亲和力[14],当pH 值小于4.0 时,AB8 树脂对总黄酮类的吸附效果优于碱性条件,故选择上样液pH=4.0 左右为佳。
3.2.2 上样液浓度的选择
取不同浓度的样品溶液(pH=4.0),以流速为1.00 mL/min 分别过AB8 大孔吸附树脂柱、(10 mm×100 mm),收集流出液,测定流出液中残余总黄酮的量,计算不同上样液浓度的吸附率,上样浓度对AB8 大孔吸附树脂的吸附率如图2(B)所示。由图2(B)知,在低浓度范围内(0.2~1.3 mg/mL),上样液浓度与吸附率呈正相关。随着上样液浓度增加,AB8 树脂对无柄金丝桃茎部总黄酮的吸附率增加;而在1.30 mg/mL 后,吸附率呈下降趋势,这是由于大孔吸附树脂具有一定的吸附容量,当吸附量达到饱和时,其对黄酮类化合物的吸附减弱,即泄漏流出,故上样液浓度应选择在1.30 mg/mL 左右为宜。
3.2.3 上样液流速的选择
取浓度为1.30 mg/mL 的总黄酮提取液(pH=4.0),分别在流速为0.30、0.50、1.00、2.00、3.00 mL/min 下过柱(10 mm ×100 mm),收集流出液,测定流出液中残余总黄酮的量,计算不同上样液流速的吸附率,如图2(C)所示,树脂的吸附容量随流速的增大而下降。因此,在相同条件下,上样液流速慢有利于无柄金丝桃茎中黄酮类化合物的吸附,但考虑到工作效率,选择1.00 mL/min 的流速过柱。

图3 上样液体积对AB8 树脂未吸附率的影响Fig.3 Effect of sample volume on end of adsorption of AB8
3.2.4 上样液体积的选择
取浓度为1.30 mg/mL 的样液(pH=4.0),以1.00 mL/min 速度过柱(10 mm × 100 mm),以5 mL/瓶收集流出液,测定泄漏点(以未吸附率达到25%计),考察不同上样体积对未吸附率的影响,如图3 所示。由图3 可知,上样液体积在5~60 mL 时未吸附率呈缓慢上升,说明此阶段为吸附过程;而到60 mL 后未吸附率开始急剧上升,这说明此时已经达到泄漏点,而在120 mL 之后未吸附率基本不再变化,说明树脂的吸附容量在此条件下已达到饱和点。因此,为避免树脂吸附过饱和而成死吸附,上样液体积应选择在60 mL 左右为宜。
3.2.5 树脂柱径高比的选择
取浓度为1.30 mg/mL 的样液60 mL(pH=4.0),分别在树脂柱径高比为1 ∶5、1 ∶10、1 ∶15、1∶20,流速为1.00 mL/min 的条件下过柱,测定流出液中总黄酮含量,考察不同径高比对树脂吸附率的影响,如图2(D)所示。由图2(D)可知,在其它条件恒定下,当树脂柱径高比为1∶10 时,吸附率最大,故选择1∶10 的树脂柱径高比。
3.2.6 洗脱剂浓度的选择
由于乙醇具有极性大、毒性低及易浓缩回收的特点,本实验选用乙醇作为洗脱剂。取浓度为1.30 mg/mL、体积60 mL(pH=4.0)的样液,以1.00 mL/min 速度分别过5 根AB8 树脂柱(10 mm × 100 mm),待吸附平衡后,先以蒸馏水洗脱,再分别用50%、60%、70%、80%、90%乙醇以1 mL/min 流速进行洗脱,以三角烧瓶收集流出液(5 mL/瓶),测定总黄酮含量,并计算不同乙醇浓度的洗脱率与洗脱量。由图4(A)可以看出,随着洗脱剂中乙醇浓度的增加,无柄金丝桃茎部总黄酮的洗脱率也增加,当70%乙醇洗脱时,洗脱率最高,达到96.8%,由图4(B)可知,当用70%乙醇洗脱,脱附峰比较集中,且洗脱剂用量也相对较小,故选择70%乙醇溶液为最佳洗脱剂。

图4 乙醇浓度对洗脱率的影响(A)和动态洗脱曲线(B)Fig.4 Effects of ethanol concentration on elution rate of flavonoids (A)and dynamic elution curve (B)
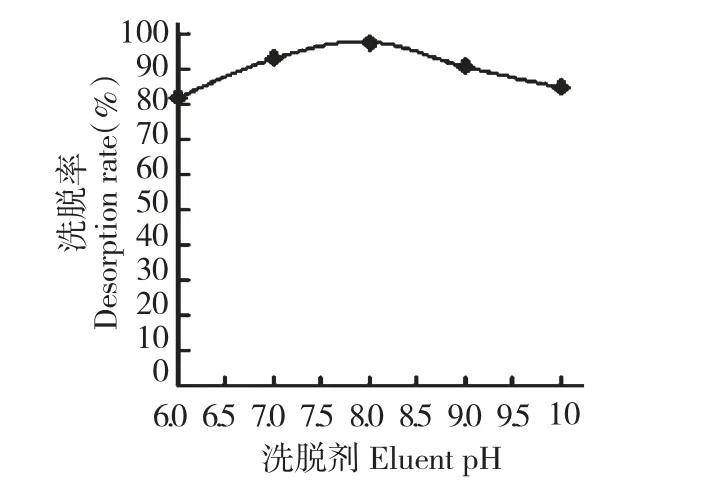
图5 洗脱剂pH 值对洗脱率的影响Fig.5 Effect of eluent pH on elution rate of flavonoids
3.2.7 洗脱剂pH 值的选择
在其它条件不变的情况下,考察不同pH 值乙醇洗脱剂对总黄酮洗脱率的影响,其洗脱效果如图5 所示。由图5 可知,当洗脱剂pH 值为8.0 左右时,洗脱率最大,这是因为黄酮类化合物显弱酸性,因此稍显碱性的洗脱剂,有助于洗脱率的增大。考虑到实验操作的方便性,乙醇溶液显中性,且pH 值为7.0 与8.0 的洗脱率较接近,本实验选择洗脱剂pH 值为7.0。
3.3 验证试验
在最佳工艺参数的条件下,取无柄金丝桃茎部总黄酮粗提液进行3 组平行试验纯化,并与未经AB8 大孔吸附树脂纯化的总黄酮粗提液3 组平行试验进行比较,结果如表2 所示。
由表2 可知,未经AB8 大孔吸附树脂吸附纯化时,无柄金丝桃茎部提取物总黄酮的平均含量为30.26%,经AB8 吸附树脂纯化的总黄酮平均含量为55.70%,纯度提高84.07%。表明AB8 大孔吸附树脂对无柄金丝桃茎部提取物总黄酮起到了有效的纯化效果。
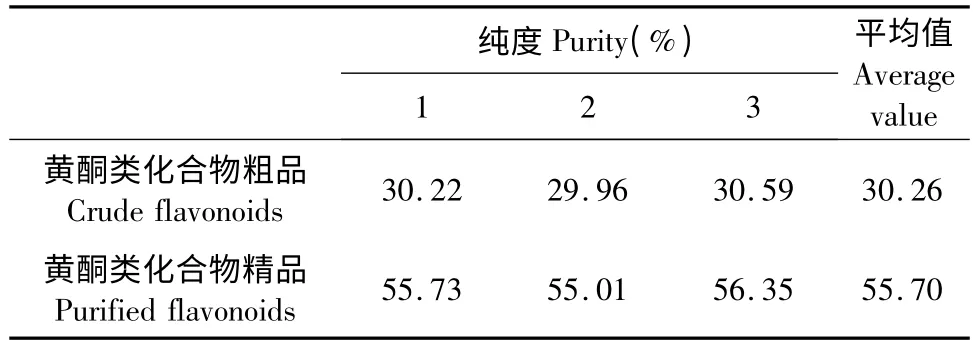
表2 AB8 树脂纯化前后总黄酮的含量比较Table 2 Comparison of flavonoids content before and after purification by AB8
4 结论
实验选取D101、AB8、S8、ADSL17 4 种不同极性的大孔吸附树脂对无柄金丝桃茎部总黄酮的纯化效果进行比较分析,通过静态吸附、解析动力学实验研究,得到弱极性大孔吸附树脂AB8 易吸附(吸附率为68.35%),易解吸(解吸率为93.18%),是性能良好的纯化无柄金丝桃茎部总黄酮的最佳树脂。同时,优化了AB8 大孔吸附树脂纯化无柄金丝桃茎部总黄酮的工艺条件,得到最佳纯化工艺参数为上样液浓度为1.30 mg/mL、体积为60 mL、pH=4.0,1.00 mL/min 的流速,树脂柱径高比为1∶10,pH=7.0 的70%乙醇洗脱剂。在最佳工艺参数的条件下,无柄金丝桃茎部提取物总黄酮的纯度由30.26%提高到了55.70%,纯度提高84.07%,说明用AB8 大孔吸附树脂纯化无柄金丝桃茎部总黄酮方法具有一定的推广价值。
1 China Flora Editorial Board of CAS(中国科学院中国植物志编辑委员会).China Flora (archives of 50,no.2)(中国植物志第50 卷,第2 分册).Beijing:Science Press,1990.
2 Xiao ZY(肖志勇),Mu Q(穆青).Advances on chemical investigation of Hypericum..Nat Prod Res Dev(天然产物研究与开发),2007,19:344-355.
3 Yin ZQ(殷志琦),Ye WC(叶文才),Zhao SX(赵受训).Advances in pharmacological effects Hypericum.China Prac Med(中国医学生物技术应用杂志),2003,02:14-16.
4 Tang X(唐栩),Xu DH(许东辉),Mei XT(梅雪婷),et al.Pharmacological studies 26 kinds of natural active ingredients flavonoids progress.J Chin Med Mater(中药材),2003,26:46-54.
5 Yan M(严敏),Tang XL(唐筱露).Research survey of flavonoids antiviral.Asia-Pacific Tradit Med(亚太传统医药),2009,5:149-150.
6 Zhu RX(朱荣鑫),Zhang SL(张赛龙),Jin LS(金永生).Recent advances in the study on antitumor effects of flavonoids.Drugs Clinic(现代药物与临床),2010,25:5-10.
7 Wang YS(王跃生),Wang Y(王洋).Research advances of macroporous resin.China J Chin Mater Med(中国中药杂志),2006,31:961-965.
8 Liu Y(刘玥).Progress of application of macroporous resin in the extraction and purification of traditional Chinese medicine.World Chin Med,2013,8:232-234.
9 Huang YC(黄月纯),Huang YH(黄樱华),Liu CL(刘翠玲),et al.Study on purification of the total flavonoids (phe-nolic acids)from Herba Lycopk with S-8 macroporous adsorption Resin.Chin J Mod Appl Pharm(中国现代应用药学),2010,21:694-698.
10 Chen C(陈超),Chen GQ(陈国芹),Chen AL(陈阿丽),et al.Optimization of purification technology for effective parts from compound Tongmai granules by AB-8 macroporous absorption resin.Chin J Exp Tradit Med Form (中国实验方剂学志),2013,19(5):4-6.
11 Dong HY(董恒颖),Wang Y(王莹).Purification process for flavonoids from haw thorn leaves with ADS type of macroporous resin.Tianjin Pharm(天津药学),2010,22(5):67-71.
12 Huang XZ(黄相中),Yin Y(尹燕),Yang QL(杨晴来),et al.Studies on antioxidation and detemination of total flavonoids in Ginkgo biloba leaves from Kunming.J Yunnan Univ of Nat,Nat Sci Ed(云南民族大学学报),2010,19:369-371.
13 Fu BQ,Liu J,Li H,et al.The application of macroporous resins in the separation of licorice flavonoids and glycyrrhizic acid.J Chromatogr A,2005,1089:18-24.
14 Liu FQ(刘福强),Xia MF(夏明芳),Yao SL(姚姗丽),et al.Adsorption equilibria and kinetics for phenol and cresol onto polymeric adsorbents:effects of adsorbents adsorbates structure and interface.J Hazard Mater,2008,152:715-720.

