均相Fenton氧化降解对木素模型物对羟基苯丙酸去除效果的研究
王 昶 张宗鹏 王 芳 张思月 豆宝娟
(1.天津科技大学海洋科学与工程学院,天津,300457;2.天津科技大学材料科学与化学工程学院,天津,300457)
当前,造纸废水作为污染环境的主要污染源日益受到人们的重视,我国造纸行业废水排放量占全国工业废水总排放量的1/6。造纸废水成分复杂,污染物浓度高,除含有大量的纤维素、木素及化学药品外,还含有众多的有机物,COD高,排放量大,是引起水体污染和环境破坏的重要有机污染源,处理难度极大[1-3]。造纸废水中,由3种基本结构单元(愈创木基单元、紫丁香基单元和对羟基苯丙烷单元)组成的木素,因其结构复杂、分子质量大以及对生物的毒性,很难采用生物方法进行降解[4-5]。
近年来高级氧化法成为造纸废水处理的热点,特别是Fenton试剂法用于处理造纸废水得到了广泛关注。Fenton试剂法具有操作过程简单、反应物易得、费用低、无需复杂设备、对后续的生化处理无毒害作用且对环境友好等优点,已逐渐应用于制浆造纸废水的深度处理领域[6]。
本研究在前期愈创木酚[7]、紫丁香醇[8]实验基础上,进一步针对组成木素的对羟基苯丙烷单元,选择木素类模型物——对羟基苯丙酸(HL)作为目标化合物,研究了均相Fenton试剂对木素类模型物HL的降解效果,详细探讨了溶液pH值、H2O2用量、Fe2+用量、HL溶液初始浓度、反应时间、紫外光(UV)照射等因素对HL降解的影响,为今后全面考查Fenton试剂对木素的降解提供有价值的实验数据。
1 实验
1.1 实验仪器及试剂
(1)仪器:Lab Tech UV-9100D紫外-可见分光光度计;GE Sievers InnovOx实验室总有机碳(TOC)分析仪;85-2恒温磁力搅拌器;J500型精密电子天平;Hanna Instruments pH211精密酸度计;ZSZ型紫外灯(8 W)。
(2)试剂:对羟基苯丙酸(HL)、硫酸亚铁、质量分数为30%的双氧水、氢氧化钠、稀硫酸及无水亚硫酸钠均为分析纯,购于天津市江天化工技术有限公司。
1.2 降解目标物对羟基苯丙酸
HL的分子式C9H10O3,主要结构为苯基烷、酚羟基、羧基,分子结构如图1所示,最大吸收波长λmax=275.35 nm。

图1 HL的化学结构
在275.35 nm下测定配制的不同质量浓度HL溶液的吸光度值(A),得到如图2所示的标准曲线。

图2 HL定量分析标准曲线
利用一元线性法得到HL溶液质量浓度(C)与吸光度(A)的关系式(1):

其中,相关系数R2=0.9997。符合Lambert-Beer光吸收定律。
1.3 实验方法
1.3.1 H2O2的理论用量
根据文献[8],按照式(2)计算可知,250 mL质量浓度为 60 mg/L的HL溶液完全氧化所需的H2O2(质量分数为30%)理论用量(Qth)为0.74 mL/L。以此为参考,实验选取的H2O2用量为此用量的倍数。

1.3.2 HL去除实验
取一定量的HL溶于蒸馏水配制成250 mL溶液,加入反应器中,再将反应器置于恒温磁力搅拌器上搅拌,用稀H2SO4或NaOH溶液调节至所需pH值。然后,加入一定量现配的FeSO4溶液搅拌均匀,最后加入一定量的H2O2(质量分数30%)后开始计时。一定时间后,取5 mL反应液,立即加入一定量的Na2SO3溶液使反应终止,在波长275.35 nm处测定其吸光度。根据式(1)确定溶液中剩余HL的质量浓度,并按式(3)计算HL去除率:
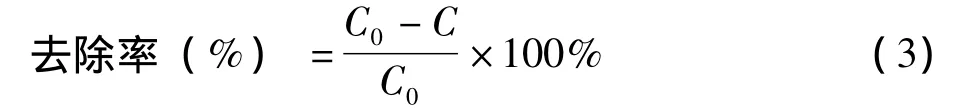
式中:C0为处理前HL溶液的质量浓度,mg/L;C为处理后HL溶液的浓度质量,mg/L。
2 结果与讨论
2.1 体系初始pH值的影响
室温下,用0.030 g HL配成质量浓度为60 mg/L的HL溶液,取250 mL该溶液用稀H2SO4或NaOH溶液调节初始pH值分别为2、3、4(未经调整的原始值)、5、6、8、9,H2O2用量为 2倍理论量(2Qth),n(Fe2+)∶n(H2O2)=1∶100,按实验方法进行实验,反应时间为60 min。不同初始pH值对HL去除率的影响见图3。

图3 初始pH值对HL去除率的影响
由图3可见,当溶液初始pH值在4.0~5.0范围内时,Fenton和UV/Fenton对HL的去除效果较好,尤其当 pH值为4.0时,去除率分别达到最大值79.2%和100%。而当pH值为2.0时,HL去除率为57.1%和 99.7%;当 pH 值为6.0时 HL去除率为28.4%和32.4%。可见当体系处于酸性条件时,有利于Fenton反应的进行。一方面,当pH值过低时,H+浓度过高,强酸性环境使H2O2稳定性增强,单位时间内生成的·OH的数量减少,同时还抑制了Fe3+向Fe2+的还原,使Fenten氧化体系中的羟基自由基对HL分解作用减弱,导致去除率下降。另一方面,随着pH值增大,尤其是H2O2在碱性溶液中很不稳定,会快速分解成O2和H2O。而且,Fe2+在碱性条件下也易形成沉淀,从而导致催化H2O2分解成·OH的能力大大降低。由此可见,合适的pH值对于Fenton反应具有重要意义。由于HL溶液原始pH值为4,其酸碱性基本在一个比较合适的范围内,所以以下实验中,固定溶液初始pH值为4.0,即溶液原始pH值不进行调整。
2.2 H2O2用量的影响
为了考查H2O2用量对HL去除率的影响,室温下,取适量的HL配制成质量浓度为60 mg/L的溶液250 mL,分别加入不同用量的 H2O2(质量分数30%):0.25Qth(即 0.25 倍的理论用量,下同)、0.5Qth、1.0Qth、2.0Qth和 3.0Qth,n(Fe2+)∶n(H2O2)=1∶100,进行 Fenton氧化降解反应,反应时间为60 min,然后分别取一定体积的溶液测定其吸光度,再由标准曲线计算出相应的质量浓度以及去除率,结果见图4。
由图4可见,HL的去除率先随H2O2用量的增加而增大。当H2O2用量为2.0Qth时,HL去除率最大,之后去除率开始降低。在 UV照射条件下,1.0Qth~3.0Qth的 H2O2对于 HL 的去除率基本没有影响,都达到100%。这是因为H2O2是·OH的生成剂,同时也是消除剂。当H2O2用量超过适宜范围时,过多的 H2O2会清除·OH,发生式(4)和式(5)的反应,致使·OH数量减少、利用率下降。因此,选择合适的H2O2用量极为重要。

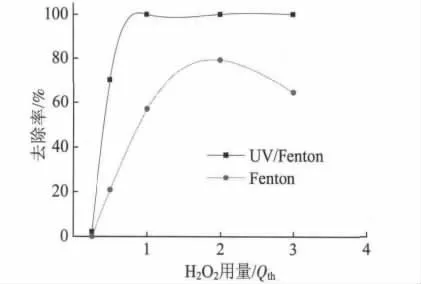
图4 H2O2用量对HL去除率的影响
2.3 Fe2+与H2O2摩尔比的影响
室温下,取适量的HL配成质量浓度为60 mg/L的溶液250 mL,H2O2用量为2.0Qth,改变 Fe2+与H2O2摩尔比为 1∶200、1∶160、1∶100、1∶80、1∶60 进行Fenton反应,反应时间60 min。Fe2+与H2O2摩尔比对废水中HL去除率的影响见图5。

图5 Fe2+与H2O2摩尔比对HL去除率的影响
由图5可见,当 n(Fe2+)∶n(H2O2)=1∶100时,HL去除率达到最大值。低于或高于这个比值其去除率会降低。这是因为Fe2+作为Fenton反应的催化剂能加速·OH的产生,随着Fe2+的增加,单位时间内产生的·OH数量增加,总数不断增加,HL的最终去除率不断提高。但Fe2+用量再进一步增加时,去除率反而下降。这主要是由于:①高浓度的Fe2+使H2O2在短时间内大量分解产生·OH,相对于废水中污染物是有富余的,此时·OH会发生复合反应而被消耗掉(见式(5));②高浓度的Fe2+会与·OH发生如式(6)的竞争反应:
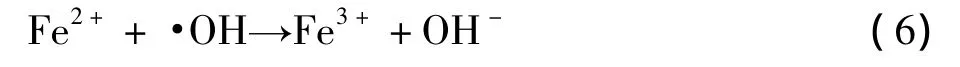
这两种因素均会导致·OH利用率下降。而在UV照射下能减小这种差异。
2.4 HL溶液初始质量浓度的影响
室温下,配置质量浓度分别为20、40、60、80、100 mg/L的 HL溶液各250 mL,H2O2按各自溶液的 2.0Qth添加,n(Fe2+)∶n(H2O2)=1∶100,反应时间为60 min。不同初始质量浓度下HL的去除率见图6。
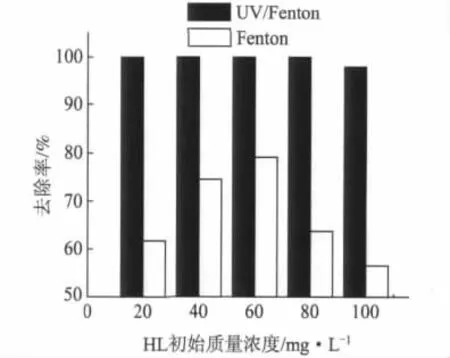
图6 HL初始质量浓度对去除率的影响
由图6可见,在无UV照射条件下,HL去除效果与其初始质量浓度有很大关系:HL初始质量浓度较低时,其去除率也较低。这是由于虽然H2O2加入量是按照各自溶液的2.0Qth添加的,但毕竟HL初始质量浓度较低,相应H2O2用量少,催化剂Fe2+浓度也低,所以必然导致溶液中产生·OH的浓度较小,氧化反应不充分;随着初始浓度增加,H2O2和催化剂Fe2+用量相应增加,去除率也逐渐提高;但是,当初始质量浓度超过一定值后,所产生的·OH会因相对浓度过高,引起·OH之间的复合反应,反而降低了自由的·OH量,最终导致去除率下降。由图6还可以知道,无UV照射的条件下,单纯的Fenton氧化过程对HL的降解效果是很有限的。但UV照射条件下,Fenton体系中的羟基自由基在UV高能量的作用下,变得更为活泼,快速与HL反应,促使其分解,去除效果显著提高,去除率接近100%。因此,在实际处理废水中,应考虑到H2O2浓度的影响,在高浓度情况下,Fenton试剂要采用分批次的优化投加,尤其是H2O2加入方式,尽可能避免·OH之间的复合反应,提高Fenton试剂的降解效果;另外应尽可能使用UV,促进Fention氧化过程,提高去除率。
2.5 反应时间的影响
室温下,取适量的HL配成质量浓度为60 mg/L的溶液250 mL,在 H2O2用量为 2.0Qth、n(Fe2+)∶n(H2O2)=1∶100的条件下进行Fenton反应。反应时间对HL及TOC去除率的影响见图7。

图7 反应时间对HL和TOC去除率的影响
由图7可知,在无UV照射条件下,HL去除率随反应时间延长而逐渐增加,20 min以内变化较快,20 min后变化缓慢,60 min之后基本不变。说明随着Fenten氧化过程的不断进行,溶液中HL逐渐减少,最终失去了降解能力,尤其对于苯环结构稳定的化合物。
另外,为了考察降解过程中中间产物的变化情况,使用TOC总有机碳分析仪分析了不同处理时间下,溶液中残余的总有机碳(TOC)含量,这些物质包含了HL以及由它降解的分子质量更小的有机化合物,由图7可以很清楚地发现,尽管HL去除率相对较高,但此时溶液中的TOC去除率较低,即溶液中HL降解并不能代表它已被完全矿化,降解过程也是一个低分子化的过程,因此,通过TOC分析仪在线分析可以了解Fenton氧化过程对污染物的最终降解能力。在UV照射条件下,在开始阶段反应速率很大,10 min时,HL去除率就可达到83.7%,而此时无UV照射条件下只有46.5%;20 min时,HL几乎完全被降解,而无UV条件下去除率只有59.3%,充分显示了UV对Fenton氧化过程的促进作用。在UV高能量的激发下,不仅提高了·OH自由基的产生,增加了其活性,同时还活化了有机化合物,降低了他们相互之间反应的活化能,所以UV照射可以与Fenton试剂形成协同效应,加速有机物降解。不难看出,不论是UV/Fenton体系,还是Fenton体系,TOC去除率均低于HL的去除率。这表明HL并不是直接就被全部氧化成CO2和H2O,而是先被降解成为其他有机物中间体[9],然后再一步一步慢慢矿化。无UV照射条件下,尽管HL在Fenton试剂作用下部分降解,但这与有机物的完全矿化还有很大差距,也就是说,HL降解的一些有机物中间体仍然存在于溶液之中,而UV照射下,HL降解就相对比较完全,溶液中的TOC去除率也能够达到90%以上,说明降解产生的有机物中间体也随着UV和Fenton试剂的协同效应得到了进一步降解。但事物总是一分为二的,·OH自由基之间的相互作用也有副作用,所以在UV条件下,H2O2用量是过程控制的一个重要指标,可以采用低浓度或分批投加的方法,提高其协同效应。
2.6 UV的影响
由图3~图7可以看出,在Fenton体系中引入UV照射可以大大提高HL的去除率。相同条件下,UV/Fenton和Fenton两体系中HL的去除率相差很大,而这样的差别不是单独UV照射效果和Fenton试剂产生效果的简单加和。由实验可知,单独采用UV照射,HL几乎不降解,所以Fenton试剂和UV之间确实存在协同效应,若充分利用这一特性,将会在Fenton氧化技术的实际应用中提供良好的集成技术,既可以减少Fenton试剂用量,又可以提高降解效果。
3 结论
选择木素类模型物——对羟基苯丙酸(HL)为研究对象,研究了均相Fenton试剂对HL的降解效果,详细探讨了体系pH值、H2O2用量、Fe2+用量、HL溶液初始质量浓度、反应时间,尤其是UV照射等因素对HL降解的影响。
3.1 均相Fenton氧化过程中,对于初始质量浓度为60 mg/L的木素类模型物HL废水,HL降解的最佳工艺条件为:体系初始pH值4.0,H2O2(质量分数为30%)用量为2倍的理论投加量(2.0Qth,即每升HL溶液中,需1.48 mL的H2O2溶液),Fe2+与H2O2的摩尔比为1∶100,反应时间60 min,此时HL去除率可达79.2%。
3.2 当体系中有紫外光(UV)照射后,UV与Fenton试剂形成了协同效应,有效加快了HL和中间体有机物的降解速度,20 min后,溶液中的HL和TOC的去除率分别达到98.3%和79.6%。
3.3 对于均相Fenton氧化体系,在有UV照射条件下,H2O2用量是过程控制的一个重要指标,可以采用低浓度或分批投加的方法,提高H2O2的有效利用率,降低处理成本。
[1]杨丽云,李怡帆,孙剑辉.Fenton氧化法深度处理草浆造纸废水的研究[J].工业水处理,2010,30(11):59.
[2]刘千钧,袁 斌,伍 红,等.Fenton法深度处理制浆造纸综合废水实验研究[J].造纸科学与技术,2009,28(4),57.
[3]刘晓静,文一波.Fenton试剂法深度处理造纸废水的实验研究[J].中国资源综合利用,2007,25(4):11.
[4]Makhotkina O A,Preis S V,Parkhomchuk E V.Water delignification by advanced oxidation processes:Homogeneous and heterogeneous Fenton and H2O2photo-assisted reactions[J].Applied Catalysis B:Environmental,2008,84(3):821.
[5]Hustert K,Zepp R G.Photocatalytic degradation of selected azo dyes[J].Chemosphere,2004,24(23):35.
[6]Lunar L,Sicilia D,Rubio S,et al.Identification of Metal Degradation Products under Fenton Reagent Treatment Using Liquid Chromatagraphy mass Spectrometer[J].Water Res,2000,34(13):3400.
[7]王 昶,刘 芳,贾青竹,等.Fenton试剂氧化降解愈创木酚[J].中国造纸学报,2009,24(4):72.
[8]王 昶,张丽萍,李 伶,等.Fenton试剂氧化降解紫丁香醇的研究[J].环境工程,2011,29(1):62.
[9]王 昶,李晨陶,贾青竹,等.纳米TiO2光催化降解紫丁香基木素模型物[J].中国造纸学报,2009,24(3):47.

