氟浓度对体外培养大鼠软骨细胞糖胺多糖和II型胶原分泌的影响
范玉兰, 王 宁, 施志冲, 郑卫东, 卢 伟, 肖 萍
(上海市疾病预防控制中心毒性评价科, 上海 200336)
氟浓度对体外培养大鼠软骨细胞糖胺多糖和II型胶原分泌的影响
范玉兰, 王 宁, 施志冲, 郑卫东, 卢 伟, 肖 萍
(上海市疾病预防控制中心毒性评价科, 上海 200336)
目的 探讨氟浓度对体外培养软骨细胞糖胺多糖(GAG)和II型胶原分泌的影响。方法 取2月龄雌性SD大鼠下肢髋关节及膝关节软骨,分离、培养出软骨细胞后,接种于细胞培养瓶,经鉴定后, 分为空白对照组和 NaF 受试组(6.25 μmol/ml、12.50 μmol/ml、25.00 μmol/ml、50.00 μmol/ml和100.00 μmol/ml),孵育6 d后,分别进行GAG含量测定、阿利新蓝染色和II型胶原免疫组化染色。结果 NaF受试6 d后,大鼠软骨细胞培养液GAG含量各组无显著性差异(P>0.05); 阿利新蓝染色显示, 大鼠软骨细胞内的糖原异染颗粒亦无明显差异; II型胶原免疫组化染色则显示,不同剂量NaF可引起对软骨细胞外II型胶原染色积分随剂量的升高逐渐上升(P<0.05)。结论 NaF对大鼠软骨细胞GAG分泌可能无影响,但可能影响Ⅱ型胶原的分泌。
氟化钠; 软骨细胞; 糖胺多糖; II型胶原
氟骨症是一种由于长期摄入氟浓度引起的慢性地方性骨关节病,主要侵害四肢关节的骨、软骨和骨周组织,导致关节功能障碍,严重者可致脊柱和四肢关节畸形。有研究表明,过量氟可引起儿童和实验动物的软骨内成骨障碍; 还可使实验大鼠的骺板软骨表现肥大、软骨细胞增多、成熟障碍,关节软骨病理切片可见单个、散在的软骨细胞变性、萎缩、坏死,软骨基质和细胞内钙盐沉积及软骨内骨化[1~2]; 过量氟可促进软骨胶原蛋白的生物合成[3]。氟浓度对实验大鼠软骨细胞基质和胶原分泌的研究十分有限,目前尚无定论。本文拟研究氟浓度对体外培养软骨细胞糖胺多糖(glycosaminoglycan, GAG)和II型胶原分泌的作用,旨在探明氟浓度对软骨细胞的功能影响和氟骨症的发病机制。
1 材料与方法
1.1 实验动物
2月龄雌性SPF级SD大鼠2只,由上海西普尔-必凯实验动物有限公司提供[SCXK(沪)2008-0016]。饲养于上海市疾病预防控制中心SPF级动物设施内[SYXK(沪)2012-0008]。
1.2 主要试剂和仪器
氟化钠(NaF), 含量>99.9%(Sigma进口分装), 贝科的改良伊格尔培养基: 营养合剂的F12(DMEM/F12)培养液(Sigma 公司), 胎牛血清(FBS, Gibco), 透明质酸酶、胰蛋白酶、II型胶原酶(Sigma公司), 鼠抗人II型胶原多克隆抗体及PowerVisionTM免疫组化试剂盒(北京中杉金桥公司)。仪器: 倒置显微镜(日本Olympus公司); 生物显微镜(日本Nikon公司); 透射电镜(德国Philips公司)。
1.3 软骨细胞的分离和鉴定[4~5]
颈椎脱臼法处死大鼠,严格消毒后,剪开膝关节,用11号刀片削取关节表面软骨,放入盛有灭菌PBS的培养皿中,清除表面血污。用PBS冲洗数次后,剪切软骨至1 mm3大小的碎块, 移入无菌培养皿内。加入4 ml 透明质酸酶,室温孵育5 min后倒去液体。重复加入透明质酸酶一次。用PBS冲洗2次,移入离心管中。10 ml的胰酶37 ℃摇床消化30 min, 静置5 min, 弃上清液,用PBS冲洗2次。4 ml 该II型胶原酶37 ℃培养30 min, 去除上清液。再用4 ml 胶原酶液37 ℃恒温振荡180 min,收集上清液,1 000 r/min,离心5 min。最后用PBS冲洗,加入DMEM/F12培养液(含体积分数10%胎牛血清),制成细胞悬液。随机取培养细胞,经胰蛋白酶消化后接种于盖玻片上,贴壁生长后,PBS冲洗,甲醇固定15 min,用10 g/L甲苯胺蓝进行基质异染(pH 2.5),PowerVisionTM两步法进行II型胶原免疫组化染色,取培养好的软骨细胞培养玻片,经体积分数2.5%戊二醛固定, 0.1 mol/L磷酸缓冲液(pH 7.4)冲洗,置体积分数1%锇酸后固定,再用0.1mol/L磷酸缓冲液(pH 7.4)冲洗,然后用各级乙醇逐级脱水,包埋、定位、超薄切片,最后置Philips CM-120型透射电镜下观察并拍照,确定其为软骨细胞。
1.4 NaF细胞受试液的配制和给药
当原代软骨细胞培养至第2代时, 以5×105/皿接种于10 cm2培养皿, 经过24 h细胞贴壁后, 倾去原有培养液, 各组分别加入含有不同实验因子的DMEM/F12培养液(含体积分数10%胎牛血清)。实验共分6组:对照组只加DMEM/F12培养液(含10%胎牛血清);实验组分别另加 6.25 μmol/ml、12.50 μmol/ml、25.00 μmol/ml、50.00 μmol/ml 和 100.00 μmol/ml NaF。每组3个平行样。培养至第6日, 收集细胞培养液用于分析GAG含量, 并对对照组、25.00 μmol/ml、50.00 μmol/ml 和 100.00 μmol/ml 3 个测试组培养细胞爬片固定后做阿利新蓝染色和免疫组化染色,分别观察并分析各受试组差异。
1.5 细胞培养液中GAG含量的测定[6]
用二甲基亚甲蓝(DMB)比色法测定细胞培养液GAG含量: 取100 μl 细胞传代消化液,加入1 ml 20 mmol/L 磷酸钠缓冲液(pH6.8,含30 μg木瓜蛋白酶,1 mmol/L EDTA,2 mmol/L 二硫苏糖醇),于60 ℃消化60 min后,加入20 mmol/L 碘乙酸和50 mmol/LTris/HCl(pH=8.0)各1 ml待测。分别取100 μl不同含量(5~100 mg/L)透明质酸标准溶液,加入2.5 ml DMB显色剂,混匀,反应15 s后,于525 nm波长处比色,测定吸光度,根据标准曲线求得消化液中硫酸GAG的含量(mg/L)。
1.6 阿利新蓝染色和II型胶原免疫组化染色
取培养细胞,胰蛋白酶消化后接种于盖玻片上, 贴壁生长后,PBS冲洗3次, 甲醇固定15 min,用5 g/L阿利新蓝染色[5]; Power VisionTM两步法进行II型胶原免疫组化染色[4], 染色结果的积分评分标准见表1。
1.7 统计方法
采用SPSS 13.0 for windows 软件处理所有数据, 计量资料用± s表示, 显著性差异用t检验, 计数资料用秩和检验, P<0.05为差异有统计学意义。
2 结果
2.1 大鼠软骨细胞的鉴定
2.1.1 甲苯胺兰染色分析 软骨细胞内见蓝色异染颗粒,细胞周围有少量异染颗粒出现(图1)。
2.1.2 II型胶原免疫组化染色分析 软骨细胞胞浆被染成棕黄色,胞核不着色(图2)。
2.1.3 透射电镜分析 细胞核较大, 多为圆形, 形态不规则,核仁边聚,常染色质明显。细胞质胞浆丰富,核糖体、线粒体较多,有丰富的粗面内质网及分泌小泡,泡内为合成的基质成分,胞浆中还可见大量成团的糖原颗粒(图3)。
2.2 NaF对大鼠软骨细胞培养液中GAG含量影响
与对照相比,NaF各处理组GAG含量没有显著性差异(P>0.05)(表 2)。

表 1 Ⅱ型胶原免疫组化染色积分表Table 1 Criteria of histochemical examination of Ⅱtype collagen
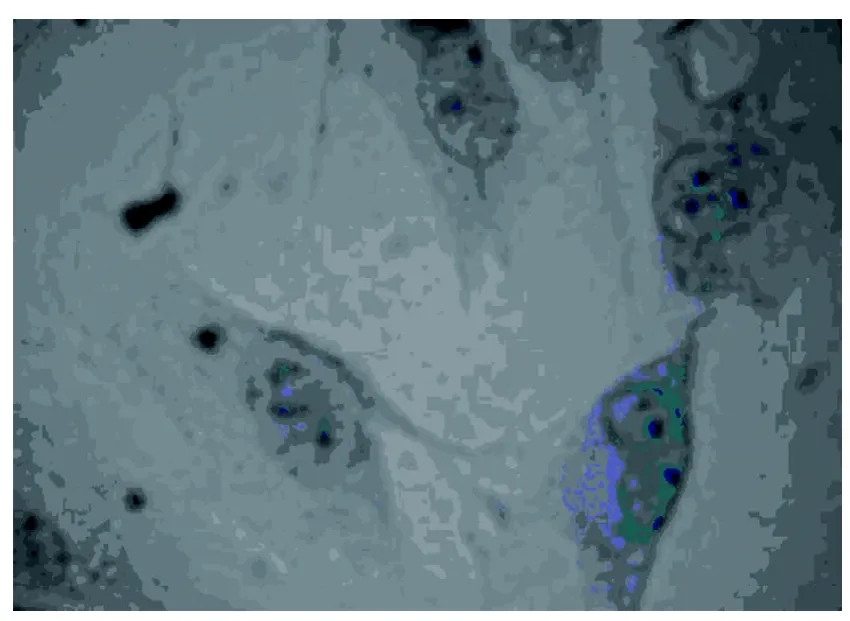
图 1 P2代软骨细胞甲苯胺兰染色(×400)Figure 1 Toluidine blue staining of chondrocytes of P2(×400)

图 2 P2代软骨细胞免疫组化染色(×400)Figure 2 Type II collagen immuno-histochemistry dye of chondrocytes of P2 (×400)

图 3 P2代软骨细胞电镜形态(Bar=1 μm)Figure 3 Photos of PEM of chondrocytes of P2(Bar=1 μm)

表 2 各受试组大鼠软骨细胞培养液中GAG的含量Table 2 GAG content in cell culture medium of chondrocytes of rats
2.3 NaF对大鼠软骨细胞内糖原颗粒的影响
阿利新兰染色显示, 对照组细胞边界清晰,胞质内有少量异染糖原颗粒(图4A)。25.00 μmol/ml、50.00 μmol/ml和 100.00 μmol/ml NaF 受试组软骨细胞数目变多,边界模糊,胞质内的异染糖原颗粒数目与对照相比无明显差异(图4B, C, D)。
2.4 NaF对大鼠软骨细胞II型胶原分泌的影响
免疫组化染色显示, 对照组细胞边界清晰, 细胞周围有少量胶原分泌(-)(图5A)。与对照组相比,25.00 μmol/ml和 50.00 μmol/ml NaF 受试组细胞边界尚清, 数目增多, 细胞周围弥漫着大量的II型胶原染色颗粒(++~+++)(图 5B, C); 100.00 μmol/ml NaF受试组细胞数目减少,形态不规则细胞外的II型胶原染色颗粒也相应开始减少(++++)(图5D)。按表1的评分标准分别对每瓶细胞的细胞爬片染色结果进行评分。每组检查结果的总积分即组中每瓶细胞的细胞爬片染色的检查积分之和(表3)。
3 讨论

图 4 受试组给药后阿利新蓝染色的差异 (×200)Figure 4 Difference of alcian blue eye after treatment (×200)
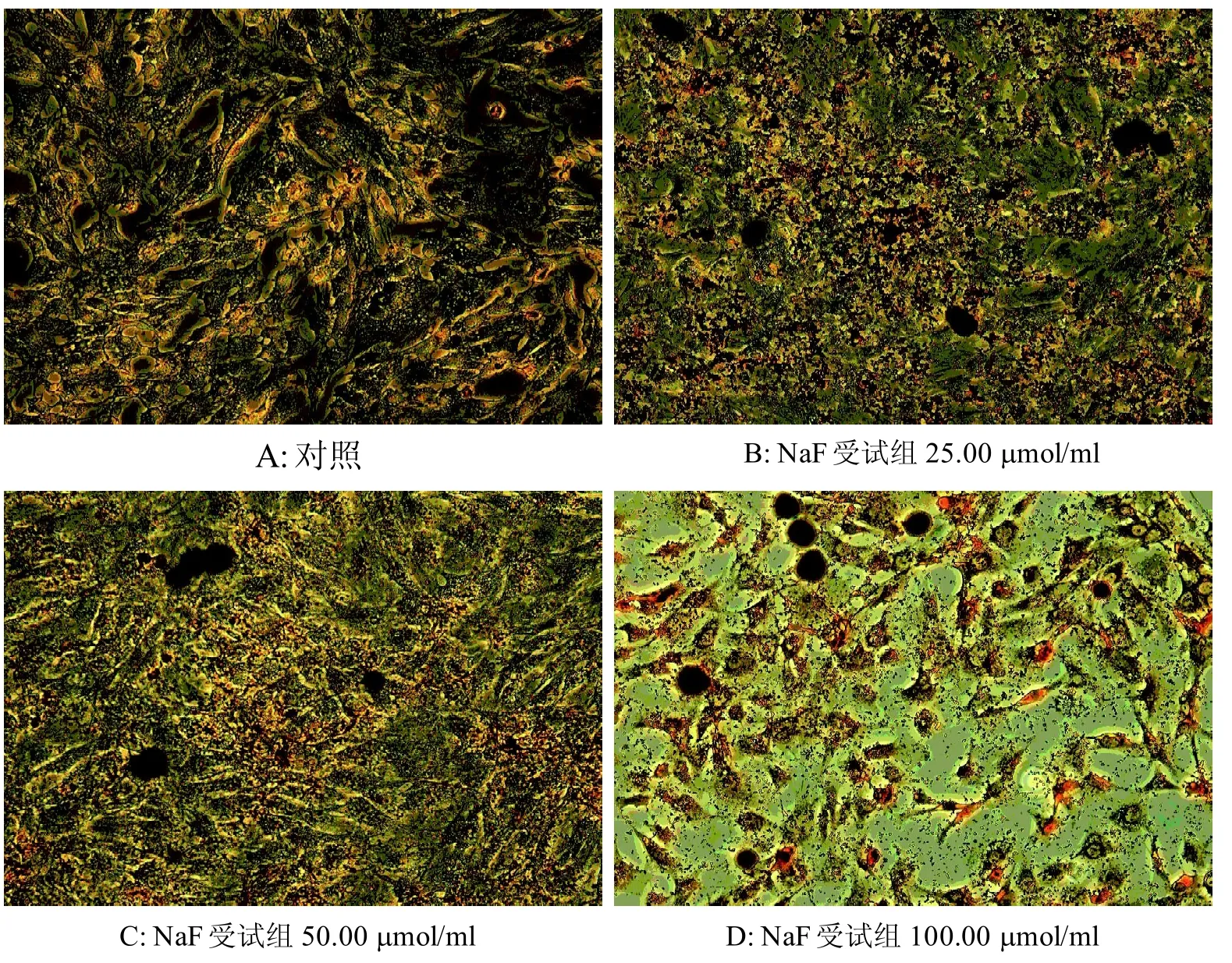
图 5 各受试组给药后II型胶原染色的差异 (×200))Figure 5 Difference of II Type Collagen Immunohistochemistry Dye After Treatment (×200)

表 3 NaF对大鼠软骨细胞周围II型胶原染色颗粒的影响(n=3)Table 3 Effect of secretion of II type collagen of chondrocytes of rat treated by NaF (n=3)
氟是一种人体必需的微量元素,但氟过量摄入后进入机体可成为原生质毒物损害软骨,影响骨骼生长发育。要建立体外实验体系研究氟对软骨细胞的作用,必须选择适合的实验动物作为细胞来源,运用科学的实验方法进行组织细胞分离,获得的软骨细胞必须进行鉴定后方能用于氟化物的毒性研究。本实验选择取材的实验动物,主要考虑该实验动物(SD大鼠)在生物学实验中比较常用,结果具有广泛的代表性,能提供足量的关节软骨细胞,同时也考虑动物遗传背景的一致性和实验结果的可重复性。另外,有研究表明雌性动物发生骨关节炎和骨关节退行性变的易感性较大[7],所以本研究选用雌性SD大鼠分离的软骨细胞。
分离方法综合相关文献, 应用最多的是低质量浓度的胰蛋白酶和II型胶原酶顺序染色消化法。胰蛋白酶对软骨细胞外周基质有较强的消化能力, 可见大部分的蛋白多糖分解; II型胶原酶可将胶元降解成低分子多肽短链物,但胰酶和胶原酶的浓度和作用时间应严格控制,避免造成软骨细胞的损伤[8~9]。关节软骨的表面为一层纤维膜组织,取材时应仔细剥离,可保证分离的细胞单一。本实验观察到,甲苯胺蓝染色时软骨细胞内见蓝色异染颗粒,细胞周围有少量异染颗粒出现; 而II型胶原免疫组化染色时,软骨细胞胞浆被染成棕黄色,胞核不着色。透射电镜分析显示细胞核较大,多为圆形,形态不规则,核仁边聚,常染色质明显。细胞质胞浆丰富,核糖体、线粒体较多,有丰富的粗面内质网及分泌小泡,泡内为合成的基质成分,胞浆中还可见大量成团的糖原颗粒证实了本实验所观察的细胞为软骨细胞。
本研究结果显示,氟浓度对体外培养实验大鼠软骨细胞培养液中的GAG含量各受试组与对照组相比无显著性差异(P>0.05),阿利新兰染色显示氟浓度对大鼠软骨细胞胞质内的异染糖原颗粒也无明显影响。说明氟浓度对体外培养实验大鼠软骨细胞GAG分泌无明显影响,氟骨症的机制可能不是通过影响软骨细胞分泌GAG影响关节功能的。
有报道称,“胶原蛋白是氟化物作用的靶子”[10],胶原蛋白是骨与软骨组织的重要成分之一,而氟是与胶原蛋白代谢有密切关系的微量元素,环境中的氟浓度可引起人与动物骨和软骨胶原蛋白代谢异常。近年研究表明,过量氟可直接损害软骨,引起骺板软骨深层肥大细胞增多; 并可使大鼠软骨基质中可溶性胶原、胶原α1(II)链的分子量降低和尿中羟脯氨酸排泄量增加,表明过量氟可干扰软骨胶原蛋白的代谢[11]。胶原表型对软骨正常结构的维持具有重要的意义,软骨细胞分化的不同时期胶原表型表达不同。其中分化过程中的关节软骨和骺板软骨合成II、VI、IX和XI型胶原,肥大软骨细胞特异性地合成X型胶原以及II型胶原,从软骨细胞肥大后分化至形成类成骨细胞的过程中合成X和I型胶原[12~14]。据此,II型胶原的合成是软骨细胞成骨分化过程中的一个重要阶段, 所以, 对于II型胶原含量的检测可以直接反映NaF对软骨细胞分化的影响。本次研究中II型胶原免疫组化染色结果显示, 随着 NaF 浓度的升高(0~50.00 μmol/ml),软骨细胞周围的II型胶原分泌量开始逐渐增多,但是浓度升至100.00 μmol/ml时,软骨细胞开始死亡,细胞数量开始减少,细胞周围的II型胶原染色颗粒也相应减少。这说明NaF在一定浓度范围内对大鼠软骨细胞的毒性作用符合一般毒性效应规律,NaF致大鼠软骨细胞II型胶原分泌改变作用存在阈值。本实验对过量氟损伤软骨机制进行初步探索, 发现氟浓度对软骨细胞分泌GAG的能力没有显著影响, 而免疫组化染色研究从半定量分析结果显示了氟浓度对软骨细胞胶原分泌量有一定的影响,所以接下来可以继续运用激光共聚焦技术对氟浓度对软骨细胞胶原分泌量以及胶原分型进行进一步的细化研究。
[1] Bely M, Ferenez G. Experimental osteofluorosis and anthrofluorosis in rats[J]. Clin Rheumatol, 1996, 15:529-530.
[2] Meng H, Zhang T, Liu W, et al. Sodium fluoride induces apoptosis through the downregulation of hypoxia-inducible factor-1α in primary cultured rat chondrocytes[J]. Int J Mol Med, 2014, 33(2):351-358.
[3] Nishida T, Kubota S, Aoyama E,et al. Impaired glycolytic metabolism causes chondrocyte hypertrophy-like changes via promotion of phospho-Smad1/5/8 translocation into nucleus[J]. Osteoarthritis Cartilage, 2013, 21(5):700-709.
[4] 司徒镇强, 吴志英. 细胞培养[M]. 西安: 世界图书出版社,1996:187-190.
[5] Chen JT, Liang JB, Chou CL, et al. Glucosamine sulfate inhibits TNF-alpha and IFN-gamma-induced production of ICAM-1 in human retinal pigment epithelial cells in vitro[J]. Invest Ophthalmol Vis Sci, 2006, 47(2):664-672.
[6] Guo X, Wu S, He Y, et al. Effect of subchronic fluoride exposure on pathologic change and beta-catenin expression in rat bone tissue[J]. Wei Sheng Yan Jiu, 2011, 40(3):304-307.
[7] 肖萍, 董妙珠, 叶于薇, 等. 不同月龄豚鼠原发性骨关节炎的病理变化[J]. 环境与职业医学, 2004, 21(6):460-462.
[8] Machoy-Mokrzyńska A. Fluorine as a factor in premature aging[J]. Ann Acad Med Stetin,2004,50 (Suppl 1):9-13.
[9] Claassen H, Cellarius C, Scholz-Ahrens KE, et al. Extracellular matrix changes in knee joint cartilage following bone-active drug treatment[J].Cell Tissue Res, 2006, 324(2):279-289.
[10] 徐鹏, 郭雄. 过量氟化物对软骨损伤的研究进展[J]. 国外医学: 医学地理分册, 2001, 22(1):1-3.
[11] 朴春吉, 侯立中, 杨同书, 等. 过量氟化物对软骨基质胶原蛋白代谢的影响[J]. 中国地方病防治杂志, 1996, 11:75-78.
[12] Stoop R, Buma P, Van der Kraan PM, et al. Type II collagen degradation in articular cartilage fibrillation after anterior cruciate ligament transaction in rats[J]. Osteoarthritis Cartilage,2001, 9:308-315.
[13] Gibson GJ, Verner JJ, Nelson FR, et al. Degradation of the cartilage collagen matrix associated with changes in chondrocytes in osteoathrosis: assessment by loss of background fluorescence and immunodetection of matrix components[J]. J Orthop Res, 2001, 19:33-42.
[14] Yasuhara R, Miyamoto Y, Akaike T, et al.Interleukin-1beta induces death in chondrocyte-like ATDC5 cells through mitochondrial dysfunction and energy depletion in a reactive nitrogen and oxygen species-dependent manner[J].Biochem J, 2005, 389(Pt 2):315-323.
Effects of Excess Fluoride on Secretion of GAG and II Type Collagen in vitro Chondrocytes of Rats
WANG Ning, FAN Yu-lan, SHI Zhi-chong, ZHENG Wei-dong, LU Wei, XIAO Ping
(Department of Toxicology, Shanghai Municipal Center of Disease Control and Prevention, Shanghai 200336, China)
ObjectiveTo observe the effect of secretion of GAG and II type collagen of excess fluoride on in vitro chondrocytes of rats.MethodsChondrocytes of rats was separated from the 2-month old female rats, and cultured in the cell bottles. After identification, six groups were designed in the research including control group and NaF group (6.25 µmol/ml, 12.50 µmol/ml, 25.00 µmol/ml,50.00 µmol/ml and 100.00 µmol/ml). After 6 days of administration, GAG contents were measured.Alcian Blue dye and II type collagen immunohistochemistry dye were also performed on the in vitro chondrocytes of rats.ResultsAfter 6 days of treatment, there were no significant difference of GAG contents of cell culture medium between NaF groups and control group (P>0.05). Alcian Blue dye showed that secretion of GAG content of all groups did not change after administered by NaF. But II type collagen immunohistochemistry dye showed that scores of II type collagen immunohistochemistry dye increased according to dosage of NaF leveled up (P<0.05).ConclusionsNaF may not affect the content of GAG secreted by the chondrocytes of rats in vitro, but can affect the secretion of II type collagen.
NaF; Chondrocytes; GAG; II type collagen
Q95-33
A
1674-5817(2014)02-0120-06
10.3969/j.issn.1674-5817.2014.02.008
2014-01-10
上海市卫生局科研课题(编号: 2007180)
范玉兰(1964-), 女, 副研究员: 研究方向: 卫生毒理学, E-mail: ylfan@scdc.sh.cn
肖 萍, E-mail: pxiao@scdc.sh.cn

