当归新病害
——炭疽病病原鉴定及发病规律研究
卞静,陈泰祥,陈秀蓉*,王涵琦,杨小利,王艳,2
(1.甘肃农业大学草业学院,草业生态系统教育部重点实验室,中-美草地畜牧业可持续发展研究中心,甘肃 兰州730070;2.甘肃中医学院药学系,甘肃 兰州730000)
当归(Angelicasinensis)属伞形科当归属,其干燥的贮藏根是我国一味常用中药材,味苦、辛,性温,药用历史悠久,在方剂中的应用频度甚高,素有“十药九归”之称[1]。由于其药用价值以及保健价值得到了广泛的认可,因此在全国范围内的种植面积逐渐扩大,主产于甘肃、四川、云南等省,陕西、贵州、湖北等省也有生产,尤以甘肃的产量最大,年均种植5400hm2,总产量12000多吨,占全国总产量的70%以上,外销量占全国总销量的90%以上,国内销售量占全国当归总产量的70%以上[2]。
关于当归病害国内报道有腐烂茎线虫(麻口)病、根腐病、褐斑病、菌核病、锈病和白粉病6种[3-7],近年来甘肃省由于种植面积扩大,病害逐年加重,其中当归腐烂茎线虫(麻口)病和根腐病已成为造成当归产量下降,品质变劣的主要因素之一。2012年笔者在甘肃省当归病害调查中发现,在甘肃省定西市渭源县、岷县、漳县等当归种植区,自7月初开始可见,在当归植株的中、下部叶片干枯死亡现象较普遍,根据症状,初步认为可能是当归炭疽病,但查阅资料,未见有关此病的报道。2013年经系统调查发现,8月初以后症状表现明显,发病普遍,如渭源县会川镇发病率约为44%、漳县大草滩约为55%、岷县麻子川约为65%,至9月中旬则均达到100%,但各地不同地块严重程度有差异,因此,笔者对其病害症状、病原特征、生物学特性以及发病规律、传播方式及条件等进行了较系统的研究。本研究仅报道病害症状、病原学鉴定以及发病规律、传播方式及条件等方面的研究,旨意为此病的防治提供理论依据。
1 材料与方法
1.1 试验材料
1.1.1 供试培养基 马铃薯葡萄糖琼脂(PDA)培养基:马铃薯200g,葡萄糖20g,琼脂15g,蒸馏水1000mL,pH自然。
当归汁液培养基:当归叶10g,琼脂15g,蒸馏水1000mL,pH自然。
马铃薯琼脂蔗糖培养基(PSA)培养基:马铃薯200g,蔗糖20g,琼脂15g,蒸馏水1000mL,pH自然。
察氏培养基:NaNO32g、KCl 0.5g、FeSO40.01g、K2HPO 41.0g、MgSO4·7H2O 0.5g、琼脂15g、蔗糖30 g、蒸馏水1000mL。
1.1.2 供试仪器 主要仪器有NIKON光学显微镜,NIKON图像分析系统,BI-2000图像分析系统,Bioneer水平凝胶电泳装置,Bioneer PCR热循环仪,Bioneer凝胶成像系统,Biometra高速冷冻离心机,pHS-3C精密数显酸度计、Apresys温湿度记录仪等。
1.1.3 供试试剂 主要试剂有Rnase,Proteinase K,PCR Master Mix,Marker购于上海生工生物技术公司,通用引物ITS1(5′-TCC GTA GGT GAA CCT GCG G-3′),ITS4(5′-TCC TCC GCT TAT TGA TAT GC-3′)由上海生工生物技术公司合成。
1.2 试验方法
1.2.1 采样时间和方法 于2012年7,8月至2013年7,8月由甘肃省定西市渭源县、漳县、岷县各当归主产区调查发病率和严重度,同时进行症状描述,并采集典型病株,备用。
1.2.2 病原菌分离纯化 采用常规组织分离法,将典型病株茎部切成0.4cm见方小块,用1%的升汞消毒1 min,无菌水冲洗3次,分别置PDA、PSA、察氏和当归汁液平板培养基上,每皿接种5块,置25℃下培养7d后纯化,编号,置4℃保存备用[8]。
1.2.3 致病性测定 当归种子浸泡后,盆栽育苗,待植株长到约20cm高,并长出5个茎秆以上时,进行致病性测定[9-10]。采用针刺法接种,即用针轻轻刺伤健康的当归植株的茎基部,将当归汁液培养基培养的纯菌种,配制成分生孢子浓度为3×106个/mL悬浮液浇灌于刺伤部位,用蘸灭菌水的棉球包在接种部位保湿,同时以刺伤健康植株浇灌无菌水后保湿作为对照,处理与对照均接种10株,保湿24h后,置于室温下,每隔2d观察其发病情况。待发病后对其病株进行镜检和再分离,并计算发病率。
1.3 病原菌的鉴定
1.3.1 病原菌的形态学鉴定 将分别在PDA、PSA、察氏和当归汁液4种平板培养基保存的菌株转接后,置25℃下培养,7d后观察菌落性状,镜检菌丝颜色、分生孢子盘、分生孢子形态,观察是否产生刚毛,测量100个分生孢子及50个分生孢子盘的大小及刚毛的长度,并显微拍照,根据病原形态、大小,查阅相关资料进行病原鉴定[11-12]。
1.3.2 病原菌的rDNA-ITS序列分析 将菌株转接到PDA平板培养基上培养7d后,挑取菌丝块接入PDA液体培养基中,置25℃,120r/min的恒温振荡箱培养7d,用灭菌的纱布过滤后,再用无菌水冲洗2~3次,然后用滤纸吸干水分,保存备用,参考张俊忠[13]的方法提取 DNA。参考相关文献[14-17],选择ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)作为扩增引物,由上海生物公司合成引物。PCR反应在PCR扩增仪上进行,PCR反应体系为50μL,PCR反应条件为:95℃预变性3min,循环1次;95℃变性30s,55℃退火30s,72℃延伸1min,循环30次;最后72℃延伸10min。用1%琼脂糖凝胶电泳对PCR产物进行检测。PCR扩增产物用上海生物公司提供的试剂盒进行纯化,并由其对纯化产物直接测序。将序列与GenBank中相关数据进行同源性分析,并构建系统发育树。
1.4 发病规律研究
1.4.1 侵入途径 盆栽当归苗,选择高约20cm,分支多于5个茎秆的健株用于试验。将纯培养的菌株配成浓度为3×106个/mL的菌悬液,分别采用针刺、灌根和喷雾3种方式进行接种,每处理10株。针刺接种:即用灭菌的细昆虫针在茎基部轻微刺伤,将菌悬液浇灌于刺伤部位,用棉球蘸取无菌水保湿接种部位,同时以针刺茎基部,用无菌水浇灌刺伤部位并保湿的植株作为对照;灌根接种:即直接将菌悬液灌入根部,以无菌水浇灌的植株为对照;喷雾处理:即将菌悬液均匀喷洒于整株植物,并套塑料袋保湿,同时以喷无菌水同样保湿植株为对照,以上处理均保湿24h后置于室温下,观察其发病情况,统计不同接种方式的发病率,确定该病原菌的侵入途径。
1.4.2 田间发病进程 2013年在甘肃省渭源县会川镇新城村唐家滩发病田块进行发病规律调查,自8月11日起,每7d定点调查1次,共调查7次,每次随机调查100株,观察发病进程,统计每株当归植株茎秆的发病率及严重度,计算病情指数。病害分级标准,查阅相关资料[18]制定如下:0级:无病;1级:轻微发病,茎秆上有零星病斑,病斑面积占茎秆表面积的5%以下;3级:轻度发病,病斑面积占茎秆表面积的6%~50%;5级:中等发病,病斑面积占茎秆表面积的50%以上;7级:高度发病,50%以上的茎秆枯死发黑;9级:严重发病,整株枯死,并在茎秆上密生小黑点。

1.4.3 病害与温、湿度的相关性 在发病规律调查田块放置Apresys自记温湿度记录仪,设置每h记录1次田间,自动测定田间小气候温、湿度变化情况,做出日均气温、湿度变化曲线,结合发病率及严重度调查结果进行回归分析[19],作出回归方程,分析病害发生情况与田间温湿度的相关性。
1.5 统计分析
采用Excel 2003和DPS 6.55软件进行统计及方差分析。
2 结果与分析

图1 病害症状Fig.1 Disease of symptoms
2.1 病害症状
2012年至2013年田间调查结果表明,此病一般在6月中、下旬开始发生,8月下旬到9月上旬达到发病高峰,该病害主要危害植株茎秆。如图1所示,发病初期先在植株外部茎秆上出现浅褐色病斑,随后病斑逐渐扩大,形成深褐色长条形病斑,叶片变黄枯死,茎秆从外向内逐渐干枯死亡,后期在病斑上出现黑色小颗粒,即病原菌的分生孢子盘,最后整株枯死。
2.2 致病性测定
挑选典型纯化菌株(编号T1),针刺接种到健康的当归植株20d后,植株均陆续开始发病,而对照未发病(图2a)。镜检茎秆上的小黑点,均为已形成的分生孢子盘,与病株上的分生孢子盘形态一致(图2b,c)。对发病植株进行再分离,获得菌株的培养形状、分生孢子形态与原接种菌株一致,因此可确定该菌株为致病菌。
2.3 病原菌的鉴定
2.3.1 病原菌培养性状 分别在4种培养基上培养,菌落形态及颜色有差异,如图3所示,在PDA、PSA和当归浸汁液培养基菌落生长速度没有明显差异,菌落初期均为白色,后期在PDA上菌落变为黑色,在PSA上菌落变为黑褐色,在当归汁液培养基上菌落则为白色,菌丝稀疏且产生大量灰黑色小颗粒,而在PDA、PSA培养基均未见小颗粒;在察氏培养基上菌落为白色,菌丝稀疏,生长速率明显低于其他3种,也未见小颗粒。镜检培养的组织,在察氏和PDA培养基的组织,仅看到菌丝而未见分生孢子;在PSA培养基上虽能产生孢子但数量很少,未见分生孢子盘;仅在当归浸汁液上镜检到大量的分生孢子,并且产生分生孢子盘,因此,当归浸汁液培养基为病原菌生长的适宜培养基。

图2 致病性测定Fig.2 Results of pathogenicity identification

图3 不同培养基上的菌落形态Fig.3 Colonies on the different media forms

图4 形态学鉴定Fig.4 Results of morphological identification
2.3.2 病原菌形态学特征 镜检和测量当归培养基上的菌丝、分生孢子、分生孢子盘以及刚毛。结果表明,菌丝无色,有隔膜具分枝;分生孢子盘为黑褐色,大小为50~400μm,周围有黑色刚毛,刚毛长度为45~200μm,顶端尖基部宽4~8μm,有0~7个隔膜;分生孢子有2种形态,一种孢子为新月形,两端尖,无色透明,单胞,中间有一个油球,孢子大小为(18.0~24.5)×(3.5~5.0)μm,另一种孢子为卵圆形或椭圆形,无色透明,单胞,孢子大小为(9.7~16.5)×(2.5~4.0)μm(图4)。查阅相关文献资料[17],初步确定该病病原菌为半知菌亚门腔孢纲黑盘孢目炭疽菌属的束状炭疽菌(Colletotrichumdematium,Grove)。
2.3.3 病原菌的rDNA-ITS序列分析 将菌株的PCR扩增产物测序、校对、剪切和拼接,获得全长550 bp序列 (图5)。将序列与GenBank中相关数据进行同源性分析,并构建系统发育树(图6),结果表明,该菌的ITS与已登录的Colletotrichumdematium的ITS同源性均为99%。

图5 PCR电泳检测结果Fig.5 Electrophoresis results of PCR
综合上述形态学和ITS序列鉴定,结果表明,甘肃省当归炭疽病病原菌为束状炭疽菌(Colletotrichum dematium,Grove)。
2.4 发病规律研究
2.4.1 侵入途径 采用3种不同方式接种健株,15d后针刺接种的植株先发病,最初在茎部产生浅褐色病斑,后逐渐扩大形成深褐色条形病斑,叶片逐渐枯死,造成植株干枯死亡,茎部产生小黑点;18d后灌根的植株开始发病,症状与针刺接种的相同;20d后喷雾处理的植株开始发病,但发病率略低于其他两种处理,症状同针刺接种的。30d后统计发病率,结果表明,针刺接种10株全部发病;灌根接种10株,8株发病;喷雾接种10株,5株发病;对照株均未发病(图7)。以上结果说明,该病原菌可通过植物伤口、根部及地上部分自然孔口或直接侵入危害,伤口有利于病原菌的侵入。
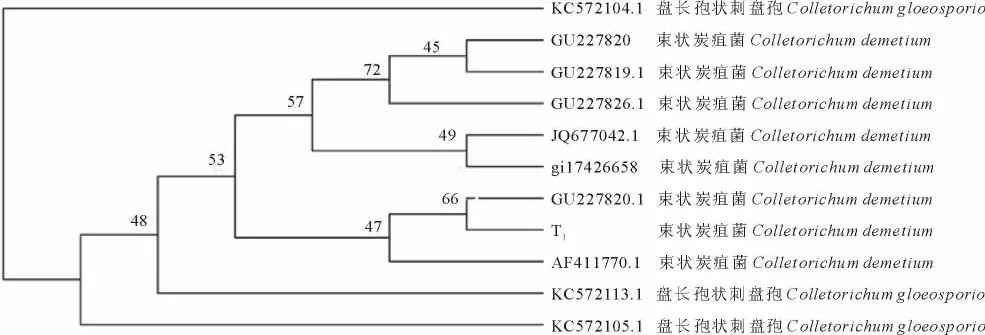
图6 T1菌株的rDNA系统发育树Fig.6 rDNA phylogenetic tree of strain T1

图7 室内盆栽传播方式Fig.7 The mode of transmission of indoor plants
2.4.2 田间发病进程 6月调查时,田间仅有零星发病,但症状不典型,也未见病症,不能确定为炭疽病危害所致。进入8月,出现典型症状后开始进行发病进程调查。由图8可以看出,从6月开始发病到8月11日调查时,田间发病率和病情指数分别为44%和24%,随后发病率稳定增长,9月1日,发病率已高达87%,仅仅20d的时间,发病率增长了43%,到9月15日发病率已达到100%;病情指数在8月11日至8月25日近半个月的时间增长了15%,而从8月25日到9月1日仅仅6d时间,病情指数高达68%,随后病情增加缓慢,9月15日后病情指数不再增加,由此可见,8月11日至9月初是病害普遍发生时期,8月下旬病害严重度显著加重,这与该时间段田间的温湿度有一定的关系。
2.4.3 病害发生与温度、湿度的相关性 经调查,试验地块的日均气温变化见图9,夜间平均气温变化见图10。由图9可见,从8月13日至9月23日测定的43 d中,日均气温为10~27℃,夜间平均气温则为5~15℃。而在8月13日至9月1日中,发病率不断增长时,白天日均气温为16~25℃,有利于病害的发生,与笔者测定病菌生长对温度的要求一致。
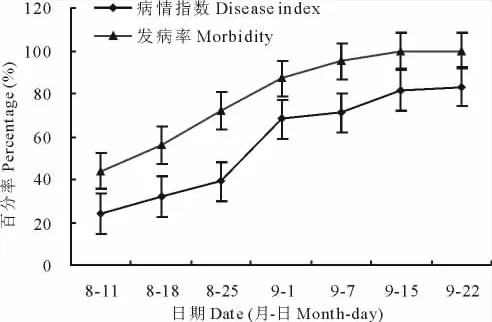
图8 田间发病进程Fig.8 The pathogenesis regularity in the field
经调查,试验地块的日均湿度变化见图11,夜间平均湿度变化见图12。在8月13日至9月23日调查的43d中,日均湿度高于90%的有27d,夜间平均湿度高于95%的共有40d,可见该地区相对湿度普遍高,有利于病害发生,特别是8月25日后,日、夜湿度明显增高,日均湿度为87%~100%,而夜间平均湿度则均高达95%~100%,这与笔者测定的病原菌孢子萌发需要95%以上相对湿度相一致,此时湿度有利于病菌孢子的萌发和生长,加重了危害。

图9 日均气温变化Fig.9 Changes of daily average temperature
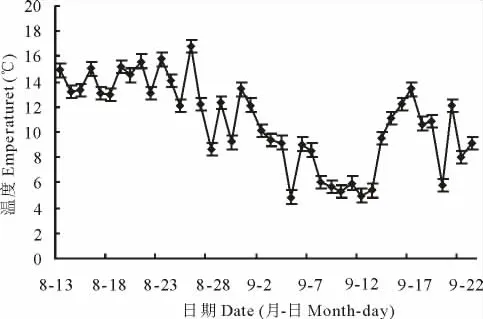
图10 夜间平均气温变化Fig.10 Changes of average temperature at night
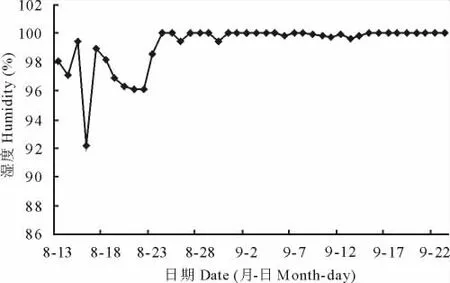
图11 日均湿度变化Fig.11 Changes of daily average humidity
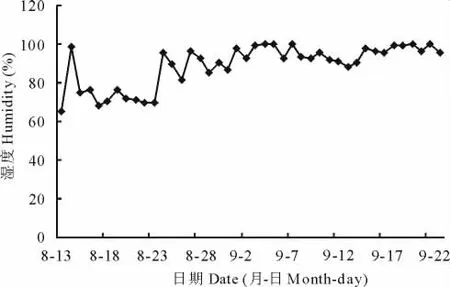
图12 夜间平均湿度变化Fig.12 Changes of average humidity at night
采用DPS 6.55软件对当归炭疽病的病情指数与平均气温、平均相对湿度等进行回归分析。其相关性分别可用以下回归方程表述:Y=2.362X1-1.536,r1=0.907;Y=2.230X2-1.192,r2=0.942。Y=0.629X1+0.746X2-22.976,r=0.986。Y为病情指数;X1为平均气温;X2为平均相对湿度;r1为病情指数与平均气温的相关系数,r2为病情指数与平均相对湿度的相关系数。回归分析表明,田间当归炭疽病的病情指数与平均气温、平均相对湿度之间存在着极显著的相关性。r为平均气温和平均相对湿度同时与病情指数的相关系数,因此从影响程度来看,病情指数受湿度影响大于温度的影响,与室内生物学特性测定相一致。
3 讨论
3.1 当归炭疽病及其病原
查阅相关资料[20-21],当归属植物的炭疽病在国外有报道,分别危害当归属中的白芷(Angelicadahurica)和川姜活(Angelicasylvestris),而当归炭疽病在国内仅有1次简单报道[22],但其病原与本研究不是同一个属,且未进行详细的鉴定及研究,查阅其病原分子序列与Colletotrichumdematium没有相似性,国外则未见报道。因此本研究系首次报道。据报道[23-25],炭疽菌属的成员寄主范围广,它们可寄生或腐生于不同科属植物上,如束状炭疽菌可侵染葡萄(Vitisvinifera)、萝卜(Raphanussativus)、薯芋(Dioscoreagrandifolia)、大丽花(Dahliapinnata)、知母(Dahliapinnata)、枸杞(Lyciumchinense)、玉竹(Polygonatumodratum)、菠菜(Spinaciaoleracea)以及曼陀罗(Daturastramonium)等不同科属植物,引起炭疽病。而Grove[27]报道,束状炭疽菌仅寄生在枯死的茎秆和叶片,但本研究表明,将当归炭疽病菌接种当归健株,引起发病较重,田间调查亦表明,此菌危害当归后,发病普遍且较重,可见此菌的致病性较强,与Grove[27]报道的有差异。另外,杨连娟和徐红[28]报道,束状炭疽菌在PDA上能够产生大量孢子,并且相关资料表明,多种植物的炭疽病菌均可在PDA培养基上生长并产孢[28-31]。而本试验菌株在当归汁液培养基上产生大量孢子且产生分生孢子盘,在PSA培养基上仅能产生少量孢子,而在PDA不产孢。由此可见,本试验的当归炭疽病菌在致病性和生理特性上与其他寄生植物上有差异,此菌能否侵染其他植物,是否有生理分化还有待进一步研究。
3.2 侵入途径
郭彩霞和迟晓红[29]报道,万年青炭疽刺盘孢菌(Colletotrichummontemartinii)接种14d后有伤口的叶片开始发病,17d后没有伤口的叶片也开始发病,室内接种试验比室外早2d。朱桂宁和蔡健和[30]报道山药炭疽病病原菌(Colletotrichumgloeosporioides)也可侵入有伤口和无伤口的叶片。范永山和刘海英[31]等报道,唐山绿宝石炭疽病菌(Colletotrichumgloeosporioides)喷雾接种7d后开始发病。本试验采用针刺、灌根和喷雾3种接种方式均能使健株发病,但针刺造成伤口有利于发病,与上述报道一致。因此,在田间进行农事操作时应尽量避免机械损伤,注意田间防虫,以减少病害危害。灌根接种发病较重,说明该病原菌可以通过土壤带菌,从根部或茎基部侵入。笔者在田间调查发现,重茬地的发病率高,这说明病菌可在田间病残体上或土壤中越冬,造成土壤中病原菌积累,发病加重,因此,建议采取轮作倒茬、精耕细作、深翻土壤、清除带病当归残体等措施。
[1]陈江弘,杨崇仁.当归属植物的研究进展[J].天然产物研究与开发,2004,16(4):359-365.
[2]王琼.浅谈岷县发展以当归为主的中药材产业优势[J].农业科技与信息,2006,(12):42-43.
[3]陆家云.药用植物病害[M].北京:中国农业出版社,1995.
[4]韩金生.中国药用植物病害[M].长春:吉林科学技术出版社,1994:240-243.
[5]宫喜臣.药用植物病虫害防治[M].北京:金盾出版社,2004:226-232.
[6]傅俊范.药用植物病害防治图册[M].沈阳:辽宁科学技术出版社,1999:29.
[7]孔庆岳.北方中药材病虫害防治[M].北京:中国林业出报社,1991.
[8]方中达.植病研究方法[M].北京:中国农业出版社,2001.
[9]许志刚.普通植物病理学4版[M].北京:中国农业出版社,2003:23-25.
[10]姜红霞,杨成德,薛莉,等.甘肃省马铃薯坏疽病鉴定及其病原生物学特性研究[J].草业学报,2013,22(4):123-131.
[11]戴方澜.中国真菌总汇[M].北京:科学技术出版社,1979.
[12]傅俊范.药用植物病理学[M].北京:中国农业出版社,2007.
[13]张俊忠.东祁连山高寒草地土壤真菌多样性研究[J].草业学报,2010,19(2):124-132.
[14]孙广宇,宗兆锋,王建明,等.植物病理学实验技术[M].北京:中国农业出版社,2001:23-29.
[15]董建力,惠红霞,黄丽丽,等.小麦全蚀病抗性鉴定方法的优化及抗源筛选研究[J].西北农林科技大学学报:自然科学版,2009,37(3):158-161.
[16]吕和平,魏晖,漆永红,等.甘肃省嘉峪关市洋葱鳞茎软腐病病原鉴定[J].草业学报,2013,22(8):153-159.
[17]高晓星,满百膺,陈秀蓉,等.东祁连山线叶嵩草内生细菌X4的产吲哚乙酸、解磷、抗菌和耐盐特性研究及分子鉴定[J].草业学报,2013,22(8):137-146.
[18]农业部农药检定所生测室.农药田间药效试验准则(一)[M].北京:中国标准出版社,2000:146.
[19]姚士桐,陆志杰.春季大棚番茄灰霉病发生规律及影响因子分析[J].中国农学通报,2011,27(10):194-198.
[20]Cho W D,Shin H D.List of Plant Diseases in Korea(Fourth edition)[M].Korean Society of Plant Pathology,2004.
[21]Lotz-Winter H,Hofmann T,Kirschner R,etal.Fungi in the botanical garden of the University of Frankfurt[J].Z.Mykol,2011,77:89-122.
[22]黄俊斌,周茂繁,赵纯森.四种药用植物炭疽病的病原鉴定[J].湖北植保,1998,(3):9-11.
[23]郑怀舟.浅谈植物炭疽病[J].生命世界,2002,(3):42-44.
[24]Keisuke Tomiokal.Anthracnose ofPolygnaturnfalcaturncaused byColletotrichumdematium[J].Journal of General Plant Pathology,2008,74(5):402-404.
[25]Sato T,Muta T.Anthracnose of Japanese radish caused byColletotrichumdematium[J].Journal of General Plant Pathology,2005,71(5):380-383.
[26]Washington W S,Irvine G.First record of anthracnose of spinach caused byColletotrichumdematiumin Australia[J].Australasian Plant Pathology,2006,35(1):489-491.
[27]Grove W B.Colletotrichum dematium[J].New or Note Worthy Fungi,1975,56:340-346.
[28]杨连娟,徐红.束状刺盘孢的体外培养条件研究[J].中国真菌学杂志,2007,2(1):20-22.
[29]郭彩霞,迟晓红.万年青炭疽病病原菌分离与鉴定[J].江西植保,2009,32(4):160-163.
[30]朱桂宁,蔡健和.广西山药炭疽病病原菌的鉴定与ITS序列分析[J].植物病理学报,2007,37(6):572-577.
[31]范永山,刘海英.唐山绿宝石炭疽病菌的分离与初步鉴定[J].河北农业大学学报,2005,28(6):64-67.

