去劣疏伐对长白落叶松初级无性系种子园SSR遗传多样性的影响
姚 宇,张含国,张 振,张 磊
(东北林业大学 林木遗传育种国家重点实验室,黑龙江 哈尔滨 150040)
去劣疏伐对长白落叶松初级无性系种子园SSR遗传多样性的影响
姚 宇,张含国,张 振,张 磊
(东北林业大学 林木遗传育种国家重点实验室,黑龙江 哈尔滨 150040)
为了解去劣疏伐对长白落叶松初级无性系种子园遗传多样性的影响程度,利用14对SSR引物,对苇河青山长白落叶松初级无性系种子园内38个无性系,共260个亲本进行遗传多样性的研究。根据子代表现及亲本生长结实的能力,设计10%~60%的疏伐强度进行模拟疏伐,利用POPGENE3.2程序分析疏伐前后各个遗传多样性参数的变化。结果表明:种子园遗传多样性降低程度与疏伐强度呈正相关,40%以内的疏伐强度对种子园遗传多样性影响较小,减小幅度小于0.5%,能够维持种子园较广泛的遗传基础;疏伐后无性系内至少要保留7~9个单株才能维持无性系内的遗传多样性,如按照疏伐后保存率为60%推算,长白落叶松种子园建园时,每个无性系至少种植12~15株。
长白落叶松;种子园;SSR标记;遗传多样性;去劣疏伐
初级种子园的建园繁殖材料是只经过表现型选择的优树,未经过子代测定,而且初植密度一般较大,因此在种子园遗传改良过程中,去劣疏伐是一个重要的管理策略[1-3]。去劣疏伐在提高种子园的遗传增益的同时,对遗传多样性的影响也不容忽视[4]。种子园的遗传多样性是林木稳定性、抗逆性和进化性的基础[5],其群体内总的遗传变异多样性越高及与杂合性相关的个体适应性越强,其林分群体相对越稳定[6]。种子园的遗传多样性是种子园的遗传基础[7],一般来说,在一个有限的种群中,遗传多样性一般会随着种群大小的缩减而减少[8]。有研究表明,去劣疏伐会降低种子园子代群体的遗传多样性[9]。
利用SSR分子标记技术,以黑龙江省苇河青山种子园的长白落叶松初级种子园为研究对象,运用群体遗传学原理,通过对SSR标记多态位点统计与分析,进行去劣疏伐对种子园遗传多样性影响的全面研究,分析不同疏伐强度下遗传多样性的变化,以及探讨无性系内数量和遗传多样性的关系,试图找出最优的去劣疏伐强度和疏伐后各个无性系应保留的单株数量,以维护种子园无性系间以及无性系内的遗传多样性,为营建去劣疏伐种子园或1.5代种子园提供亲本无性系配置及经营管理的理论依据。
1 材料与方法
1.1 试验地点和材料来源
试验地点位于黑龙江省苇河林业局青山种子园,长白落叶松初级无性系种子园始建于1983年4月,分为52个小区,共202个无性系。优树来源均来自绥阳,配置方式为顺序错位法。建园至今,未进行过疏伐。以小区内包含无性系个数多、单株保存率高为原则选择试验地,试验地设在第28小区,该小区面积为0.167了hm2,初植377株,株间距5 m×5 m,实际存活260株,保存率为68.97%,区内含有38个无性系,每个无性系有1~12株,疏伐时株均高17.67 m、冠幅6.2 m左右,无性系内的雌性球花的花期同步性较好。由于小区内存活的单株分布不均,大部分植株下部1/4左右冠层有交叠的现象。第28小区所含的38个无性系中有25个无性系有子代测定林,每个无性系的子代有3~34株,共325株。
该试验采集第28小区疏伐前所有单株的当年生(2011.6)嫩叶,每个单株的嫩叶分别置于保鲜袋中,按单株的位置编号,贮于-20℃冰箱备用。
1.2 疏伐设计
对第28小区所含的38个无性系的子代测定林进行每木检尺,同时调查第28小区所有亲本(260株)的生长情况。根据调查情况,将亲本无性系分为7类,有子代测定林的无性系中,高于平均子代材积20%以上的无性系为A类,高于平均子代材积20%以内的无性系为B类,低于平均子代材积20%以内的无性系为C类,低于平均子代材积20%以上的无性系为D类;无子代测定林的无性系中,平均材积高于亲本平均材积的无性系为E类,低于平均亲本材积20%以内的无性系为F类,低于平均亲本材积20%以上的无性系为G类。
总的疏伐原则为:(1)A类的无性系全部保留;(2)B类的无性系部分疏伐;(3)C、D类的无性系重点疏伐;(4)E类的无性系全部保留;(5)F、G类的无性系,根据亲本平均生长情况选择疏伐;(6)每个无性系内,伐除材积小、不通直、侧枝细、结实差的无性系,同时考虑位置。
根据子代表现以及母树生长结实情况设计疏伐:(1)10%~60%的疏伐强度,预计模拟疏伐后分别保留234株(38个无性系)、208株(36个无性系)、182株(34个无性系)、156株(32个无性系)、130株(30个无性系)、104株(28个无性系),用于不同疏伐强度对遗传多样性影响的分析;(2)从A、B、C、D中,分别选取单株数量最多的1个无性系,每一个无性系根据亲本生长结实情况设计去劣疏伐,每个无性系每次伐除1株,直到剩下1株,用作无性系内单株数量和遗传多样性的关系分析。
1.3 总DNA的提取与SSR-PCR扩增
采用针对落叶松改良的CTAB法[10]提取DNA,0.8%的琼脂糖凝胶和紫外检测进行DNA浓度与纯度的测定。
SSR-PCR的反应体系:模板DNA50 ng,20µmol·L-1上游引物 2.0 µL,5 µmol·L-1下游引物2.0 µL,2.0 mmol·L-1dNTP(Ta Ka Ra)1.6 µL,10×Taq Buffer 2.0 µL,25 mmol·L-1MgCl22.2µL,5 µ·µL-1Taq DNA 聚 合 酶(Fermentas)0.2µL。PCR扩增反应程序为:94℃预变性5 min;94℃变性 30 s,60℃退火 30 s,72℃延伸 30 s,35个循环;最后72℃延伸7 min。反应在System 9700(Gene Amp)扩增仪上进行。
PCR产物混合等体积的上样缓冲液,94℃变性10 min后用8%的聚丙烯酰胺凝胶电泳分离片段,银染拍照并统计结果。
1.4 引物筛选
本研究应用的SSR引物均从已公开的针对落叶松的SSR引物[11-13],共合成214对SSR引物进行初筛选,选出多态性高且稳定的SSR引物14对(见表1),引物Y14 的部分样品扩增结果见图1。
1.5 数据分析
采用人工读带法,根据条带的迁移对其进行判读,采用A,B,C,D,……记录电泳条带。利用软件POPGENE32计算疏伐前后的遗传多样性,分析的参数有:等位基因数(A)、有效等位基因数(Ne)、Shannon多样性指数(I)、Nei's基因多样度指数(H)、期望杂合度(He)。
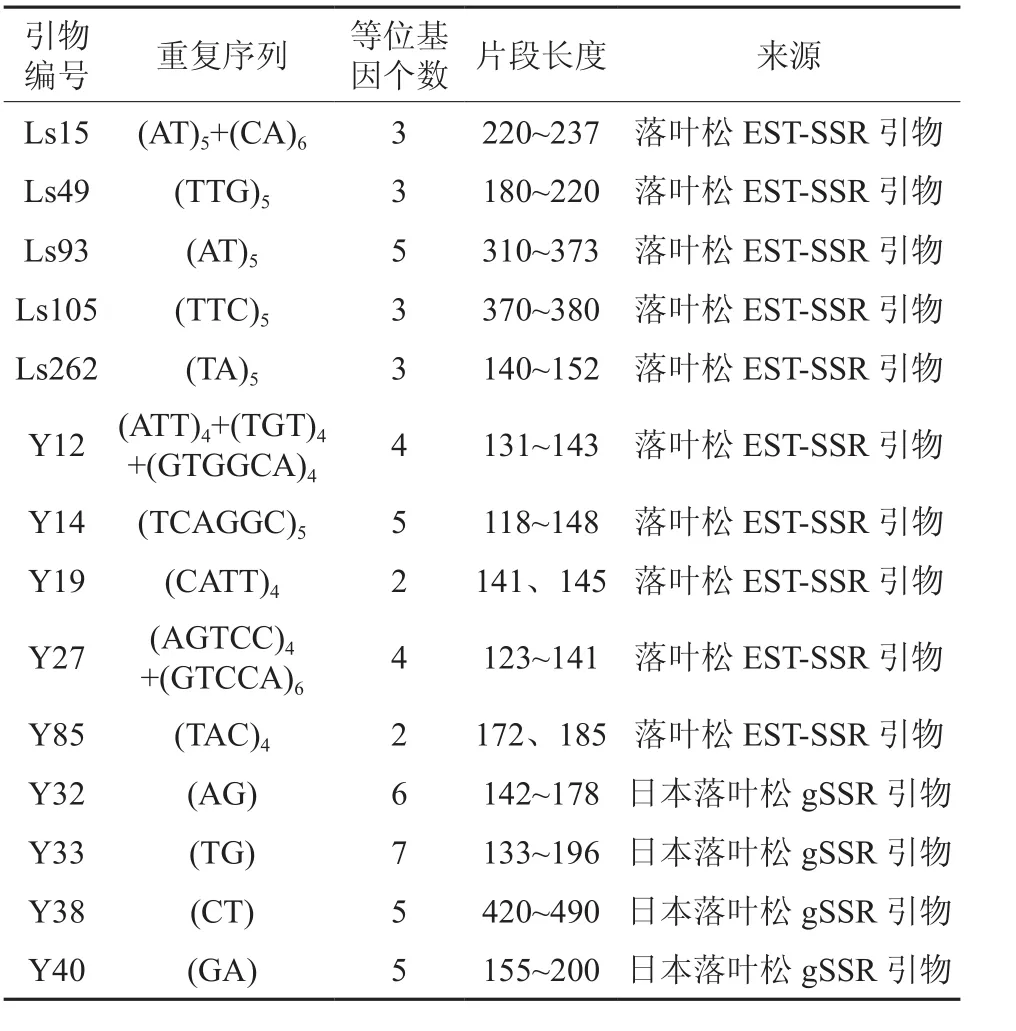
表1 14对SSR引物特征Table 1 Characteristics of 14 SSR primer pairs
2 结果与分析
2.1 疏伐方式与结果
根据子代测定及母树生长结实情况,同时考虑母树位置,依据疏伐设计,模拟疏伐,不同疏伐强度设计下各个无性系保留数量情况见表2。具体疏伐情况如下:
10%强度疏伐中,A、B类中的无性系全部保留;C类中的无性系,每个无性系保留8株左右;D类的无性系,每个无性系保留7株左右;E类的无性系全部保留;F、G类的无性系,每个无性系保留8株左右。
20%强度疏伐中,A类中的无性系全部保留;B类中的无性系,每个无性系保留9株左右;C类中的无性系,每个无性系保留7株左右;D类中的无性系,每个无性系保留4株左右;E类中的无性系全部保留;F、G类的无性系保留7株左右,其中438号、264号全部伐除。
30%强度疏伐中,A类中的无性系全部保留;B类中的无性系,每个无性系保留8株左右;C类中的无性系,每个无性系保留6株左右;D类中的无性系,每个无性系保留3株左右,其中474号全部伐除;E类中的无性系全部保留;F、G类的无性系保留5株左右,其中438号、264号、471号全部伐除。
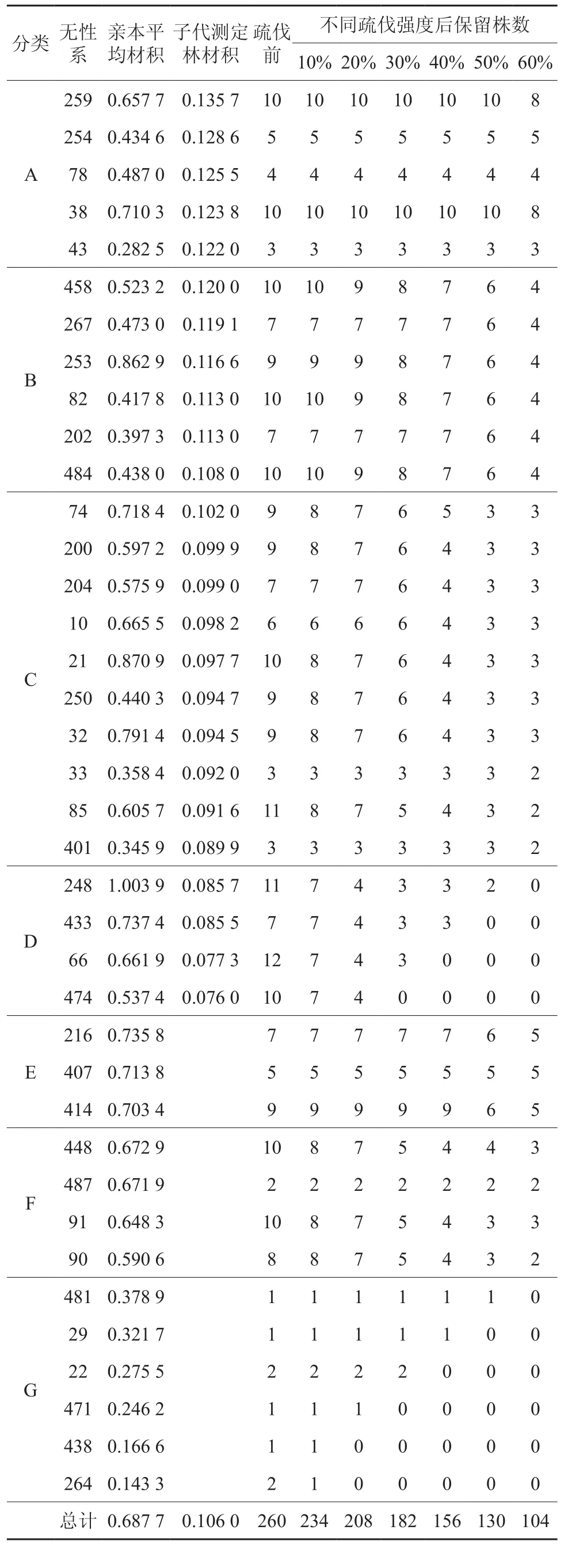
表2 不同疏伐设计下各个无性系保留单株数量情况Table 2 Numbers of reserved clones by different thinning designs
40%强度疏伐中,A类中的无性系全部保留;B类中的无性系,每个无性系保留7株左右;C类中的无性系,每个无性系保留5株左右;D类中的无性系,每个无性系保留3株左右,其中474号、66号全部伐除;E类中的无性系全部保留;F、G类的无性系保留4株左右,其中438号、264号、471号、22号全部伐除。
50%强度疏伐中,A类中的无性系全部保留;B类中的无性系,每个无性系保留6株左右;C类中的无性系,每个无性系保留3株左右;D类中的无性系,每个无性系保留2株左右,其中474号、66号、433号全部伐除;E类中的无性系,每个无性系保留6株;F、G类的无性系保留3株左右,其中438号、264号、471号、22号、29号全部伐除。
60%强度疏伐中,A类中的无性系,每个无性系保留8株;B类中的无性系,每个无性系保留4株左右;C类中的无性系,每个无性系保留2株左右;D类中的无性系全部伐除;E类中的无性系,每个无性系保留5株;F类的无性系,每个无性系保留3株左右;G类的无性系全部疏伐。
无性系内的伐除对象首先考虑不结实或者结实差的无性系,其次是亲本材积小的无性系,同时考虑无性系单株的位置。
2.2 不同的疏伐强度对种子园遗传多样性的影响
利用筛选出的14对多态性引物对种子园所有38个无性系共260个单株的DNA进行扩增,检测到2~7个等位基因,观察等位基因数(A)均为4.071 4个,有效等位基因数(Ne)为2.325 8。Shannon多样性指数和Nei's多样度分别为0.980 5和0.513 6,说明长白落叶松初级种子园育种亲本疏伐前具备丰富的遗传基础。亲本群体平均期望杂合度(He)为0.514 6,说明种子园亲本群体中杂合单株较多,纯合单株较少(见表3)。
根据疏伐原则,设计10%~60%强度的模拟疏伐,模拟疏伐后,观察等位基因数没有随着疏伐强度的提高而下降,一直为4.071 4。有效等位基因数(Ne)疏伐前为2.325 8,在10%~40%疏伐强度范围内随着疏伐强度的增大而缓慢减少,分别为2.322 1、2.320 9、2.315 9、2.314 3,减小幅度在0.5%范围内;50%疏伐强度时,Ne减小幅度明显,为2.265 1,降低2.61%;60%疏伐强度时,Ne为2.249 8,减低3.27%。Shannon多样性指数(I)呈缓慢曲线下降趋势,疏伐前为0.980 5,10%~60%的疏伐强度疏伐后,分别降为0.977 7、0.977 6、0.972 9、0.968 6、0.953 6、0.938 3。期望杂合度(He)呈缓慢下降的趋势,疏伐前为0.514 6,10%~40%强度疏伐后分别降为0.512 4、0.512 0、0.508 5、0.507 1,但仍保持种子园内杂合单株较多,50%~60%强度疏伐后,He为0.4997、0.492 1,说明种子园内纯合单株多于杂合单株。平均Nei's基因多样度(H)也呈缓慢下降的趋势,疏伐前为0.513 6,10%~60%强度模拟疏伐后分别降为0.511 4、0.510 8、0.507 1、0.505 5、0.497 8、0.489 7。
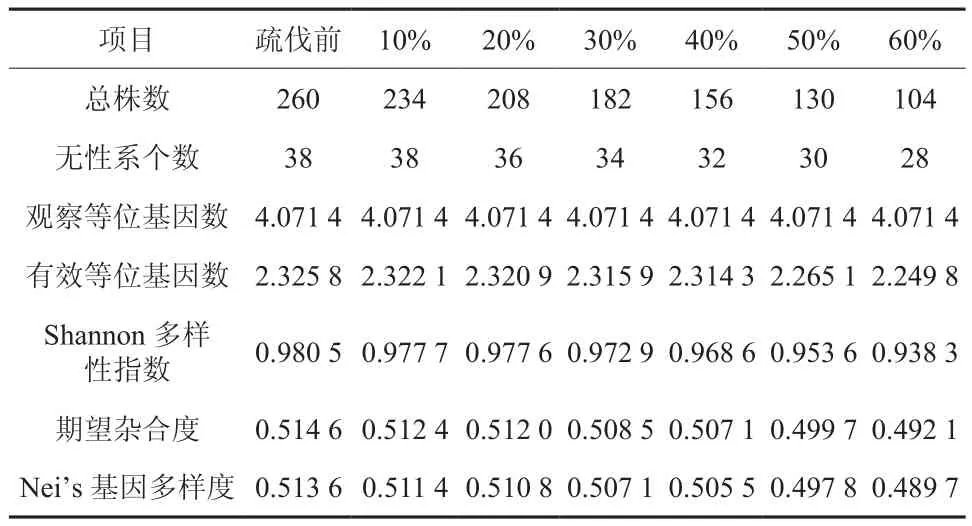
表3 不同疏伐强度的遗传多样性的比较Table 3 Comparison of genetic diversity in seed orchard with different thinning intensities
2.3 无性系内数量对遗传多样性的影响
根据母树调查结果,从A、B、C、D类无性系中分别选取38号无性系(10株)、484号无性系(12株)、85号无性系(11株)、248号无性系(10株)。
如图2所示,4个无性系的观察等位基因数均随着无性系内数量的减少而减低,38号无性系的观察等位基因为3.000 0~1.500 0,66号无性系的观察等位基因数为3.142 9到1.500 0,85号无性系观察等位基因数为3.000 0到1.500 0,484号无性系观察等位基因数为3.000 0到1.571 4,伐后无性系内数量分别降低到6株、7株、7株、7株以下时,降幅增大。
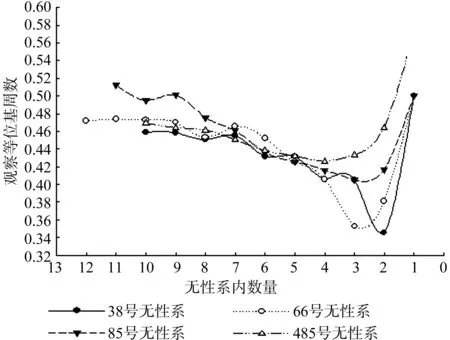
图2 观察等位基因和无性系内数量的关系Fig.2 Relation between observative alleles and trees in clone
如图3所示,无性系内数量对有效等位基因也产生很大的影响,无性系内数量和该无性系有效等位基因数呈正相关,38号无性系的有效等位基因数从1.972 1降到1.500 0,66号无性系的有效等位基因数从2.050 8降到1.500 0,85号无性系的有效等位基因数从2.080 4降到1.500 0,484号无性系的有效等位基因数从2.048 7降到1.571 4。伐后无性系内数量分别降低到7株、9株、9株、7株以下时,降幅增大。
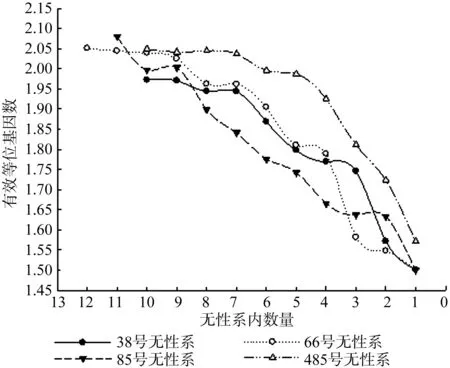
图3 有效等位基因与无性系内数量的关系Fig.3 Relationp between effective alleles and trees clone
如图4所示,当无性系内数量在3株以上时,各个无性系内的期望杂合度随着无性系内的减少而逐渐减少,3株以下呈上升趋势。32号无性系的期望杂合度分别为0.459 0、0.458 5、0.450 6、0.455 3、0.431 8、0.431 7、0.405 6、0.404 8、0.345 2、0.500 0,66号无性系的期望杂合度分别为0.472 0、0.473 7、0.472 9、0.470 1、0.453 0、0.465 5、0.452 4、0.425 4、0.405 6、0.352 4、0.381 0、0.500 0,85号无性系的期望杂合度分别为0.512 7、0.495 1、0.500 9、0.475 6、0.460 8、0.436 1、0.425 4、0.415 8、0.404 8、0.416 7、0.500 0,484号 无 性系的期望杂合度分别为0.469 5、0.464 1、0.461 3、0.450 5、0.438 3、0.431 7、0.426 0、0.433 3、0.464 3、0.571 4。
如图5所示,无性系Shannon多样性指数随着该无性系内数量的减少而降低,32号无性系的Shannon多样性指数从0.751 7下降到0.346 6,66号无性系的Shannon多样性指数从0.796 7降到0.346 6,85号无性系的Shannon多样性指数从0.823 7降到0.346 6,484号无性系的Shannon多样性指数从0.779 9降到0.396 1。伐后无性系数量分别降低到7株、9株、7株、7株以下时,降幅增大。
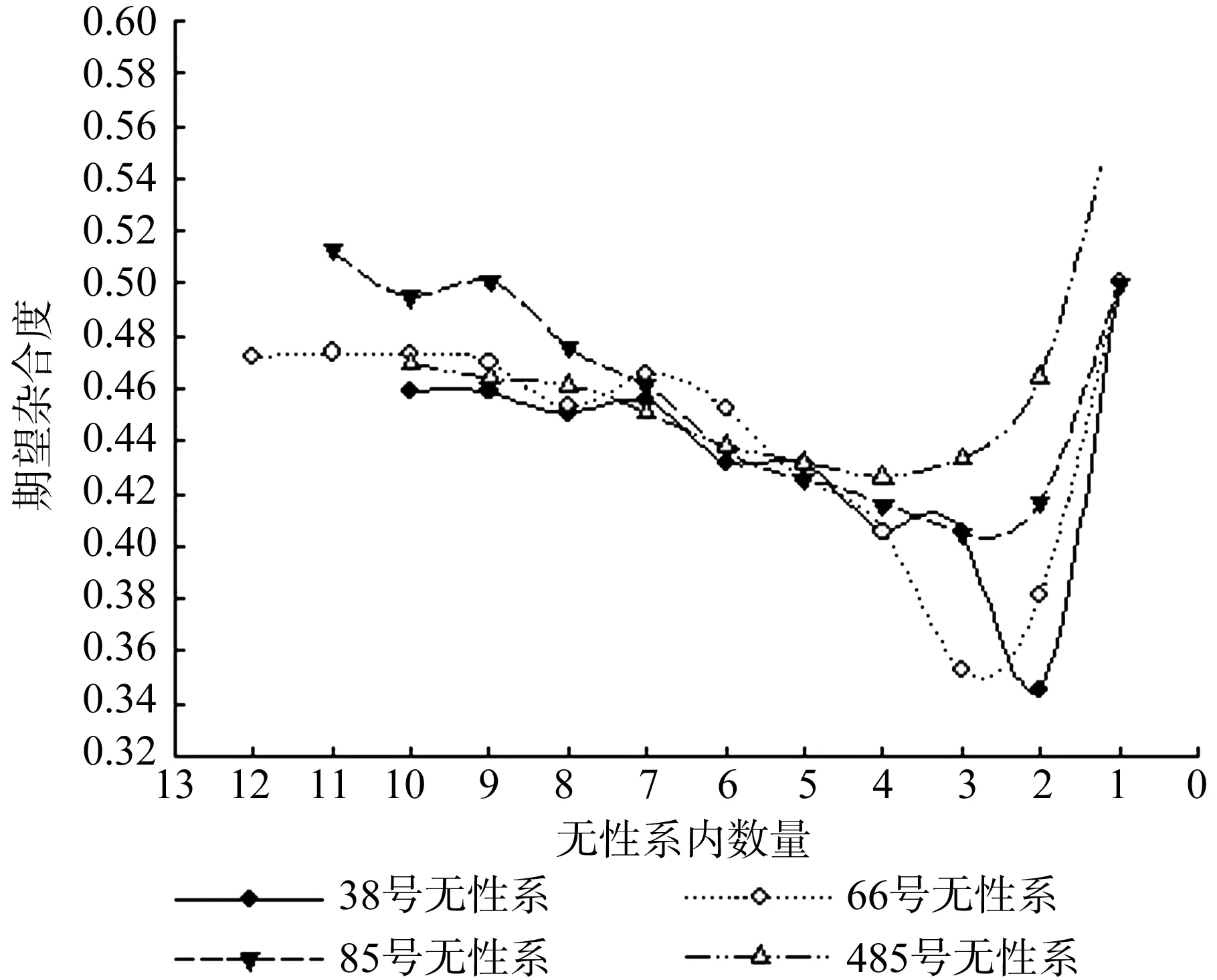
图4 期望杂合度与无性系内数量的关系Fig.4 Relation between expected heterozygosity and trees in clone
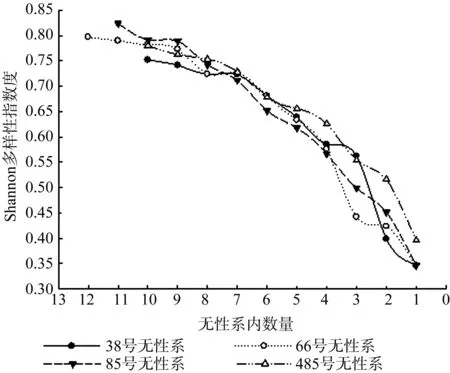
图5 Shannon多样性指数与无性系内数量的关系Fig.5 Relation between Shannon Index and trees in clone
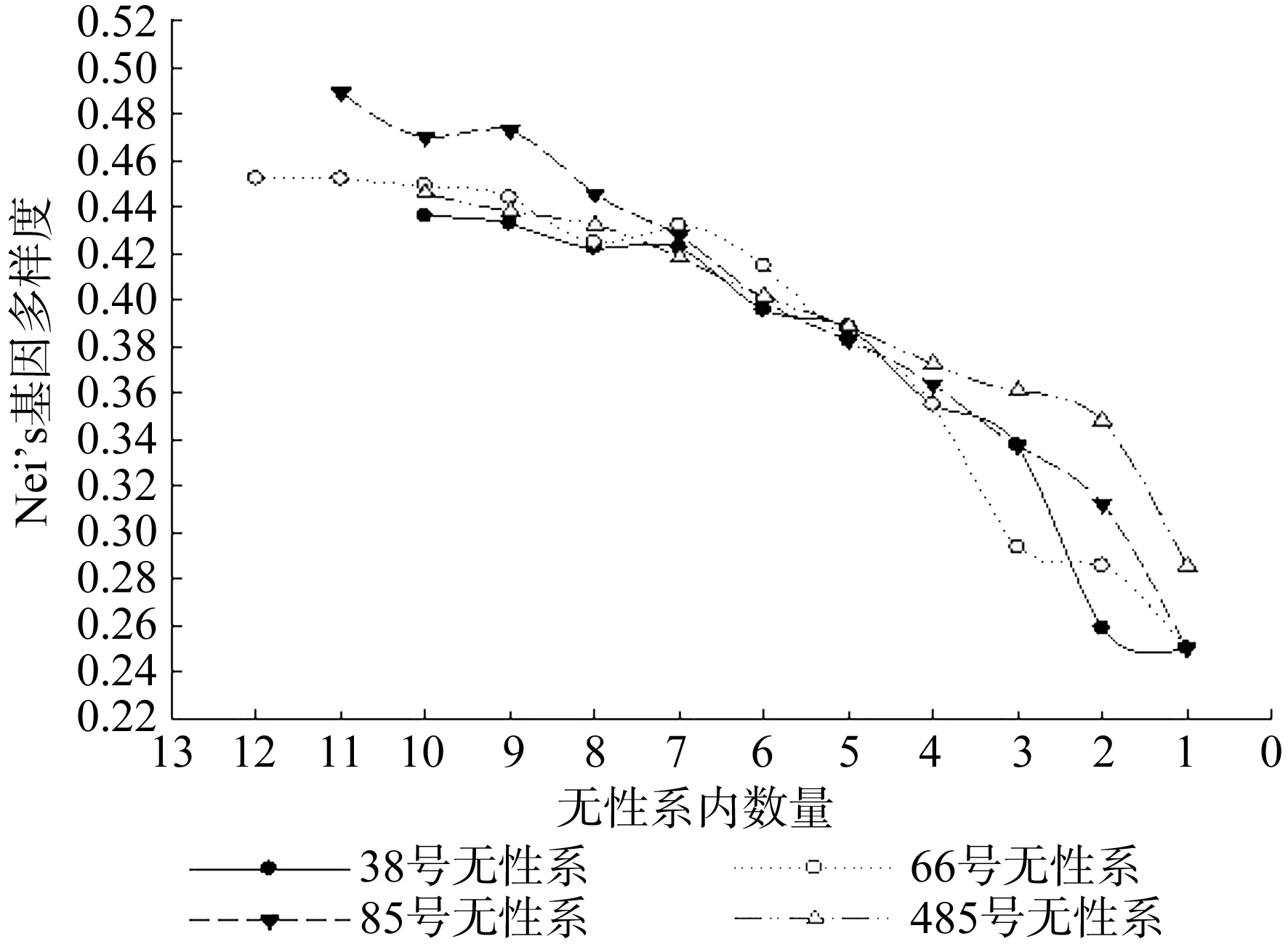
图6 Nei’s基因多样度与无性系内数量的关系Fig.6 Relation between Nei’s gene diversity and trees in clone
如图6所示,无性系内Nei's基因多样度也随着无性系内数量的减少而减低。32号无性系的Nei's基因多样度为0.436 1~0.250 0,66号无性系的Nei's基因多样度为0.452 4~0.250 0,85号无性系的Nei's基因多样度为0.489 4~0.250 0,484号无性系的Nei's基因多样度为0.446 1~0.285 7。伐后无性系数量分别降低到7株、7株、9株、7株以下时,降幅增大。
3 结论与讨论
本研究分析结果表明长白落叶松初级无性系种子园依据无性系的子代表现及亲本生长结实能力对其实施去劣疏伐,在一定程度上减少种子园的遗传多样性,而且种子园遗传多样性降低程度与疏伐强度呈正相关。小于40%疏伐强度的疏伐,有效等位基因与疏伐前基本一致,降幅小于0.5%,期望杂合度在0.5以上,说明能维持种子园亲本较高的杂合度,而50%、60%的疏伐强度,有效等位基因数降幅增大,分别下降了2.61%、3.27%,期望杂合度下降到0.5以下,因此,建议长白落叶松初级无性系种子园疏伐强度在40%疏伐强度以内。
无性系内观察等位基因、有效等位基因、Shannon多样性指数、Nei's基因多样度总趋势都是随着无性系内数量的减少而减少,但当到某一点后,下降的趋势明显增大,这拐点一般在7~9株之间。综上分析,去劣疏伐后每个无性系至少应保留7~9株,以维持无性系内的遗传多样性。如按照疏伐后保存率为60%推算,长白落叶松种子园建园时,每个无性系至少种植12~15株。
松科其他树种有去劣疏伐对种子园遗传多样性影响的报道,油松种子园进行1/3强度去劣疏伐后,以疏伐前(1993年)和疏伐后不连续2年(1996、2000年)的油松种子为试验材料,表明每个位点的平均等位基因数减少7%和17%,多态位点百分率下降20%和17%[9],反映了去劣疏伐对油松种子园子代遗传多样性影响。美国白松两个250年生天然林经3/4强度疏伐后,检测到的等位基因数都减少了约25%,多态位点百分率降低了33%,由于疏伐造成两个林分各约40%的低频等位基因和80%的稀有等位基因丢失[14]。 Lindgren[15]、Kyu-Suk Kang[16]、陈建中[17]采用状态数的方法,分析表明去劣疏伐在增加种子园的遗传增益的同时,降低了种子园育种群体的遗传多样性。
本研究是基于长白落叶松初级无性系种子园的一个小区的全部亲本单株模拟疏伐前后的调查统计结果,避免了抽样调查对实验结果产生的误差,真实地反映了不同疏伐强度及无性系内不同数量对该种子园生产小区遗传多样性的影响。同时,有利今后关于该种子园小区子代遗传多样性、园内交配系统的对比研究,探索亲本遗传多样性与子代遗传多样性的关系。
以往的去劣疏伐侧重获得较高的遗传增益,在未来的种子园发展中将会更加重视遗传增益和遗传多样性之间的平衡,种子园内各个家系或者无性系内数量的不同,能更好地维持这种平衡。在制定种子园去劣疏伐的策略时,家系或无性系间的亲缘关系以及家系或无性系的子代表现也应是需要考虑的内容[18-21]。
[1] Davis A S,Jacobs D F.Quantifying root system quality of nursery seedlings and relationship to outplanting performance[J].New Forests, 2005, 30(2-3):295-311.
[2] Lindgren D, El-Kassaky Y A. Genetic consequences of combining selective cone harvesting and genetic thinning in clonal seed orchard [J]. Silvae Genetica, 1989,38(2):65-70.
[3] Mc Kinley C R, Cunningham M W. Theoretical effects of seedorchard roguing on selfing and percent filled seeds[J].Canadian Journalof Forestry Research, 1983,1(13):187-190.
[4] Pickens K A, Affolter J M, Wetzstein H Y. Enhanced seed germination and seedling growth of Tillandsia Eizii in vitro[J].HortScience, 2003,38(1):101-104.
[5] Fogal W H, Larocque G R, Lopushanski S M. Nutritional and sexual responses of jack pine to ammonium nitrate and gibberellins[J].Forest Science,1999,45(1):136-153.
[6] Gao L, Ge S, Hong D. Study on population genetic structure of Oryza meyeriana (Zoll.Et Mor.ex Steud.) Baill.from Yunnan and its in situ conservation signif i cance[J]. Science in China Series C Life Sciences,1999,42(1):102-108.
[7] Nikkanen. Making a thinning plan for seed orchards using a computer program[J].Folia Forestry,1987,701: 26.
[8] Frankel O H,Soule M E.Conservation and Evolution[M].Cambridge: Cam-bridge University Press,1981:124-136.
[9] 张冬梅,李 悦,沈熙环,等.去劣疏伐对油松种子园交配系统及遗传多样性影响的研究[J].植物生态学报,2001,25(4):483-487.
[10] 贯春雨,张含国,张 磊,等.落叶松杂种F1代群体遗传多样性的RAPD,SSR分析[J]. 经济林研究,2010,28(4):8-14.
[11] 贯春雨,张含国,张 磊,等.基于松科树种EST序列的落叶松SSR引物开发[J].东北林业大学学报,2011,39(1):20-23.
[12] 杨秀艳,孙晓梅,张守攻,等.日本落叶松EST-SSR标记开发及二代优树遗传多样性分析[J].林业科学,2011,47(11):52-58.
[13] 张新叶,白石进,黄敏仁.日本落叶松群体的叶绿体SSR分析 [J].遗传 ,2004,26(4):486-490.
[14] Buchert G P, O P Rajora, J V Hood B P. Dancik.Effect of harvesting on genetic diversity in old-growth eastern white pine in Ontario,Canada[J].Conservation Biology,1997,11:747-758.
[15] Finnvid Prescher, Dag Lindgren, et al. Genetic thinning of clonal seed orchard using linear deployment may improve both gain and diversity[J]. Forest Ecology and Manaement,2008,254:188-192.
[16] Kyu-Suk Kang, Yousry A, El-Kassaby, et al. Genetic gain and diversity under different thinning scenarios in a breeding seed orchard of Quercus accutissima[J]. Forest Ecology and Management, 2005,212 :405-410.
[17] 陈建中.基于状态数分析的种子园遗传管理策略与发展策略研究[D].北京:北京林业大学,2006.
[18] Reynolds S, El-Kassaby Y A. Parental balance in Douglas-fir seed orchards-cone crop versus seed crop[J]. Silvae Genet, 1990,39: 40-42.
[19] Roberds J H, Friedman S T, et al. Effective number of pollen parents in clonal seed orchards[J]. Theor.Appl.Genet.,1991, 82:313-320.
[20] Kang K S, Lindgren D. Prediction of genetic gain and gene diversity in seed orchard crops under alternative management strategies[J].Theor.Appl.Genet., 2001,103 (6-7):1099-1107.
[21] El-Kassaby Y A, Cook C. Female reproductive energy and reproductive success in a Douglas- fi r seed orchard and its impact on genetic diversity[J]. Silvae Genet, 1994,43:243-246.
Effects of rogue thinning on genetic diversity by SSR in a Larix olgensis clone seed orchard
YAO Yu, ZHANG Han-guo, ZHANG Zhen, ZHANG Lei
(State Key Lab. of Tree Genetics and Breeding, Northeast Forestry University, Harbin 150040, Heilongjiang, China)
To fi nd out the changes of genetic diversity in the Larix olgensis Henry elementary clone seed orchard after rogue thinning, the genetic diversity of 38 L. olgensis clones (260 individuals) in Qingshan orchard were studied by using 14 pairs SSR primers. According to the individuals’ ability of growth, bearing and their progeny, the simulation thinning activities with intensity from 10% to 60% were conducted, and the changes of genetic diversity parameters before and after thinning were analyzed by POPGENE3.2. The results show that the reduction level of genetic diversity was positive correlation with the thinning intensity, the thinning intensity less than 40%affected genetic diversity of clones slightly (reduction was less than 0.5%) and can maintain the orchard’s broad base of genetic. If the genetic diversity of one clone is preserved, at least 7~9 individuals need to be reserved, in accordance with the preservation rate of 60%after thinning, at the beginning of building a L. olgensis orchard, each L. olgensis clone needs to consist of more than 12~15 individuals.
Larix olgensis Henry; seed orchard; SSR makers; genetic diversity; rogue thinning
S791.229;S722.8+3
A
1673-923X(2013)03-0040-07
2012-12-10
科技部基础专项“东北林木良种基地种质资源现状调查”(2007FY110400-3)
姚 宇(1988-),女,辽宁鞍山人,硕士研究生,主要从事林木遗传多样性研究
张含国(1962-),男,黑龙江哈尔滨人,教授,博士,从事林木遗传改良等研究;E-mail:hanguozhang1@yahoo.com.cn
[本文编校:谢荣秀]

