桉树内生真菌对铝毒害胁迫下尾巨桉幼苗抗性特征的影响
谢安强,洪 伟,吴承祯,林勇明,陈 灿
(1.福建农林大学 森林生态研究所,福建 福州 350002;2.福建省高校森林生态系统过程与经营重点实验室,福建 福州 350002)
桉树内生真菌对铝毒害胁迫下尾巨桉幼苗抗性特征的影响
谢安强,洪 伟,吴承祯,林勇明,陈 灿
(1.福建农林大学 森林生态研究所,福建 福州 350002;2.福建省高校森林生态系统过程与经营重点实验室,福建 福州 350002)
通过菌液浸泡的方法接种10株内生菌于尾巨桉幼苗,随之将幼苗进行铝胁迫试验,胁迫处理10d后,测量植株叶绿素含量、植株鲜重和植株Al含量。处理A、E和D的总叶绿素含量增加44.78%、38.81%和34.33%。处理D、A和E的铝含量分别减少74.52%、66.24%和54.14%。处理A、E和D的生物量增加43.05%、41.67%和34.72%。菌种A、D、E具有较强的提高植株铝胁迫抗性的能力,可以尝试进行推广试验。
桉树;尾巨桉;真菌;抗性特征;叶绿素;生物量
我国酸性土壤占耕地面积的21%,在酸性条件下,土壤中的铝以活性铝的形式存在。铝不是植株生长所需要的必需元素,在微量条件下铝元素可能会刺激植株的生长,但高浓度的铝对植株会产生毒害[1-2]。国外一些学者对桉树在酸铝环境中的影响,进行了一定程度的研究[3-5]。我国酸性土壤主要分布在南方地区,而桉树的主产区在南方。我国桉树种植受到铝(Al)毒影响较为严重。如何减少桉树的生长所受的铝毒的影响,成为现在铝胁迫研究的主要方向。而且对桉树接种内生真菌后铝胁迫生理特性的变化研究未见报道。文章通过菌种浸泡法将10株内生真菌接入桉树无性系,研究其在不同铝胁迫条件下植株叶绿素含量、铝含量和植株生物量的变化,为筛选出优良抗铝菌种提供参考。
1 试验地点
本试验在福州市福建农林大学校内福建省高校森林生态系统过程与经营重点实验室苗地内进行。试验地位于 118°08′~ 120°31′E, 25°15′~26°39′N之间,属于亚热带海洋性气候,年平均气温19.6 ℃,无霜期326 d,降雨量1 342.5 mm,平均湿度77%。该地气候温和,雨量充沛。
2 材料与方法
2.1 试验设计
本试验所用材料为福建省林科院组培中心的尾巨桉3229号无性系组培苗。根据试验需要选择营养条件良好且生长一致的苗木。由于营养液培养试验可以控制植物生长所需的全部营养物质,该方法被应用于植物营养科学研究的各个领域。营养液采用Hoagland不完全营养液配方[6],铝胁迫试验设置3个铝离子处理水平,分别为0、50、100 µm,在每个溶液中加入等量的
水培试验容器采用直径为20 cm,体积3 L的塑料小桶。使用前将塑料桶用黑色油漆涂成黑色,漆2~3层,确保四面不透光(模拟土壤环境)。将塑料桶清洗干净,在桶盖上打3个小孔,并将桶的边缘剪开,以便于苗木的放入。桶盖中央打1个大孔,用于放入通气管道。苗木放入塑料桶前,用蒸馏水清洗干净根部,并吸干水分。装桶前测量苗木株高,地径,尽量使植株保持大小均衡。每桶定植3株。定植后利用氧气泵每天7点、15点、23点给苗木通气30 min,每隔3天更换1次培养液。
在初始培养10天后,为避免铝离子与营养液中的磷酸盐形成沉淀物,根据谢国生等[8]的方法修改后进行Al间隔处理:将植物根系生长于含100 µm A1C13的 0.5 mm CaC12溶液 (pH4.5)和 50µm A1C13的0.5 mm CaC12溶液(pH4.5)中,处理1天,与此同时,对照根系置于0.5 mm CaCl2溶液(pH 4.5)中,第2天将Al处理和对照的根系置于Hoagland营养液中培养一天,然后再进行Al和对照处理,如此交叉处理10天后,测量植株叶绿素含量。收获植物,将其分为地上部和地下部,称量其鲜重,70 ℃烘干。小型粉碎机将烘干样品磨细准备用于测定其中的Al含量。
2.2 接种试验
菌种是通过提取桉树内生菌分离纯化得到的。菌液的制备:将10个菌种(表1)接入等体积的液体培养基,经过24 h的培养,利用血球计数板计算菌液浓度,将菌液共同用水溶液稀释成5.0×106cfu/mL。将幼苗清洗干净,并用蒸馏水冲洗3次。然后将幼苗根系浸泡在相同浓度的菌液当中,放置30 min,用蒸馏水清洗3次,最后将幼苗转入培养液中。
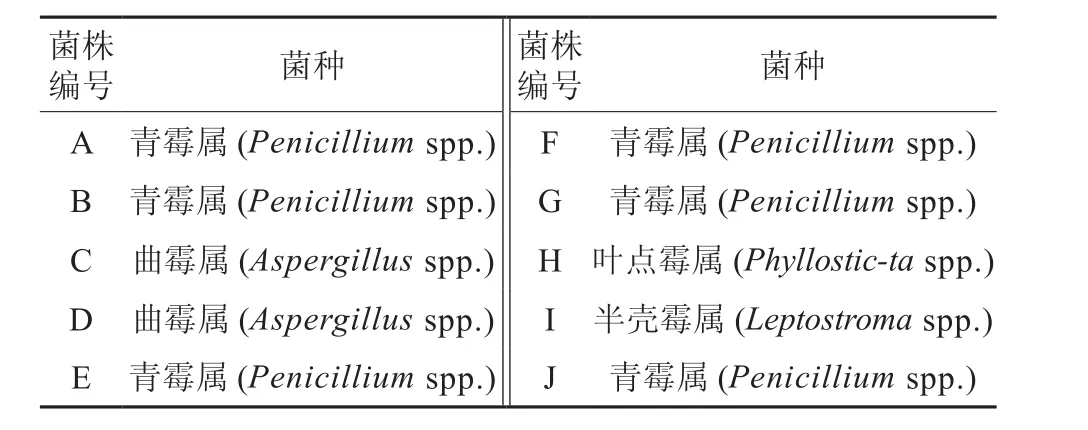
表1 10株菌种†Table 1 Ten fungus and their code name
2.3 测定方法
2.3.1 叶绿素含量测定
参照李合生的方法[9]进行。
2.3.2 植株生物量测定
将植株的不同部位分别标号放入已知重量的铝盒(W1)中,然后放入烘箱105 ℃烘干0.5 h(钝化酶),然后在70 ℃下烘干,经过10 h后,取出铝盒放入干燥箱中冷却至室温,称重后再放入烘箱中,重复测定直至恒重为止。称得铝盒和样品的总重量W2。则材料干重=W2-W1。
2.3.3 植株铝含量测定
参考森林土壤分析方法[10]。
3 结果与分析
3.1 内生真菌对桉树铝胁迫下叶绿素含量的影响
对不同Al胁迫处理的叶绿素含量进行方差分析和LSD多重比较分析(见表2、表3)。植株的总叶绿素含量在不同菌种间的差异达到极显著水平,不同Al处理间差异也达到极显著水平。与对照相比,处理C达到显著水平,处理A、D、E达到极显著水平。与对照处理相比,铝胁迫处理2达到极显著水平。植株叶绿素a/b的数值在不同菌种和不同Al处理间均未达到显著水平。与对照处理相比,铝胁迫处理1和铝胁迫处理2均未达到显著水平。处理A、E、D、C、H、F、G、B和I的总叶绿素含量增加44.78%、38.81%、34.33%、16.42%、10.45%、5.97%、5.97%、4.48% 和1.50%,处理J的叶绿素含量与对照相同。这表明植株由于受到铝毒害,叶绿素含量呈现下降趋势,不同菌种处理的植株叶绿素含量呈现明显区别。大部分菌种处理的植株叶绿素含量与对照相比有一定程度的增加,这表明经过菌种处理的植株在一定程度上保护了植株组织不受铝毒害,延缓了叶绿素体组织受到的伤害。

表2 11种桉树处理不同Al胁迫处理叶绿素含量的方差分析Table 2 Variance analysis on chlorophyll contents with different Al content in eleven treatments

表3 11种处理和不同Al胁迫处理叶绿素含量的LSD多重比较Table 3 Multiple comparison on chlorophyll contents with different Al content in eleven treatments
3.2 内生真菌对桉树铝胁迫下植株铝含量的影响
在铝胁迫下,一些耐铝植物的根系会分泌有机酸[11-12]。这些有机酸与铝离子形成有机鳌合物,毒性较低,从而达到降低铝离子浓度的作用[13]。
随着低Al胁迫的加深,植株体内Al的含量逐渐增加(见图1)。对不同Al胁迫处理的植株铝含量进行方差分析表明(见表4),不同菌种处理间和不同铝胁迫处理间均达到极显著水平。对不同Al胁迫处理的植株铝含量进行LSD多重比较分析表明(见表5),与对照相比, C达到显著水平,处理A、D、E达到极显著水平。铝胁迫处理1和铝胁迫处理2达到极显著水平。与对照处理CK相比较,处理D、A、E、H、F和I的铝含量分别减少74.52%、66.24%、54.14%、10.83%、9.55%和0.64%,处理C、B、J和G的铝含量增加51.59%、35.67%、14.65%和5.10%。这表明植株由于受到铝离子的毒害,铝离子一定程度的渗入到植株体内,对植株的正常生理特征产生了一定程度的破坏。不同菌种处理的植株体内铝含量具有显著的区别,这表明不同菌种对植株铝的吸收产生一定程度的调控。个别菌种处理的植株体内铝含量与对照相比明显下降,这可能在一定程度上降低了植株的铝毒。
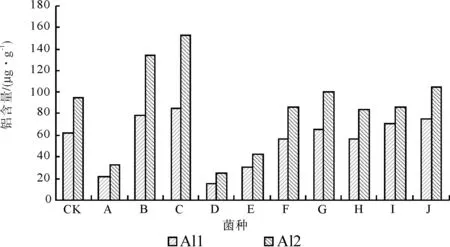
图1 11种桉树处理的植株铝含量变化Fig.1 Aluminum content changes in eleven treatments
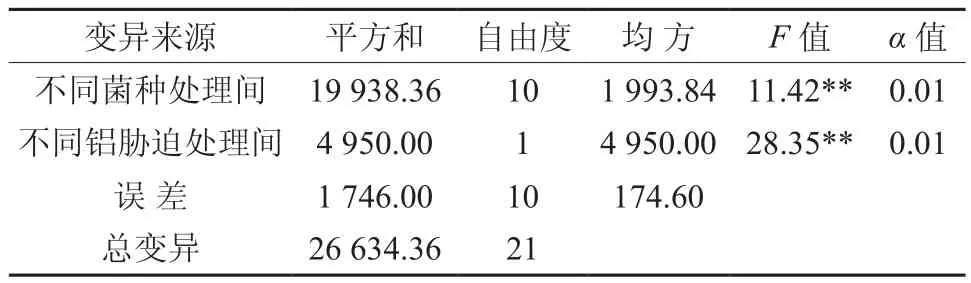
表4 11种处理和不同Al胁迫处理植株铝含量的方差分析Table 4 Variance analysis on different Al content treatments in eleven treatments
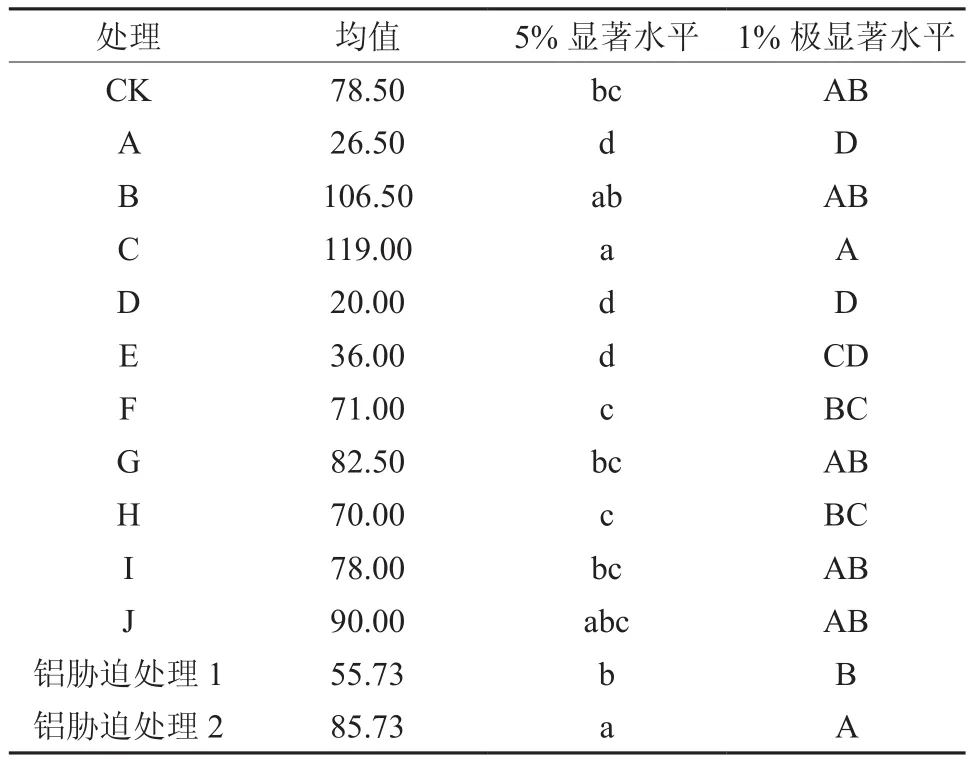
表5 11种处理和不同Al胁迫处理植株铝含量的LSD多重比较Table 5 Multiple comparison of different Al content in eleven treatments
3.3 内生真菌对桉树铝胁迫下植株生物量的影响
对植株总干重进行方差分析和LSD多重比较分析(见表6、表7),不同菌种处理和不同Al处理均达到差异极显著水平。与对照处理相比,处理I、J达到显著水平,处理A、D、E达到极显著水平。与对照处理相比较,铝胁迫处理2达到极显著水平,铝胁迫处理1未达到显著水平。
对对照处理进行方差分析和LSD多重比较分析,不同部位间达到差异极显著水平,不同菌种处理间未达到差异极显著水平。与对照处理相比,处理A、E达到显著水平。与对照处理相比较,铝胁迫处理1和铝胁迫处理2达到极显著水平。
对铝胁迫处理1进行方差分析和LSD多重比较分析,不同菌种处理间和不同部位间均达到差异极显著水平。与对照处理相比,处理G、H、I、J达到显著水平,处理A、B、D、E、F达到极显著水平。与对照处理相比,铝胁迫处理1和铝胁迫处理2达到极显著水平。
对铝胁迫处理2进行方差分析和LSD多重比较分析,不同菌种处理间和不同部位间均达到差异极显著水平。与对照处理相比,处理A、E达到显著水平。与对照处理相比,铝胁迫处理1和铝胁迫处理2达到极显著水平。

表6 11种处理和不同Al胁迫处理生物量含量的方差分析Table 6 Variance analysis on biomass with different Al content in eleven treatments
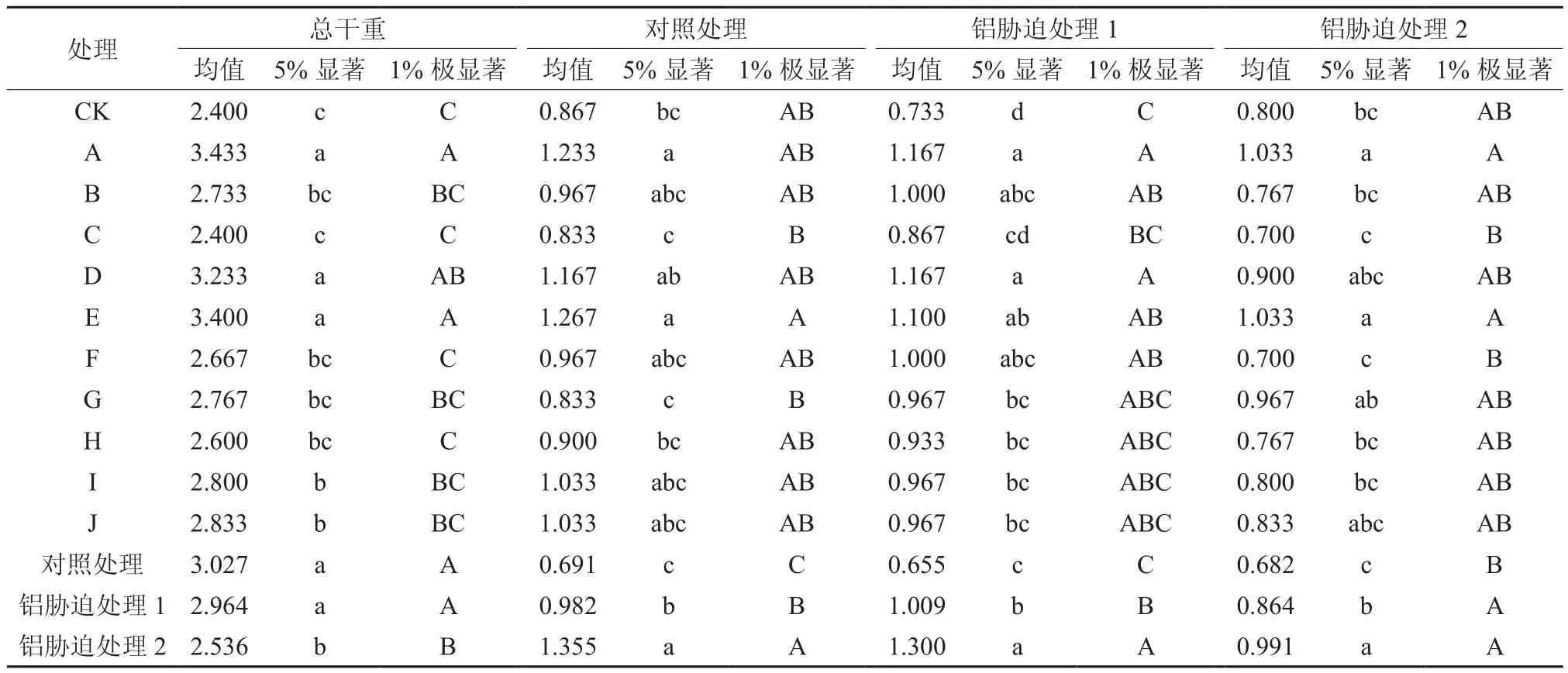
表7 11种处理和不同Al胁迫处理生物量含量的LSD多重比较分析Table7 Multiple comparison on biomass with different Al content in eleven treatments
植株总生物量分析,与对照处理CK相比较,处理A、E、D、J、I、G、B、F和H的生物量增加 43.05%、41.67%、34.72%、18.05%、16.67%、15.28%、13.89%、11.11%和8.33%,处理C的生物量和对照相同。这表明不同菌种处理的植株与对照相比,由于内在生理特征在一定程度上抑制了铝离子产生的毒害,从而达到促进植株正常生理特征的目的,因此植株的生物量与对照相比得到一定程度的增加。
4 结论与讨论
处理A、E和D的总叶绿素含量增加44.78%、38.81%和34.33%。处理D、A和E的铝含量分别减少74.52%、66.24%和54.14%。处理A、E和D的生物量增加43.05%、41.67%和34.72%。综上所述,接种菌种A、D、E后植株各方面生理指标均体现出一定程度的抵御铝毒害的能力。菌种A、D、E具有较强的提高植株铝胁迫抗性的能力。今后可以考虑进一步研究菌株抵御铝毒能力的机理,以便将其推广应用于现实生产中。
目前有关植物耐铝的机理主要有两种[14-17]:一是植株的外部抗铝机制(即对铝的排斥),只要是指植物阻止铝进入植物体内或接触细胞的敏感的代谢部位;二是植物的内部机理(即植物对铝的内部忍耐),即当铝离子进入植物体内,植株通过解毒作用或生理作用而抵抗其对植株产生的毒害。不同植株对铝的耐性主要源自多个基因性状,一般由一个或一个以上的基因和几个微基因控制,并且多数耐铝植物对铝的抗性可能涉及内部和外部抗性[18-19]。无论是内部还是外部机制,细胞膜和细胞产生的抗氧化酶类和非酶类物质都起着重要的作用[20-22]。接种桉树内生真菌后,在植株受到Al的毒害下,我们测定的上述指标显现出明显的差异,这可能跟内生菌能促进分泌抗氧化酶类和非酶类物质有关。今后将进一步通过试验来证实,以探明其机理。
由于参与铝转导的因素很多,但关于信号分子之间或信号分子与有机酸阴离子通道相互作用的研究比较少,因此以后可以加强这方面的研究。研究菌株的分泌物,研究其是否分泌有机酸。研究植株在单独铝胁迫条件下和接种内生真菌铝胁迫下蛋白质表达差异,研究其是否在内生菌的诱导下某些基因加强表达,研究内生菌是否促进了植株抗铝基因的表达。研究所接种的内生真菌在正常条件下的分泌物与在铝胁迫条件下的分泌物,研究铝离子是否对真菌的基因表达产生影响。还可以将它们分别与植株进行接种,分析接种对植株产生的影响。
[1] Arbestain M C, Mourenza C, Alvarez E, et al. Inf l uence of parent material and soil type on the root chemistry of forest species grown on acid soils[J]. Forest Ecology Management, 2004,193(3):307-320.
[2] Alrarez E, Femandez-Marcos M L, Monterroso C, et al. Application of aluminums toxicity indices to soils under various forest species[J]. Forest Ecology Management, 2005, 211(3): 227-239.
[3] Silva I R, Novais R F, Jham G N, et al. Responses of eucalypt species to aluminium: the possible involvement of low molecular weight organic acids in the Al tolerance mechanism[J]. Tree Physiology, 2004, 24:1267- 1272.
[4] Neves J C L, Novais R F, Barros N F. Effect of aluminium in nutrient solution on growth and nutrient uptake by Eucalyptus spp.[J]. Rev. Arvor,1982, 6:1-16.
[5] Tahara K, Norisada M, Yamanoshita T, et al. Role of aluminiumbinding ligands in aluminium resistance of Eucalyptus camaldulensis and Melaleuca cajuputi[J]. Plant Soil, 2008,302:175-187.
[6] 杨曾奖.桉苗水培营养配方和pH值的选择[J].林业科学研究 ,1990,3(5):495-498.
[7] 方允中,杨 胜,伍国耀.自由基稳衡性动态[J].生理科学研究进展 ,2004,35(3):1999-2004.
[8] 谢国生,师瑞红,庞贞武,等.铝胁迫下水稻幼苗根系的生理特性[J].应用生态学报,2009,20(7):1698-1704.
[9] 李合生.植物生理生化原理和技术[M].北京:高等教育出版社 ,2000:167-169.
[10] 国家林业局.森林土壤分析方法[M].北京:中国标准出版社,2000.
[11] Ma J F, Ryan P R, Delhaize E. Aluminum tolerance in plants and the complexing role of organic acids [J].Trends in Plant Science,2001,6:273-278.
[12] Ryan P R, Delhaize E, Jones D L. Function and mechanism of organic anion exudation from plant roots [J].Ann. Rev. Plant Physiology Plant Mol. Biology, 2001,52:527-560.
[13] Kochian L V. Cellular mechanisms of aluminum toxicity and resistance in plants Annu. Rev. Plant Physiology[J]. Plant Mal.Biology, 1995,46:237-260.
[14] Kong F X, Sang W E, Jing X, et al. Aluminum toxicity and tolerance in plants[J].Acta Ecological Sinica,2000,20:855-863.
[15] Barcelo J, Poschenrieder C. Fast root growth responses,root exudates and internal detoxif i cation as clues to the mechanisms of aluminum toxicity and resistance:a review[J].Environment Experimental Botany,2002, 48:75-92.
[16] Ermolayev V, Weschke W, Manteuffel R. Comparison of A1-induced gene expression in sensitive and tolerant soybean cultivars[J].Journal of Experimental Botany, 2003,393:2745-2756.
[17] Deborah A, Tesfaye M. Plant improvement for tolerance to aluminum in acid soils-a review.Plant Cel1[J]. Tissue and Organ Culture, 2003,75:189-207.
[18] Ermolayev V, Weschke W, Manteuffel R. Comparison of A1-induced gene expression in sensitive and tolerant soybean cultivars[J].Journal of Experimental Botany,2003,393:2745-2756.
[19] Rout G R, Samantary S, Das P. Aluminium toxicity in plants:a review[J]. Agronomie, 2001,21:2-21.
[20] 梁小翠,闫文德,田大伦,等.樟树对土壤中PAHs 的修复及其影响因子[J].中南林业科技大学学报,2012,32(12):176-180.
[21] 陈 星,文仕知,陈永华,等. 锰污染土壤渗漏液与径流生态拦截净化系统的植物筛选[J].中南林业科技大学学报,2012,32(12): 97-103.
[22] Devi S R,Yamamoto Y, Matsumoto H. An intracellular mechanism of aluminium tolerance associated with high antioxidant status in culture tobacco cells[J]. Journal of Inorganic Biochemistry, 2003,97:59-68.
Effects of endophytic fungi in Eucalyptus on resistance physiological characteristics of E.urophylla × E.grandis seedlings under aluminum toxicity stress
XIE An-qiang, HONG Wei, WU Cheng-zhen, LIN Yong-ming, CHEN Can
(1. Institute of Forest Ecology, Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian, China; 2. Key Lab. for Forest Ecosystem Process and Management of Fujian Province, Fuzhou 350002, Fujian, China)
By strain liquid soak method, ten endophytic fungus were inoculated into the seedlings of E. urophylla×E. grandis, the seedlings were tested with aluminum stress for 10 days, then the chlorophyll content, plant fresh weight and aluminum content were measured. The results show that after ten days, compared with control the contents of chlorophyll of treatment A, E and D increased by 44.78%、38.81% and 34.33%respectively; compared with control the contents of aluminum of treatment D, A and E decreased by 74.52%、66.24% and 54.14%respectively; compared with control the contents of plant fresh weight of treatment A, E and D increased by 43.05%、41.67% and 34.72%respectively. After inoculated with No.A, No.D, No. E fungus, the aluminum-resistant capability of Eucalyptus has been improved greatly. The method can be popularized in test.
Eucalyptus; E.urophylla×E.grandis; fungus; resistance physiological characteristics; chlorophyll; biomass
S718.81;S792.39
A
1673-923X(2013)03-0016-05
2012-10-16
教育部博士点学科专项基金项目(20093515110006);福建省科技厅重点项目(2008N0004)
谢安强(1981-),男,福建福州人,讲师,博士,主要从事森林生态方面的研究
[本文编校:吴 毅]

