水稻条纹病毒编码的NS2蛋白的亚细胞定位分析
郑璐平,林 辰,吴祖建,谢联辉
(福建农林大学植物病毒研究所,福建福州350002)
水稻条纹叶枯病是水稻上的重要病害之一,是由水稻条纹病毒(Rice stripe virus,RSV)引起的一种病毒病.1975年日本首次发现并报道该病毒[1],随后在中国、韩国等水稻种植区也相继发现该病毒.RSV属于极纤细病毒属,由介体昆虫灰飞虱持续传播,并可经卵传播[2].发病水稻心叶出现褪绿黄白斑,而后扩展成与叶脉平行的黄色条纹,条纹间仍保持绿色,其茎秆有时出现褪绿现象,能引起水稻抽穗畸形、枯心,结实少甚至不结实,给水稻产量造成严重影响[3-4].
RSV病毒粒子为线状,长为500-2000 nm,直径为3-8 nm,由4个基因组组成(RNA1、RNA2、RNA3和RNA4),该病毒共编码7个蛋白[5],除RNA1为负义编码方式外,其他基因组均采用双义编码方式.RNA1编码的蛋白大小为337 kD,具有依赖RNA的RNA聚合酶(RNA-dependent RNA polymerase,RdRp)功能[6];RNA2编码2个蛋白,其正义链编码NS2蛋白,大小为22.8 kD,该蛋白被鉴定为弱沉默抑制子,并能与水稻内源基因SGS3互作[7],负义链编码大小为94 kD的NSc2蛋白,该蛋白可能是一个膜糖蛋白[8];RNA3编码一个沉默抑制子NS3[9]和一个核衣壳蛋白NSc3(即CP)[10];RNA4编码一个病害特异性蛋白SP 以及一个运动蛋白 Nsvc4[11-12].
细胞的大多数遗传物质都存在于细胞核中,用于维持基因完整性,调节基因表现,并借此来影响细胞活动[13-14].细胞核被认为是 RNA 沉默发生的起点[15],因此,很多病毒编码的沉默抑制子如 RSV NS3[9]、黄瓜花叶病毒(Cucumber mosaic virus,CMV)2b蛋白、马铃薯A病毒(Potato virus A,PVA)VPg蛋白均定位于细胞核[16-17].笔者对RSV NS2初期研究发现,该蛋白同样定位于细胞核,并形成大小不一的小点,推测其可能与柯浩体(cajal body,CB)共定位.因此,本文将进一步研究RSV NS2的亚细胞定位,以期为深入研究NS2的功能奠定基础.
1 材料与方法
1.1 材料
1.1.1 植物材料 RSV水稻病株、拟南芥以及本氏烟为本实验室保存.水稻病株种植在温室中,拟南芥和本氏烟分别种植在温度为22和25℃的人工气候培养箱中(16 h/光,8 h/暗).
1.1.2 菌种和载体 入门载体pDNOR221、表达载体pEarley101和pEarley102由加拿大农业部王爱民博士赠送,表达载体35S-GFP、大肠杆菌(Escherichia coli)DH5α菌株、农杆菌(Agrobacterium tumefaciens)EHA105菌株由本实验室保存.
1.1.3 试剂 RNA提取试剂盒(EasyPure Plant RNA Kit)、Taq酶(TransStart TopTaq DNA Polymerase)、质粒提取试剂盒(EasyPure HiPure Plasmid MaxiPrep Kit)和DNA回收试剂盒(EasyPure Quick Gel Extraction Kit)购于北京全式金生物技术有限公司;反转录试剂盒(FastQuant RT Kit with gDNase)购于北京天根生化科技有限公司;限制性内切酶MluⅠ购于宝生物工程(大连)有限公司;BP ClonaseTMⅡ Enzyme Mix和LR ClonaseTMⅡEnzyme Mix购于invitrogen公司.引物合成、序列测定和绿色荧光蛋白 (green fluorescent protein,GFP)多克隆抗体制备由南京金斯瑞生物科技有限公司完成.碱性磷酸酶标记羊抗兔IgG购于Sigma公司,BCIP/NBT显色试剂盒购于成都贝斯特试剂有限公司.
1.2 方法
1.2.1 NS2及CB蛋白(coilin)cDNA开放阅读框(open reading frame,ORF)的克隆 分别取0.1 g本氏烟和水稻叶片,迅速放入液氮中,按试剂盒说明书完成RNA提取.根据GenBank中报道的RSV NS2(Gen-Bank accession:EF493228)和Atcoilin(GenBank accession:NM_101173)设计引物(表1),以RNA反转录产物cDNA第一链为模板进行PCR扩增.反应条件:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸2 min,共35个循环;最后72℃终延伸10 min.扩增产物通过1%琼脂糖凝胶电泳鉴定,回收目的条带.按BP ClonaseTMⅡEnzyme Mix说明书操作,将回收条带与入门载体pDNOR221进行同源重组,并将重组产物转化到DH5α中,经卡那霉素抗性平板筛选培养,挑选单菌落摇菌并提取质粒,经MluⅠ酶切鉴定正确后,委托南京金斯瑞生物技术有限公司测序.
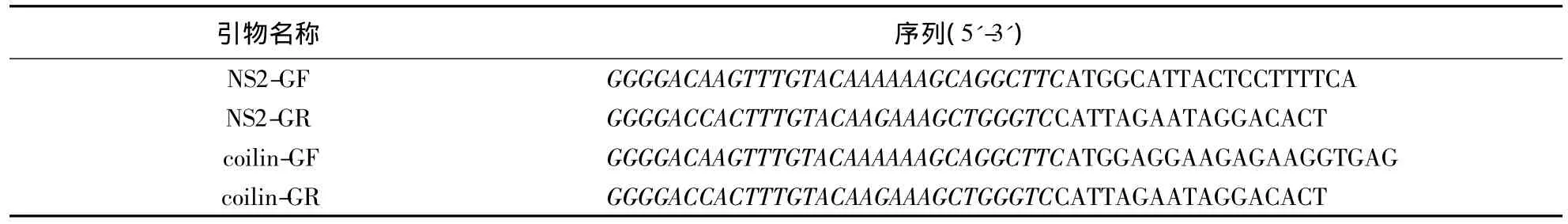
表1 本研究所用引物1)Table 1 Primers used in this study
1.2.2 植物重组表达载体pEarley102-NS2、pEarley101-coilin的构建 将测序正确的质粒pDNOR221-NS2和pDNOR221-coilin进行MluⅠ单酶切,分别回收目的条带.根据LR ClonaseTMⅡEnzyme Mix说明书操作,将回收条带分别与pEarley102、pEarley101同源重组后转化到DH5α中,经卡那霉素抗性平板筛选培养,挑取单菌落摇菌并提取质粒;将PCR鉴定正确的重组质粒通过液氮冻融法转化到EHA105中,再经卡那霉素和利福平抗性平板筛选培养,挑取单菌落进行PCR鉴定.
1.2.3 本氏烟总蛋白提取及Western blot检测 取接种后3 d的本氏烟叶片0.3 g(未接种的健康植株为对照),加入 1 mL 蛋白提取蛋白缓冲液(50 mmol·L-1phosphate pH 8.0,10 mmol·L-1Tris pH 8.0,500 mmol·L-1NaCl,0.1%Tween 20,0.1% β-巯基乙醇,1 mmol·L-1PMSF,Roche Protease inhibitor cocktail MINI tablet 10 mL·片-1).研磨数分钟,移入1.5 mL 离心管,4 ℃、12000 r·min-1离心 10 min,吸取上清液至新离心管中,4℃、12000 r·min-1离心10 min,吸取上清液至新离心管中,完成总蛋白的提取.
取适量提纯的蛋白与5×SDS-PAGE loading buffer混匀后,98℃煮沸5 min,在12%SDS-PAGE上电泳.电泳结束前20 min,将PVDF膜在甲醇中浸润10 s后,转移至电转缓冲液中浸润20 min,待电泳结束后,将凝胶转移到膜上,通过湿转转膜仪转膜(80 V,45 min).转膜结束后,取出PVDF膜,用1×PBST清洗3次(5 min·次-1),加入封闭液,37℃、50 r·min-1震荡1 h,用1×PBST清洗膜3次;加入GFP抗体孵育(37 ℃、50 r·min-1、1 h),再用1 ×PBST 清洗膜3 次;加入二抗(羊抗兔)孵育(37 ℃、50 r·min-1、1 h),用1×PBST清洗膜3次.参照BCIP/NBT显色试剂盒,在AP碱性磷酸反应缓冲液中加入等量底物显色溶液BCIP/NBT避光显色(10-20 min).
1.2.4 NS2在本氏烟表皮细胞中的定位观察 将NS2-CFP(EHA105)和coilin-YFP(EHA105)于28℃下,在含有0.05 mg·L-1卡那霉素和0.05 mg·L-1利福平的LB液体培养基中培养至对数生长期.取1 mL菌液于 12000 r·min-1离心 1 min,弃菌液,底部菌体用悬浮液(10 mmol·L-1MES pH 5.6,10 mmol·L-1MgCl2和150 μmol·L-1乙酰丁香酮)悬浮2次后,用悬浮液调整菌液浓度至D600nm≈0.7,将两者按体积比1∶1混合,室温放置3 h.用1 mL注射器吸取适量菌液,用无针头的针管将菌液慢慢注入本氏烟叶片背部组织的空隙中,浸润接种的植株于25℃暗培养,48 h后在激光共聚焦显微镜(Microsystems CMS GmbH Leica TCS SP5)下观察融合蛋白的亚细胞定位结果.
2 结果与分析
2.1 RSV NS2和Atcoilin的cDNA的克隆及其表达载体的构建
通过RT-PCR方法从水稻和拟南芥RNA反转录的cDNA中扩增到大小分别为600和1800 bp的条带(图1),与目的条带大小一致;回收这2个片段,分别与入门载体pDNOR221进行同源重组,将重组质粒进行MluⅠ单酶切,出现大小为900 bp的条带,与预期一致,并通过测序确定重组质粒的正确性,将正确的质粒分别命名为pDNOR221-NS2和 pDNOR221-coilin(图2).回收图2酶切产物2400和3600 bp的条带,将其分别与表达载体pEarley102和pEarley101同源重组,经PCR扩增鉴定(图3),重组质粒条带大小与预期一致;将正确的质粒转化到农杆菌EHA105中,并进行单菌落PCR鉴定(图3),条带大小与目的基因一致,说明重组质粒成功转化到EHA105.
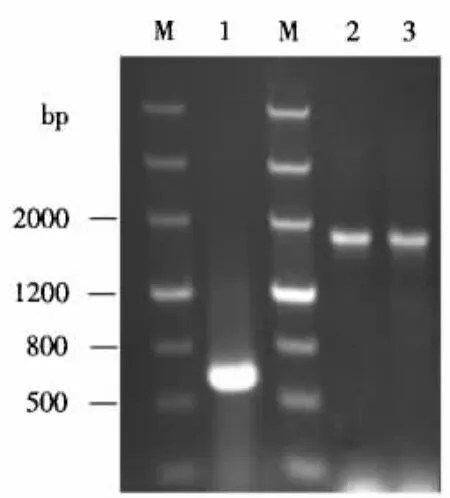
图1 RSV NS2及Atcoilin基因的扩增Fig.1 Amplification of RSV NS2 and Atcoilin
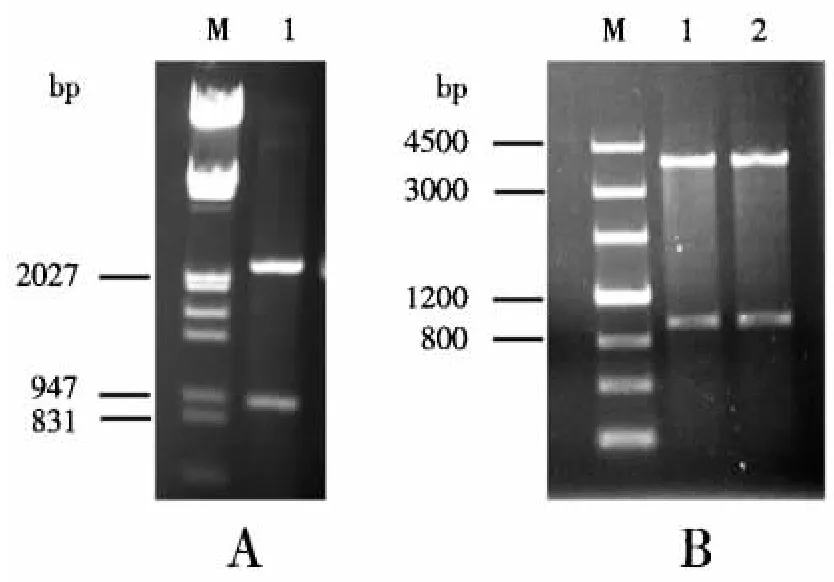
图2 重组质粒单酶切鉴定图Fig.2 Identification of recombinant plasmid by enzyme digestion
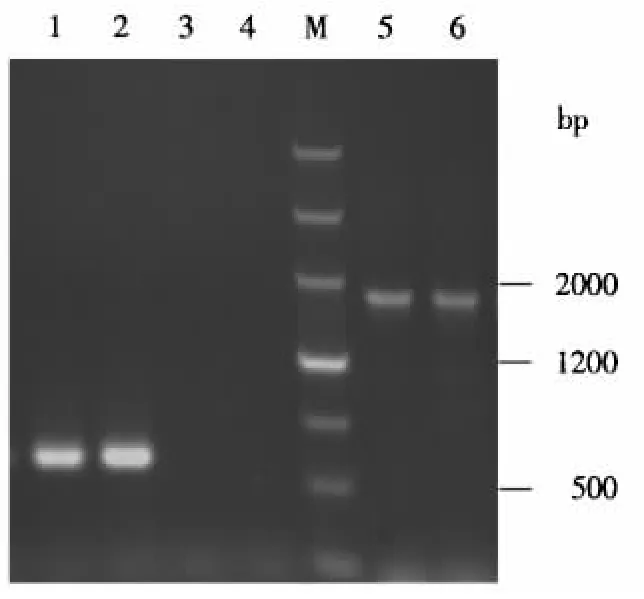
图3 重组植物表达载体的PCR鉴定Fig.3 Identification of recombinant expression vectors by PCR
2.2 Western blot检测蛋白的表达
以GFP多克隆抗体为一抗、碱性磷酸酶标记的羊抗兔为二抗检测本氏烟叶片中GFP、YFP和CFP的表达.图4显示,仅接种GFP的本氏烟,约在30 kD处有一明显条带,与GFP大小一致;接种NS2-CFP和coilin-YFP的本氏烟,分别在53和130 kD处有明显条带,与融合后重组蛋白的分子质量大小一致;健康植株则未出现特异条带,说明本氏烟叶片中检测到的蛋白条带是由外源蛋白特异表达,且这些蛋白的表达是正确的.
2.3 RSV NS2和Atcoilin在本氏烟叶片表皮细胞中的定位
取接种48 h的本氏烟叶片在激光共聚焦显微镜下观察,NS2-CFP与Atcoilin-YFP共定位(图5),说明NS2定位在CB上.

图5 NS2与coilin的亚细胞定位Fig.5 Subcellular localization of fusion protein NS2 and coilin
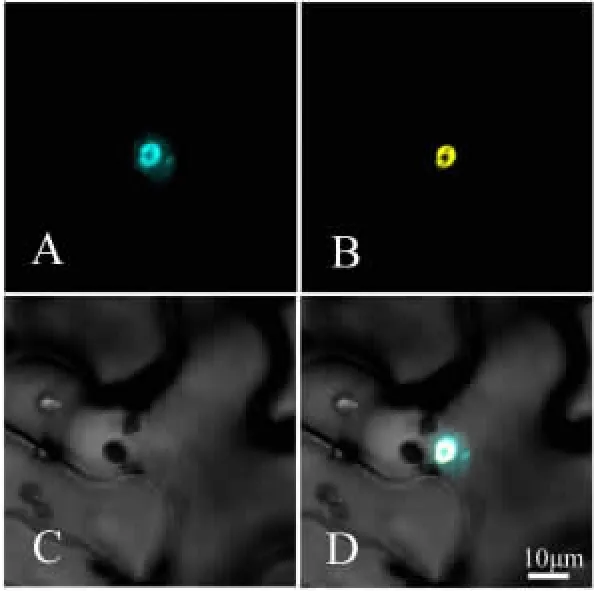
图4 本氏烟叶片中蛋白表达情况的Western blot检测Fig.4 Western blot analysis of proteins expression in Nicotiana benthamiana leaves
3 讨论
本研究利用模式植物本氏烟,结合农杆菌接种法观察RSV NS2的亚细胞定位,发现该蛋白定位在细胞核的CB上.试验过程中还发现,在进行农杆菌接种时,菌液的浓度不可太高,否则易损伤叶片,使外源蛋白无法表达.而蛋白在本氏烟表皮细胞瞬时表达的时间因蛋白而异,尤其研究对象CB是一个动态结构,并非在所有的细胞中都能看到该结构,CB的大小、数量与细胞环境、细胞核内小核核糖体蛋白(small nuclear ribonucleoprotein,snRNP)组装水平和RNA合成效率相关[18-19].因此,在接种期间要定时观察,以找到最适宜观察的时间点.
CB是细胞核中一个重要的细胞器.Kim et al[20]研究发现,花生丛簇病毒(Groundnut rosette virus,GRV)编码的ORF3蛋白定位在CB上,其借助CB进入核仁,并由此与核仁蛋白fibrillarin(Fib)互作,从而完成病毒的侵染过程,在此过程中病毒蛋白和Fib缺一不可[21].Fib是核仁和CB的指示蛋白,定位在核仁和CB上.一些病毒可通过招募细胞的核蛋白进行病毒核糖核蛋白粒子的装配、病毒的复制和移动等[22],如水稻矮缩病毒(Rice dwarf virus,RDV)编码的Pns11与Fib互作[23],动物病毒如甲型流感H3N2病毒也与Fib蛋白互作[24].另外,在利用RNAi技术沉默RSV不同编码蛋白基因的研究中发现,针对RSV NS2沉默的转基因水稻表现出一定的抗性,故研究者推测该蛋白可能参与病毒的增殖[25].根据本研究结果,RSV NS2与CB共定位,可能发生直接或间接的互作,这一互作是否介导病毒的复制和增殖,将成为今后的研究重点.
[1]KOGANEZAWA H,YORA K.Purification of rice stripe virus[J].PSJ,1975,41(2):148-154.
[2]FALK B W,TSAI J H.Biology and molecular biology of viruses in the genus Tenuivirus[J].Ann Rev Phytopathol,1998,36(1):139-163.
[3]HIBINO H.Biology and epidemiology of rice viruses[J].Ann Rev Phytopathol,1996,34(1):249-274.
[4]WEI T Y,YANG J G,LIAO F L,et al.Genetic diversity and population structure of Rice stripe virus in China[J].J Gen Virol,2009,90(4):1025-1034.
[5]RAMÍREZ B C,HAENNI A L.Molecular biology of tenuiviruses,a remarkable group of plant viruses[J].J Gen Virol,1994,75(3):467-475.
[6]TORIYAMA S,TAKAHASHI M,SANO Y,et al.Nucleotide sequence of RNA 1,the largest genomic segment of Rice stripe virus,the prototype of the tenuiviruses[J].J Gen Virol,1994,75(12):3569-3580.
[7]DU Z,XIAO D,WU J,et al.P2 of Rice stripe virus(RSV)interacts with OsSGS3 and is a silencing suppressor[J].Mol Plant Pathol,2011,12(8):808-814.
[8]TAKAHASHI M,TORIYAMA S,HAMAMATSU C,et al.Nucleotide sequence and possible ambisense coding strategy of Rice stripe virus RNA segment 2[J].J Gen Virol,1993,74:769-773.
[9]XIONG R,WU J,ZHOU Y,et al.Characterization and subcellular localization of an RNA silencing suppressor encoded by rice stripe tenuivirus[J].Virol,2009,387(1):29-40.
[10]ZHU Y,HAYAKAWA T,TORIYAMA S,et al.Complete nucleotide sequence of RNA 3 of Rice stripe virus:an ambisense coding strategy[J].J Gen Virol,1991,72(4):763-767.
[11]XIONG R,WU J,ZHOU Y,et al.Identification of a movement protein of the tenuivirus Rice stripe virus[J].J Virol,2008,82(24):12304-12311.
[12]ZHU Y,HAYAKAWA T,TORIYAMA S.Complete nucleotide sequence of RNA 4 of Rice stripe virus isolate T,and comparison with another isolate and with Maize stripe virus[J].J Gen Virol,1992,73(5):1309-1312.
[13]SCHNEIDER R,GROSSCHEDL R.Dynamics and interplay of nuclear architecture,genome organization,and gene expression[J].Genes Dev,2007,21(23):3027-3043.
[14]TRINKLE-MULCAHY L,BOULON S,LAM Y W,et al.Identifying specific protein interaction partners using quantitative mass spectrometry and bead proteomes[J].J Cell Bio,2008,183(2):223-239.
[15]PONTES O,LI C F,NUNES P C,et al.The Arabidopsis chromatin-modifying nuclear siRNA pathway involves a nucleolar RNA processing center[J].Cell,2006,126(1):79-92.
[16]HAUPT S,STROGANOVA T,RYABOV E,et al.Nucleolar localization of Potato leafroll virus capsid proteins[J].J Gen Virol,2005,86(10):2891-2896.
[17]GONZÁLEZ I,MARTÍNEZ L,RAKITINA D V,et al.Cucumber mosaic virus 2b protein subcellular targets and interactions:their significance to RNA silencing suppressor activity[J].Mol Plant Microbe In,2010,23(3):294-303.
[18]SLEEMAN J E,AJUH P,LAMOND A I.snRNP protein expression enhances the formation of Cajal bodies containing p80-coilin and SMN[J].J Cell Sci,2001,114(24):4407-4419.
[19]LEMM I,GIRARD C,KUHN A N,et al.Ongoing U snRNP biogenesis is required for the integrity of Cajal bodies[J].Mol Biol Cell,2006,17(7):3221-3231.
[20]KIM S H,RYABOV E V,KALININA N O,et al.Cajal bodies and the nucleolus are required for a plant virus systemic infection[J].EMBO J,2007,26(8):2169-2179.
[21]KIM S H,MACFARLANE S,KALININA N O,et al.Interaction of a plant virus-encoded protein with the major nucleolar protein fibrillarin is required for systemic virus infection[J].PNAS,2007,104(26):11115-11120.
[22]SHAW P,BROWN J.Nucleoli:composition,function,and dynamics[J].Plant Physiol,2012,158(1):44-51.
[23]吴建国.水稻矮缩病毒非结构蛋白Pns11的核仁定位及其与核仁蛋白Fibrillarin的互作[D].福州:福建农林大学,2010.
[24]MELÉN K,TYNELL J,FAGERLUND R,et al.Influenza A H3N2 subtype virus NS1 protein targets into the nucleus and binds primarily via its C-terminal NLS2/NoLS to nucleolin and fibrillarin[J].Virol J,2012,9(1):167.
[25]SHIMIZU T,NAKAZONO-NAGAOKA E,UEHARA-ICHIKI T,et al.Targeting specific genes for RNA interference is crucial to the development of strong resistance to Rice stripe virus[J].Plant Biotechnol J,2011,9(4):503-512.

