矿源黄腐酸对甜椒幼苗生长和耐热性的影响
林梅桂
(福建农林大学作物科学学院,福建福州350002)
地球表层存在着大量的腐植酸类物质,其中,可溶于水和酸的黄腐酸(fulvic acid,FA)的应用越来越广,可应用在农业、医药和工业等多个领域,根据其来源分为生物黄腐酸和矿源黄腐酸(mineral fulvic acid,MFA).国内外关于MFA在农业中的应用报道较多,如作为抗逆诱导剂、土壤改良修复剂[1]、农药降解剂[2]、天然有机肥料和肥料增效剂[3]等.研究表明:小麦越冬前适期喷施MFA可以提高叶片游离脯氨酸、可溶性糖和蔗糖的含量,降低细胞质膜透性[4];在低温胁迫下,MFA可提高油菜幼苗超氧化物歧化酶、过氧化氢酶的活性和抗坏血酸含量,从而提高抗寒性,维护细胞的生理功能[5].
甜椒(Capsicum frutescens L.var.grossum Bailey)具有丰富的营养,在我国蔬菜栽培上具有重要地位.甜椒原产于热带,属于喜温作物,大多数研究者偏重于甜椒抗寒性的研究[6-7].但甜椒在生长发育的过程中,当外界气温超过35℃时,其生育进程就会受到影响.近年来,随着气候温室效应的加剧,高温天气日益增多,且在我国长江以南地区因夏季酷热,使得温室和大棚甜椒夏秋栽培的难度越来越大,即使是露地栽培也会造成产量锐减、品质下降,影响甜椒种植效益的最大发挥,因此,有关甜椒耐热性的研究也日益受到重视.目前有关MFA对甜椒抗高温的研究尚未见报道,为了适应夏秋茬甜椒栽培的需要,本试验研究MFA对提高甜椒幼苗生长和抗热性的作用,旨在为MFA在甜椒及其他茄果类蔬菜上的抗热性应用提供参考.
1 材料与方法
1.1 材料
MFA由中国农业大学环境微生物实验室提供,为褐煤经微生物降解后的产物,经红外光谱分析,其特征吸收峰与河南巩县MFA的吸收光谱[8]相符.
甜椒供试品种为“中椒105”,由福建超大现代种业有限公司提供,为中国农业科学院蔬菜花卉研究所育成的中早熟甜椒一代杂种,该品种抗烟草花叶病毒.
1.2 材料培养与处理
试验于超大现代农业集团福州黄山高科技试验示范农场的智能控制温室内进行.种子用高锰酸钾1200倍液浸泡20 min,洗净后在恒温30℃下催芽,挑取露白种子播于盛有已消毒细砂的72孔聚乙烯塑料盘.待长出真叶后,每隔2 d用山崎研制的甜椒营养液(含354 mg·L-1硝酸钙、607 mg·L-1硫酸钾、96 mg·L-1磷酸二氢铵、185 mg·L-1硫酸镁,其他微量元素按无土栽培通用配方配制)浇灌.
待第4片真叶完全展开时,挑取整齐一致的幼苗,移栽至直径6 cm的方形小花盆中.移栽1周后,分别用蒸馏水(空白对照),50、175、500和1750 mg·L-1MFA灌根,每处理60株,每株灌10 mL.甜椒在常温(25-30℃)下生长1周后,于40℃下进行高温胁迫处理6 h,取样,进行各种生理生化指标的测定.
1.3 基本形态指标的测定
株高和节间长度用直尺测量;茎粗用游标卡尺测量;鲜重用电子天平称量,将待测植株冲洗干净,用滤纸吸干表面水分,分为地上部、侧根及整株,每组取10株进行测量.
1.4 生理生化指标的测定
分别取距生长点第二片完全展开叶测定各种生理生化指标.丙二醛(malondialdehyde,MDA)含量参照李合生[9]的方法测定;相对电导率参照 Lutts et al[10]的方法测定;H2O2含量参照 Verma et al[11]的方法测定发生速率参照郑炳松[12]的方法测定;可溶性蛋白含量参照邹琦[13]的考马斯亮蓝G250染色法测定;抗氧化酶液参照李忠光等[14]和Kuk et al[15]的方法提取;超氧化物歧化酶(superoxide dismutase,SOD)活性参照 Mishra et al[16]和 Dhindsa et al[17]的方法测定;过氧化氢酶(catalase,CAT)活性参照李合生[9]的方法测定;过氧化物酶(peroxidase,POD)活性参照Tatiana et al[18]的方法测定.测定时每处理重复3次,每重复测定3次.
1.5 数据处理
利用Excel 2003软件对所有数据进行统计分析,计算平均值±标准误差,并绘制图表;利用SPSS 13.0软件Duncan's新复极差法进行多重比较和差异显著性分析.
2 结果与分析
2.1 MFA对甜椒幼苗生长的影响
2.1.1 对幼苗地上部与地下部生长的影响 由图1可知,适宜含量的MFA对甜椒幼苗的生长有明显的促进作用,随着MFA含量的升高,这种促进效果也更加显著.其中,500 mg·L-1MFA处理与对照相比,显著促进根部和地上部的生长,株高增高12.22%,全株鲜重增加24.90%,茎重和侧根鲜重分别增加19.21%和48.87%,提高根茎比.其他含量处理与对照的差异不显著.
2.1.2 对幼苗子叶上第一和第二节间生长的影响 子叶上第一和第二节间是甜椒幼苗生长最旺盛的部分,是极易受到高温伤害的部位.图2表明,500 mg·L-1MFA处理可显著提高第二节间的长度、直径和鲜重,分别比对照增加28.46%、8.19%和48.19%,而第一节间的直径和鲜重也分别比对照增加7.73%和15.43%,但第一节间的长度没有差异.通过对第一和第二节间生长的促进,从而提高地上部的生长势,增强抗高温伤害的能力.
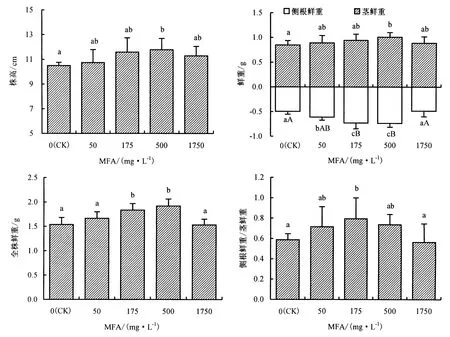
图1 MFA对甜椒幼苗地上部和地下部生长的影响Fig.1 The effect of MFA on the growing of over ground and underground sweet pepper seedlings
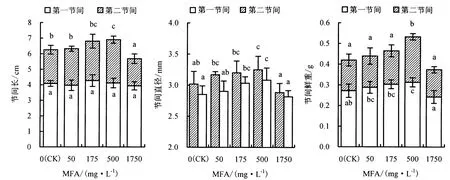
图2 MFA对甜椒幼苗子叶上第一和第二节间长度、直径和节间鲜重的影响Fig.2 The effect of MFA on the length,diameter and fresh weight of the first and second internode of sweet pepper seedlings
2.2 MFA对甜椒幼苗叶片细胞质膜的影响
高温逆境会对植物的细胞膜结构和功能产生损伤,使膜透性增加,胞内电解质外渗[19],提高相对电导率.由图3可知,在高温胁迫下,MFA处理后甜椒幼苗叶片的相对电导率显著低于对照,50、175、500和1750 mg·L-1MFA 处理的相对电导率分别由对照的78.56%降低至52.37%、49.12%、43.70%和60.38%.表明适宜含量的MFA可有效减缓高温胁迫对甜椒幼苗叶片细胞质膜的伤害.
MDA含量的增加是膜脂过氧化和膜损伤加剧的表现,其含量的高低可反映细胞膜脂过氧化的程度.由图3可知,在高温胁迫下,MFA处理可显著降低甜椒幼苗叶片的MDA含量,但随着MFA含量的增加呈现先下降后上升的趋势,其中以500 mg·L-1MFA处理的效果最好,MDA含量比对照降低29.74%.表明适宜含量的MFA处理可减缓甜椒幼苗叶片的膜质过氧化程度.
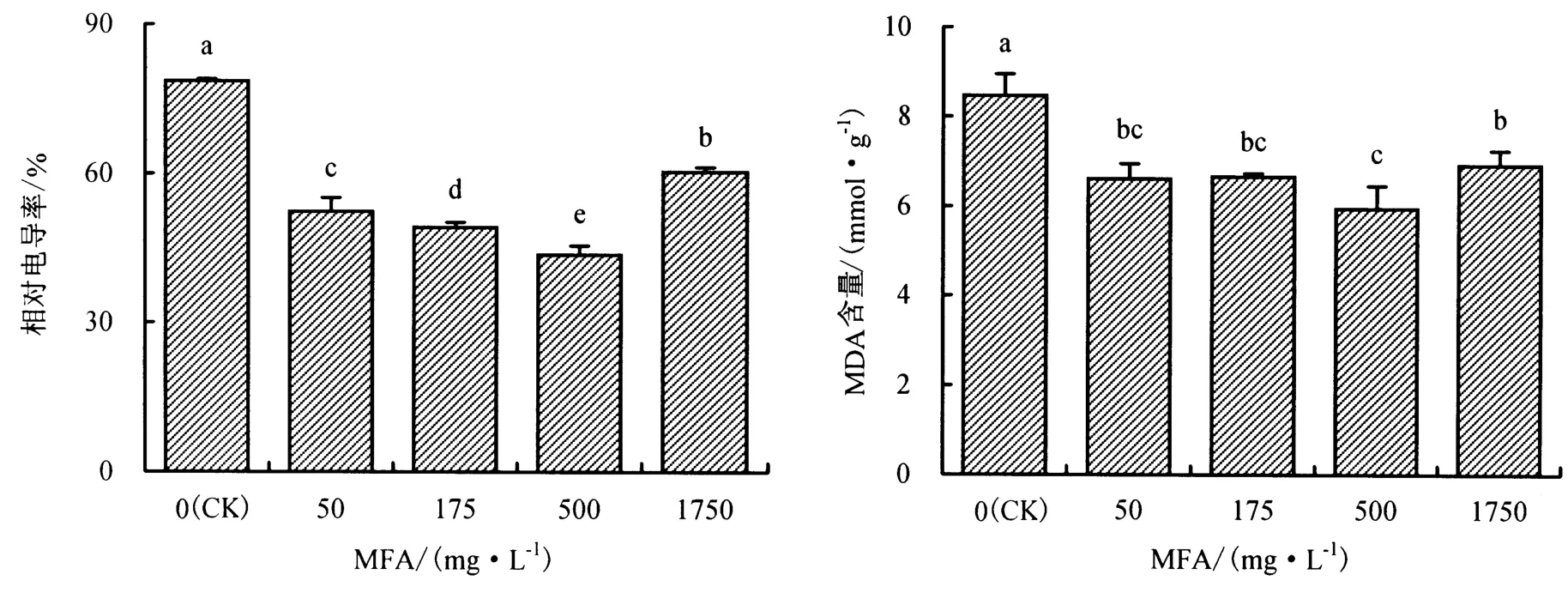
图3 MFA对甜椒幼苗叶片细胞相对电导率和MDA含量的影响Fig.3 The effect of MFA on the relative conductivity and MDA accumulation in the leaf cells of sweet pepper seedlings
2.3MFA对甜椒幼苗叶片产生速率和H2O2含量的影响
由图4可知,高温胁迫下,MFA处理可显著降低甜椒幼苗叶片中的产生速率,且不同含量处理产生的效果不同.50、175、500和1750 mg·L-1MFA处理的产生速率分别比照降低28.05%、38.36%、39.30% 和 12.80%,差异均达显著水平,但 175、500 mg·L-1处理间的差异不显著,而 1750 mg·L-1处理的产生速率有增高的趋势.可见,MFA处理能够有效控制高温胁迫下甜椒幼苗叶片中的产生速率,从而减少对细胞的伤害.
植物在遭遇逆境时,其体内活性氧产生与清除的平衡首先被打破,累积的活性氧可加剧膜脂过氧化和膜蛋白的聚合,从而引起细胞质膜的伤害及生理生化变化,这些伤害与H2O2的产生有关[20-21].由图4可知,50、175和500 mg·L-1MFA处理显著降低甜椒幼苗叶片中H2O2的含量,分别比对照降低21.92%、41.72%和36.76%,而1750 mg·L-1MFA处理增加H2O2含量.表明低含量的MFA处理可有效降低高温胁迫下甜椒幼苗叶片因H2O2累积而引起的质膜伤害.
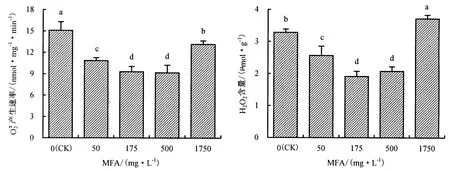
图4MFA对甜椒幼苗叶片产生速率和H2O2累积的影响Fig.4The effect of MFA on the accumulation of active oxygenand H2O2in the leaf cells of sweet pepper seedlings
2.4 MFA对甜椒幼苗叶片抗氧化酶活性的影响
由图5可知,在高温胁迫下,随着MFA含量的增大,甜椒幼苗叶片的CAT活性表现出不同的变化趋势.50、175和500 mg·L-1MFA 处理的 CAT活性分别比对照提高60.77%、87.61%和74.49%,差异均达显著水平.
由图5可知,在高温胁迫下,不同含量MFA处理均可有效提高甜椒幼苗叶片的POD活性,50、175、500 和1750 mg·L-1处理的 POD 活性分别比对照提高26.04%、72.85%、122.08%和39.29%,差异均达显著水平.但从趋势上看,随着MFA含量的增大,POD活性逐步提高,但当MFA含量达到1750 mg·L-1时,POD活性提高的程度呈现下降的趋势.可见,在高温胁迫下,MFA处理可提高甜椒幼苗叶片的POD活性,但不同含量处理的效果不一样.
由图5可知:在高温胁迫下,50、175和500 mg·L-1MFA处理的甜椒幼苗叶片的SOD活性分别比对照提高40.62%、34.87%和16.27%,差异均达显著水平;而1750 mg·L-1处理的SOD活性与对照间的差异不显著.表明在高温胁迫下,适宜含量的MFA处理可有效提高甜椒幼苗叶片中的SOD活性,以实现对和HO的清除,MFA含量太高时,SOD活性反而会降低.22
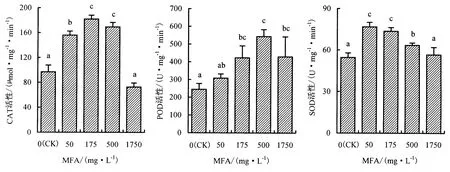
图5 MFA对甜椒幼苗叶片CAT、POD和SOD活性的影响Fig.5 The effect of MFA on the activity of CAT,POD and SOD in the leaf cells of sweet pepper seedlings
3 结论与讨论
3.1 MFA促进甜椒幼苗生长的调控
大量研究表明,MFA对植物的生长具有显著的促进作用[22-23,5].本试验结果表明:MFA可促进甜椒幼苗地上部和根系的生长,其中以500 mg·L-1MFA处理的效果最明显,株高和全株鲜重分别比对照提高12.22%和24.90%;MFA处理可极显著地增加侧根和茎的鲜重,提高根茎比,侧根鲜重比对照增加48.87%,达到极显著水平,侧根的发达表明植物的根系活力较强.高丽红等[24]认为,较高的根系活力可保证根系对水分和养分的吸收,有利于维持地上部细胞分裂素和赤霉素的合成能力,通过激素水平调节蛋白质、核酸代谢以缓解地上部受到的伤害.根系活力一般与植物的耐热性呈正相关[25].本试验中,MFA提高甜椒幼苗侧根的鲜重相应地提高根系活力,从而减缓地上部的高温伤害;MFA对茎部生长的影响主要通过调控子叶上第一和第二节间的生长实现,由于施药时正处于第二节间伸长时期,500 mg·L-1MFA处理显著地促进第二节间的生长,从而增加株高和茎重,增强地上部的生长势,提高植株抗高温伤害的能力.
3.2 高温胁迫下MFA对甜椒幼苗叶片细胞质膜伤害的调控
细胞膜是细胞与环境进行物质交换的主要通道,对维持细胞的微环境和正常代谢起重要作用,其主要组成成分是蛋白质和脂类.由于细胞膜系统较为敏感,在高温胁迫下会首先受到伤害[26],细胞膜损伤会导致膜透性增大,电解质外渗,提高电解质渗透率.电解质渗透率越高,则叶片受损越严重.此外,高温对细胞膜的伤害还表现在膜脂过氧化上,最后造成脂质过氧化产物MDA的积累.在逆境下,MDA在细胞中的积累常引起细胞膜功能紊乱,MDA含量的增加是高温胁迫下植物细胞受损伤的直接原因,是反应质膜伤害程度的重要指标.本试验结果表明,在高温胁迫下,不同含量MFA处理均显著降低甜椒幼苗叶片相对电导率和MDA的累积,保护质膜结构,降低细胞质膜透性,减少细胞电解质的外渗,维护质膜的热稳定,提高甜椒的抗高温胁迫能力,从而减轻高温胁迫对幼苗的伤害.不同含量MFA处理对质膜热稳定的保护效果不同,其中以500 mg·L-1MFA的处理效果最好.
3.3高温胁迫下MFA对甜椒幼苗叶片细胞和H2O2的调控
本试验中,在高温胁迫下不同含量MFA处理对甜椒幼苗叶片抗氧化酶活性的诱导程度是不同的.随着MFA含量的增大,CAT和POD的活性显著增加,但当MFA含量达到1750 mg·L-1时,这两种酶的活性开始下降,这也直接导致和H2O2含量的上升,其中,H2O2含量显著高于对照,造成对细胞脂膜的伤害.另外,从SOD活性随着MFA含量的变化来看,低含量时活性高,高含量时活性低,SOD活性呈逐渐下降的趋势.表明在高温胁迫下,低含量MFA主要通过诱导CAT和SOD的活性来清除和H2O2,而较高含量的MFA可同时诱导SOD、CAT和POD的活性,通过三者协调来有效清除和H2O2,维持细胞内代谢和质膜的热稳定;但当MFA含量达到一定时,则对抗氧化酶的诱导不起作用.
综上所述,适宜含量的MFA处理对甜椒幼苗的生长具有显著的促进作用.与对照相比,500 mg·L-1MFA处理提高幼苗的株高和鲜重,促进侧根和子叶上节间的生长,提高根茎比和根系活力,有利于营养物质的吸收、合成和运输,对培育壮苗起重要作用.同时在高温胁迫下,MFA处理对甜椒幼苗的耐热性有显著的诱导效应,显著提高SOD、CAT和POD的活性,从而更加有效地清除植株体内的H2O2,以减轻高温胁迫造成的伤害,表现出相对电导率和MDA含量的下降.从不同含量MFA处理下甜椒幼苗所表现出耐热性的生理生化指标上看,为了保证MFA的应用效果,可以初步确定MFA的适宜含量为175-500 mg·L-1.
从MFA对甜椒幼苗生长及耐热性的调控在外部形态和代谢水平上的总体表现来看,不同含量MFA的调控效果并不相同,本试验以500 mg·L-1的处理效果较好,但生产上的最适含量还需要进一步筛选.同时,由于品种的抗热性不同,在高温胁迫下其活性氧代谢的表现也不相同,MFA在不同品种上的应用效果还需进一步验证.
[1]LUO D,YU Q W,YIN H R,et al.Humic acid bonded silica as a novel sorbent for solid phase extraction of benzo a pyrene in edible oils[J].Anal Chim Acta,2007,588(2):261-267.
[2]SALVESTRINI S,CAPASSO S,IOVINO P.Catalytic effect of dissolved humic acids on the chemical degradation of phenylurea herbicides[J].Pest Management Science,2008,64:768-774.
[3]YE R,WRIGHT A L,MO CRAY J M,et al.Sulfur-induced changes in phosphorus distribution in Everglades Agricultural Area soils[J].Nutr Cycl Agroecosyst,2009,10:1007-1015.
[4]朱遐龄,甘吉生,王雁.抑制蒸腾剂黄腐酸对冬小麦抗寒生理的影响[J].北京农业科学,1995,13(4):20-21.
[5]程扶玖,杨道麒.黄腐酸对油菜种子萌发、氮素吸收及抗寒性的生理效应[J].安徽农业大学学报,1995,22(2):123-128.
[6]徐福乐,罗立津,高灿红.植物生长调节剂对甜椒的抗寒性诱导效应研究[J].农药学学报,2011,13(1):33-39.
[7]陈发河,张唯一,吴光斌.高温处理后甜椒果实对低温胁迫的生理反应[J].园艺学报,1994,21(4):351-356.
[8]袁红莉,陈文新.微生物降解生产黄腐酸方法:中国,02158189.4[P].2006-01-11.
[9]李合生.植物生理生化实验原理与技术[M].北京:高等教育出版社,1999:195.
[10]LUTTS S,KINET J M,BOUHARMONT J.NaCl induced senescence in leaves of rice(Oryza sativa L.)cultivars differing in salinity resistance[J].Annals of Botany,1996,78(3):389-398.
[11]VERMA S,MISHRA S N.Putrescine alleviation of growth in salt stressed Brassica juncea by inducing antioxidative defense system[J].Journal of Plant Physiology,2005,162:669-677.
[12]郑炳松.现代植物生理生化研究技术[M].北京:气象出版社,2006:267-268.
[13]邹琦.植物生理学实验指导[M].北京:中国农业出版社,2000:110-130.
[14]李忠光,李红鸿,杜朝昆,等.在单一提取系统中同时测定五种植物抗氧化酶[J].云南师范大学学报,2002,22(6):44-48.
[15]KUK Y I,SHIN J S,BURGOS N R,et al.Antioxidative enzymes offer protection from chilling damage in rice plants[J].Crop Science,2003,43(6):2109-2117.
[16]MISHRA H P,FRIDOVICH I.The role of superoxide anion in auto-oxidation of the epinephrine and a sample assay for superoxide dismutase[J].Journal of Biological Chemistry,1972,247(10):3170-3175.
[17]DHINDSA R S,DHINDSA P P,THORPE T A.Leaf senescence:correlated with increased levels of membrane permeability and lipid peroxidation,and decreased levels of superoxide dismutas and catalase[J].Journal of Experimental Botan,1981,32(1):93-101.
[18]TATIANA Z,YAMASHITA K,MATSUMOTO H.Iron deficiency induced changes in ascorbate content and enzyme activities related to ascorbate metabolism in cucumber roots[J].Plant and Cell Physiology,1999,40:273-280.
[19]TAIZ L,ZEIGER E.Plant Physiology[M].宋纯鹏,王学路,译.北京:科学出版社,2009:384-550.
[20]吴旭红,罗新义.镉胁迫对苜蓿膜脂过氧化的影响及保护系统的应答[J].中国草地,2005,27(3):37-40.
[21]CHENG Y L,SONG C P.Hydrogen peroxide homeostasis and signaling in plant cells[J].Sci China C Life Sci,2006,49(1):1-11.
[22]朱京涛,曹霞,王学东.生物黄腐酸对番茄幼苗发育及产量品质的影响[J].安徽农业科学,2009,37(3):964-965,968.
[23]杨轶囡,窦森.风化煤FA对玉米幼苗生长的影响[J].吉林农业大学学报,2002,24(5):78-80.
[24]高丽红,李式军,裴孝伯.生菜根系活力对缓解地上部高温伤害的机理[M]∥侯喜林.园艺学进展.南京:东南大学出版社,1998:388-395.
[25]徐剑锋.甜椒耐热机理及热胁迫下生理生化变化的研究[D].福州:福建农林大学,2003.
[26]HASEGAWA P M,BRESSAN R A,ZHU J K,et al.Plant cellular and molecular responses to high salinity[J].Annu Rev Plant Physiol Plant Mol Biol,2000,51:463-499.
[27]蒋明义,荆家海.植物体内羟自由基的产生及其与脂膜氧化作用启动的关系[J].植物学报,1993,4(9):669-675.
[28]DESIKAN R,REYNOLDS A,HANCOCK J T,et al.Harpin and hydrogen peroxide both initiate programmed cell death but have differential effects on defense gene expression in Arabidopsis suspension cultures[J].Biochem J,1998,30(3):115-120.
[29]陈少裕.膜脂过氧化与植物逆境胁迫[J].植物学通报,1989,6(4):211-217.

