白背飞虱体内RNA干扰技术体系的建立
贾东升,任堂雨,陈红燕,魏太云,谢联辉
(福建农林大学植物病毒研究所/福建省植物病毒学重点实验室,福建福州350002)
白背飞虱(Sogatella furcifera Horvath)属同翅目(Homoptera)飞虱科(Delphacidae),是我国水稻作物上发生严重的稻飞虱之一[1-2].白背飞虱不仅可以通过取食直接危害水稻,而且可以高效携带并传播南方水稻黑条矮缩病毒(Southern rice black-streaked dwarf virus,SRBSDV)[3],给我国水稻生产造成了重大损失.由于白背飞虱具有远距离迁飞习性[2],SRBSDV随白背飞虱的迁飞扩散到我国南方稻区.白背飞虱的迁徙性和病毒传播介体的特性,使得对其防治十分困难,因此急需发展新的有效的防治方法控制白背飞虱的大规模暴发和阻断病毒的传播.
RNA干扰(RNA interference,RNAi)现象是指利用同源的dsRNA特异地降解靶基因mRNA的表达,引起基因功能缺失[4-5].1998年RNAi技术首次在线虫上成功应用[4],目前已广泛用于植物、动物和微生物等基因功能的研究方面.近年来,大量的研究证明通过摄取dsRNA诱导的RNAi技术是一种新的可行的农业病虫害防治手段.例如,将棉铃虫参与棉毒素解毒的P450基因转入棉花可以降低棉铃虫对棉酚的耐性,从而使棉铃虫生长缓慢,甚至死亡[6];将源自黄曲条跳甲嗅觉感应器Or基因的dsRNA注射到黄曲条跳甲蛹内,可以削弱其对寄主植物的取食倾向性[7];通过膜饲喂法饲喂源自褐飞虱海藻糖磷酸化合成酶基因(TPS)的dsRNA可作为防治褐飞虱的有效手段[8].Shimizu et al[9]研究发现,通过转基因水稻表达水稻条纹病毒(Rice stripe virus,RSV)pC3和pC4基因的dsRNA片段可以高效抵御病毒的侵染;郑海刚等[10]研究表明,利用诱导提取的源于黄瓜绿斑驳花叶病毒(Cucumber green mottle mosaic virus,CGMMV)运动蛋白的dsRNA可以抑制CGMMV的侵染.但目前还没有在白背飞虱体内进行RNAi试验的相关报道.因此,本研究将利用源自白背飞虱肌动蛋白(Actin)基因的dsRNA探索适合于白背飞虱的RNAi体系,以期为应用RNAi技术防治白背飞虱的发生和病毒病的流行奠定基础.
1 材料与方法
1.1 材料
白背飞虱采自福建农林大学水稻田,并饲养于温室中(25℃)的水稻幼苗上.成虫期的白背飞虱在水稻幼苗上产卵3 d,产卵后10-12 d孵出1龄若虫,将生长至2龄的若虫用于试验.
1.2 白背飞虱Actin基因的扩增
通过Trizol法[11]提取白背飞虱总RNA,用M-MLV Reverse Transcriptase反转录试剂盒(Promega,美国)合成单链cDNA.根据昆虫Actin基因的高度保守性,以褐飞虱Actin同源基因序列(GenBank登录号:EU179847.1)设计引物ActinF/R(表1).以白背飞虱cDNA为模版扩增Actin基因,经1%琼脂糖凝胶电泳检测后回收目标产物,并将其克隆到pEASY-Blunt载体(Transgen公司,北京)上,将阳性质粒送华大基因公司测序.

表1 本研究所用引物1)Table 1 Primers used in this study
1.3 dsRNA 的合成
根据已获得的白背飞虱Actin基因序列设计合成dsRNA的引物Actin-T7F/R,以绿色荧光蛋白GFP基因的序列(GenBank登录号:AF324407.1)设计GFP基因的dsRNA引物GFP-T7F/R(表1).参照T7 Ribo-MAXTMExpress RNAi System试剂盒(Promega,美国)说明书操作,先扩增5'端均含有T7启动子序列的DNA片段,随后以获得的DNA片段为模板,用T7转录酶进行体外转录以合成目的基因的dsRNA,经纯化和浓度测定后的dsRNA用于白背飞虱的饲喂.
1.4 人工饲料的筛选
根据目前已有的人工饲料配方,如 10% 蔗糖、D-97[12]、MMD-1、MED-1、MED-4[13],配置不同的人工饲料并饲喂白背飞虱若虫,同时以饲喂蒸馏水作为对照,通过观察昆虫的取食倾向性找到最佳的人工饲料.
1.5 dsRNA稳定性的检测
为了明确dsRNA在饲喂过程中的完整性,先将dsRNA与筛选的人工饲料的混合液分别放置0、6、12、18、24 h,然后收集含有dsRNA的混合液,通过琼脂糖凝胶电泳分析dsRNA在人工饲料中的降解情况.
1.6 dsRNA 的饲喂
将体外合成的dsRNA与人工饲料混合后饲喂白背飞虱若虫,饲喂方法参照Dong et al[14]并做调整.具体方法:取直径3 cm、长5 cm的塑料透明管,先将管的一端用单层Parafilm M膜包裹,将约100头的2龄白背飞虱装入管中,再将另一端用双层Parafilm M膜包裹,dsRNA和人工饲料的混合液则添加在双层膜间供昆虫刺吸式取食.将组装后的小管置于有固定湿度和光照的养虫笼内.为了明确合适的dsRNA饲喂浓度,将体外合成的dsRNA与人工饲料配制成不同终浓度饲喂2龄白背飞虱若虫,同时以人工饲料饲喂2龄白背飞虱作为对照.24 h后收集白背飞虱虫体,用于检测(RT-qPCR)Actin基因的干扰效果.
1.7 RT-qPCR 检测技术
根据白背飞虱Actin基因序列设计RT-qPCR引物qActinF/R,同时以组成型表达基因18S(GenBank登录号:AB625607)作为内参基因设计引物q18SF/R(表1).提取收集到的昆虫样本总RNA,用oligdT18引物反转录获得cDNA.参照GoTaq qPCR Master Mix试剂盒(Promega公司,美国)操作说明配制反应体系,每个样品设3个重复,在Mastercycler realplex4实时定量PCR仪(Eppendorf,德国)上检测目标基因的表达量.采用 2-ΔΔCT算法[15]分析试验数据,其中,ΔΔCT=(CT,Actin-CT,18S)x-(CT,Actin-CT,18S)ck.CT,Actin和 CT,18S分别是目标基因Actin和内参基因18S的CT值;x和ck分别表示dsRNA饲喂的不同时间点和对照.应用DPS 7.05软件对不同处理条件下白背飞虱Actin基因的表达量进行差异显著性分析.
1.8 饲喂Actin的dsRNA对白背飞虱存活率影响的测定
根据已确定的人工饲料和合适的Actin基因dsRNA(dsActin)浓度饲喂2龄白背飞虱若虫,同时以饲喂GFP基因dsRNA(dsGFP)或人工饲料的处理为对照.每个处理饲喂100头虫,每个处理重复3次.每天更换1次人工饲料混合液,连续观察3 d,并统计白背飞虱的死亡率和虫体的变化.
2 结果与分析
2.1 白背飞虱Actin基因的扩增结果
琼脂糖凝胶电泳检测结果表明,RT-PCR产物约为1131 bp,与预期结果一致(图1).序列测定及比对结果表明,白背飞虱Actin基因的核酸序列与褐飞虱Actin具有高度的同源性,同源率为94.5%(图2).

图1 白背飞虱Actin基因的RT-PCR产物Fig.1 RT-PCR products of Actin gene of WBPH

图2 白背飞虱与褐飞虱Actin基因的核酸序列比对Fig.2 Aligment of Actin genes of WBPH and brown planthopper(BPH)
2.2 人工饲料的筛选及dsRNA的稳定性
通过观察发现,饲喂1 d后白背飞虱在添加D-97人工饲料的Parafilm M膜上刺吸产生的小泡最多,其次分别为MMD-1、MED-1、MED-4和10%蔗糖,饲喂蒸馏水的处理组几乎未取食.因此,选择 D-97为合适的人工饲料.
琼脂糖凝胶电泳检测结果表明,dsRNA放置24 h仍然保持较好的完整性(图3).因此,确定dsRNA混合液饲喂昆虫的时间为24 h.
2.3 dsActin对白背飞虱体内Actin基因表达的抑制作用
RT-qPCR检测结果表明,与饲喂人工饲料的对照组相比,饲喂 dsGFP 和 0.05 μg·μL-1dsActin 的处理组的Actin基因表达量没有明显差异.饲喂浓度为0.10、0.20、0.30、0.50 和1.00 μg·μL-1的处理组的Actin基因表达量分别是对照组的75%、55%、49%、27%和22%(图4).这说明饲喂dsActin可显著抑制Actin基因在白背飞虱体内的表达.结合试验成本和干扰效果,选择0.50 μg·μL-1dsRNA 为最适浓度.
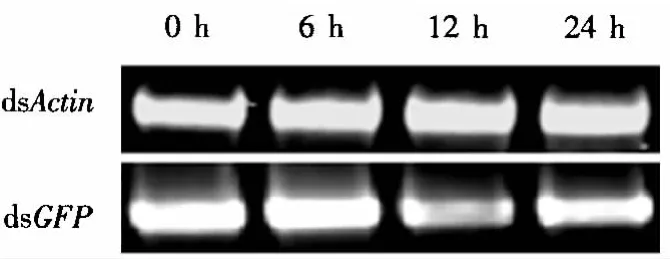
图3 dsRNA在人工饲料中的稳定性Fig.3 The stability of dsRNA in artificial diet

图4 不同浓度dsRNA处理下Actin基因的表达量Fig.4 The repression of Actin genes by treatment with different concentrations of dsRNAs
2.4 dsActin对白背飞虱存活率的影响
观察发现,饲喂GFP基因dsRNA或饲喂人工饲料均会对白背飞虱有一定的影响,饲喂3 d后的死亡率分别为22%和17%;而饲喂Actin基因dsRNA的若虫死亡率在第1、2、3天时分别达到43%、80%、89%(图5A).同时,饲喂Actin基因dsRNA后存活的若虫生长缓慢,个体小于饲喂GFP基因dsRNA和人工饲料D-97(Buffer)的对照组(图5B).这说明dsActin成功干扰了白背飞虱Actin基因的表达,并直接影响其生长发育.

图5 dsRNA对白背飞虱生长发育及存活率的影响Fig.5 Effects of dsRNA(0.50 μg·μL -1)on the growth and survival rate of WBPH
3 讨论
目前,将外源 dsRNA 导入昆虫体内的方式有多种,如注射法[16]、饲喂法[13,17]、浸泡法[18]、转基因植物表达后昆虫取食等[19].针对不同种昆虫所适用的方法不同.用于褐飞虱的微针注射法[20]也适用于白背飞虱,但与膜饲喂法相比,昆虫的死亡率高,且操作复杂.膜饲喂法已成为一种方便、经济、有效的dsRNA摄入方式,还可以保证昆虫的完整性[21].因此,本研究选择膜饲喂的方式摄入dsRNA,并且成功实现了对目的基因的干扰.此外,利用白背飞虱高效的免疫机制,通过饲喂源自SRBSDV基因的dsRNA可以研究该病毒基因的功能,也可通过种植表达病毒基因dsRNA的转基因水稻阻断白背飞虱携带SRBSDV,从而防止病毒扩散.因此,膜饲喂dsRNA有着很好的应用前景.
刺吸式口器昆虫通过膜饲喂方式取食dsRNA时,大部分dsRNA残留在膜上,只有少量的dsRNA混合液被昆虫取食,且大部分进入肠腔内的dsRNA会随粪便排出体外,只有极少部分dsRNA留在体内诱发RNAi.因此,必须通过试验摸索合适的dsRNA饲喂浓度,以保证dsRNA的有效摄入量及对目的基因表达的有效抑制作用[22].本研究饲喂不同浓度dsRNA所产生的干扰效果不同,最终选择0.50 μg·μL-1dsRNA为使用浓度,与干扰褐飞虱目的基因所使用的浓度[8,14]相同.然而,由于不同基因或同一基因不同位点dsRNA的干扰效果存在差异,针对不同基因的RNAi必须在参考已知基因dsRNA使用浓度的基础上进一步优化.
在昆虫体内dsRNA诱导的RNAi需要一定的时间.对于不同的昆虫,由于免疫机制的差异其dsRNA产生效应的时间也不同,如褐飞虱摄取dsRNA后引发RNAi效果的最短时间为2 d[17].本研究中,白背飞虱摄取dsActin后1 d即检测到目的基因的表达受抑制,表明白背飞虱体内具有高效的RNAi免疫机制.这为通过干扰控制白背飞虱生长发育基因的表达防治白背飞虱大面积发生奠定了基础.
[1]ASCHE M,WILSON M R.The delphacid genus Sogatella and related groups:a revision with special reference to rice-associated species(Homoptera:Fulgoroidea)[J].Systematic Entomology,1990,15(1):1-42.
[2]沈君辉,尚金梅,刘光杰.中国的白背飞虱研究概况[J].中国水稻科学,2003,17(增刊):7-22.
[3]ZHOU G H,WEN J J,CAI D J,et al.Southern rice black-streaked dwarf virus:a new proposed Fijivirus species in the family Reoviridae[J].Chinese Science Bulletin,2008,53(23):3677-3685.
[4]FIRE A,XU S,MONTGOMERY M K,et al.Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans[J].Nature,1998,391:806-811.
[5]HANNON G J.RNA interference[J].Nature,2002,418:244-251.
[6]MAO Y B,CAI W J,WANG J W,et al.Silencing a cotton bollworm P450 monooxygenase gene by plant-mediated RNAi impairs larval tolerance of gossypol[J].Nature Biotechnology,2007,25(11):1307-1313.
[7]ZHAO Y Y,LIU F,YANG G,et al.PsOr1,a potential target for RNA interference-based pest management[J].Insect Molecular Biology,2010,20(1):97-104.
[8]CHEN J,ZHANG D,YAO Q,et al.Feeding-based RNA interference of a trehalose phosphate synthase gene in the brown planthopper,Nilaparvata lugens[J].Insect Molecular Biology,2010,19(6):777-786.
[9]SHIMIZU T,NAKAZONO-NAGAOKA E,UEHARA-ICHIKI T,et al.Targeting specific genes for RNA interference is crucial to the development of strong resistance to Rice stripe virus[J].Plant Biotechnology Journal,2011,9(4):503-512.
[10]郑海刚,陈启建.诱导提取的dsRNA粗提液对黄瓜绿斑驳花叶病毒的抑制作用[J].福建农林大学学报:自然科学版,2011,40(4):346-350.
[11]吴凯朝,黄诚梅,李杨瑞,等.Trizol试剂法快速高效提取3种作物不同组织总RNA[J].南方农业学报,2012,43(12):1934-1939.
[12]FU Q,ZHANG Z,HU C,et al.A chemically defined diet enables continuous rearing of the brown planthopper,Nilaparvata lugens(Stål)(Homoptera:Delphacidae)[J].Applied Entomology and Zoology,2001,36(1):111-116.
[13]KOYAMA K.Artificial rearing and nutritional physiology of the planthoppers and leafhoppers(Homoptera:Delphacidae and Deltocephalidae)on a holidic diet[J].JARQ,1988,22:20-27.
[14]DONG X,ZHAI Y,ZHANG J,et al.Fork head transcription factor is required for ovarian mature in the brown planthopper,Nilaparvata lugens(Stål)[J].BMC Molecular Biology,2011,doi:10.1186/1471-2199-12-53.
[15]LIVAK K J,SCHMITTGEN T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod[J].Methods,2001,25(4):402-408.
[16]TANG B,CHEN J,YAO Q,et al.Characterization of a trehalose-6-phosphate synthase gene from Spodoptera exigua and its function identification through RNA interference[J].Journal of Insect Physiology,2010,56(7):813-821.
[17]LI X,ZHANG M,ZHANG H.RNA interference of four genes in adult Bactrocera dorsalis by feeding their dsRNAs[J].PloS ONE,2011,6(3):e17788.
[18]ZHU F,XU J,PALLI R,et al.Ingested RNA interference for managing the populations of the Colorado potato beetle,Leptinotarsa decemlineata[J].Pest Management Science,2010,67(2):175-182.
[19]PRICE D R G,GATEHOUSE J A.RNAi-mediated crop protection against insects[J].Trends in Biotechnology,2008,26(7):393-400.
[20]LIU S,DING Z,ZHANG C,et al.Gene knockdown by intro-thoracic injection of double-stranded RNA in the brown planthopper,Nilaparvata lugens[J].Insect Biochemistry and Molecular Biology,2010,40(9):666-671.
[21]LI J,CHEN Q,LIN Y,et al.RNA interference in Nilaparvata lugens(Homoptera:Delphacidae)based on dsRNA ingestion[J].Pest Management Science,2011,67(7):852-859.
[22]TIAN H,PENG H,YAO Q,et al.Developmental control of a Lepidopteran pest Spodoptera exigua by ingestion of bacteria expressing dsRNA of a non-midgut gene[J].PLoS ONE,2009,4(7):e6225.

