金丝草对Pb的富集效果及其体内Pb的存在形态
侯晓龙,刘爱琴,蔡丽平,吴鹏飞,邹显花,马祥庆
(福建农林大学林学院,福建福州350002)
土壤重金属污染已成为当前环境科学界关注的重大问题[1-2],其中,Pb污染受到普遍关注[3-4].Pb污染不仅影响植物的正常生长发育,而且还通过食物链进入人体,对人体的神经、消化、免疫系统产生危害.我国目前土壤Pb污染已经不容忽视[5-6].Pb污染的植物修复技术是一项高效、环保和低廉的治理措施,具有十分广阔的应用前景[7-8].植物修复技术的前提是发现重金属的超富集植物,本课题组前期在国内首次发现了Pb的超富集植物——金丝草(Pogonatherum crinitum),对Pb污染具有很强的耐性,达到了Pb超富集植物的标准[9-10].但目前对金丝草修复土壤Pb污染的可利用性、金丝草体内的富集和转移规律尚不清楚.
研究表明,重金属的形态不同,在植物体内的分布也有所区别,呈现的毒性大小和毒理作用也有很大差异[11].因此,对植物体内重金属的研究,不但要考虑到含量的高低,更要考虑其存在形态,才能揭示重金属作用的本质.重金属在植物体内可以多种复杂的化学形态存在,化学形态直接关系到重金属的活性、毒性、迁移能力和从基质分离的难易程度,不同形态重金属的迁移能力及其活性明显不同[12].巴戟天中的Pb以结合态存在为主,Cd以离子态形式为主[13].Pb和Cd在商陆中的存在形态以水溶性离子态形式为主[14].目前,金丝草对土壤Pb污染的修复效果及其体内Pb的存在形态尚不清楚,影响了金丝草在Pb污染土壤治理中的应用.
鉴于此,本试验以Pb超富集植物——金丝草为材料,采用室内土培胁迫试验,设计不同浓度Pb的胁迫水平,定量测定不同浓度Pb胁迫下金丝草根系和地上部分的生物量、Pb含量、存在形态及其分布,分析金丝草修复土壤Pb污染的可利用性,探讨Pb在金丝草体内的存在形态及其转移规律,旨在为金丝草在Pb污染土壤治理中的应用提供科学依据.
1 材料与方法
1.1 材料
金丝草种子采自福建尤溪铅锌矿区.种子在恒温培养箱中发芽后将幼苗小心移栽至营养袋中,继续在培养箱中培养,待幼苗长至10 cm左右时移出培养箱,供胁迫试验用.
1.2 试验设计
选用自制的直径27 cm、高30 cm的塑料桶作为培养容器.采用沙壤土作为基质,土壤风干后过5 mm的尼龙筛备用,沙壤土中的养分及主要重金属含量见表1和2.基质填充高度为27 cm(重8 kg,以干土计),3 cm为缓冲层(重1.5 kg,以干土计).根据南方铅锌矿区土壤Pb含量及分布情况,结合国家土壤环境质量评价标准,设计6个浓度 Pb胁迫处理:JH1(150 mg·kg-1)、JH2(250 mg·kg-1)、JH3(500 mg·kg-1)、JH4(1000 mg·kg-1)、JH5(1500 mg·kg-1)、JH6(2500 mg·kg-1),同时设置不加 Pb 的对照处理,每处理5个重复.用醋酸铅[(CH3COO)2Pb·3H2O]配置成60 g·L-1的Pb溶液,然后按照设计的胁迫浓度分别加入不同量的Pb溶液于相应的培养桶中.施加时用500 mL相应的Pb溶液一次性均匀浇入基质中(预试验得出500 mL可保证溶液均匀分布在土壤中而不出现渗漏).

表1 基质的养分含量Table 1 Nutrient content in substrate
2012年6月15日选择长势一致、高10 cm的金丝草幼苗,移栽到不同Pb胁迫浓度的培养桶中,每桶移栽幼苗2株,移栽时注意保持根系的自然伸展,正好处于培养桶的中心位置,然后移入温室中进行胁迫试验.缓苗7 d后测定各项指标.为保证植株生长对养分的需求,每7 d浇一次四分之一的营养液100 mL.营养液采用 Hoagland 配方,含 0.51 g·L-1KNO3、0.82 g·L-1Ca(NO3)2、0.49 g·L-1MgSO4·7H2O、0.136 g·L-1KH2PO4,调节营养液 pH 为5.5.各处理每3 d浇去离子水100 mL,保持土壤田间持水量在80%左右.
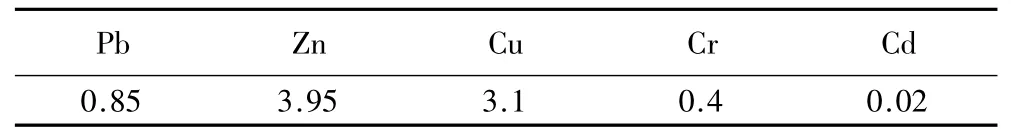
表2 基质的重金属含量Table 2 Heavy metal content in substrate mg·kg-1
2012年10月15日(种子成熟后)收获植株,分别收获地上部分和根系,将收获的根系做好标记后,先用自来水反复冲洗干净,再用去离子水冲洗3遍后备用.
1.3 指标测定
将收获的金丝草地上部分先在60℃的烘箱中杀青,然后与根系一起在80℃的烘箱中烘干至恒重,粉碎过0.5 mm的尼龙筛后分别保存,用于Pb含量及其形态的测定.
1.3.1 样品前处理 采用两步连续浸提法[15]测定植物体内重金属的形态,从高到低依次分为乙醇提取态、盐酸提取态和残渣态Pb.
乙醇提取态Pb:以80%乙醇为提取剂.称取0.4 g粉碎过的植物样品于20 mL玻璃试管中,加入10 mL乙醇提取剂于室温振荡20 h,3000 r·min-1离心10 min,收集离心液,然后在残渣中再次加入10 mL乙醇提取剂,室温振荡2 h,3000 r·min-1离心10 min,收集离心液,重复2次.将3次离心液全部收集到30 mL三角瓶中进行消煮,测定提取液中的Pb含量.
盐酸提取态Pb:以0.6 mol·L-1HCl为提取剂.在上述植物残渣中加入10 mL HCl提取剂,其余步骤与乙醇提取态Pb的相同.
残渣态Pb:盐酸提取过的残渣采用湿灰化法进行处理后测定Pb含量.
1.3.2 Pb含量测定 提取液中的Pb含量参考GB/T 7475-1987[16]的方法,采用硝酸+高氯酸法进行消煮;残渣中的Pb含量参考GB/T 13080-2004[17]的方法,采用湿灰化法消煮.用北京瑞利分析仪器公司的火焰原子吸收分光光度计(WFX-136)测定Pb含量.
1.4 数据统计
试验数据采用SPSS 13.0软件进行LSD方差分析和多重比较.
2 结果与分析
2.1 Pb胁迫对金丝草生物量的影响
由表3可知,随Pb胁迫浓度的增大,金丝草根系和地上部分的生物量及总生物量均呈先减小后增大的趋势.Pb胁迫浓度为2500 mg·kg-1时,根系生物量大于除250 mg·kg-1外的其他处理,Pb胁迫下根系的生物量均显著小于无Pb对照(P<0.05);Pb胁迫浓度为2500 mg·kg-1时,地上部分的生物量及总生物量大于除150 mg·kg-1外的其他处理.地上部分的生物量除150 mg·kg-1外的其他处理均显著小于对照(P<0.05);Pb胁迫下总生物量均显著小于对照,表明Pb胁迫对金丝草的生物量有一定的抑制作用.高浓度Pb胁迫下,金丝草仍有较大的生物量,且大于低浓度Pb胁迫处理,表明高浓度Pb胁迫对金丝草的生长有一定促进作用,加快Pb在体内的转移,这是金丝草对高浓度Pb胁迫的重要响应机制之一.
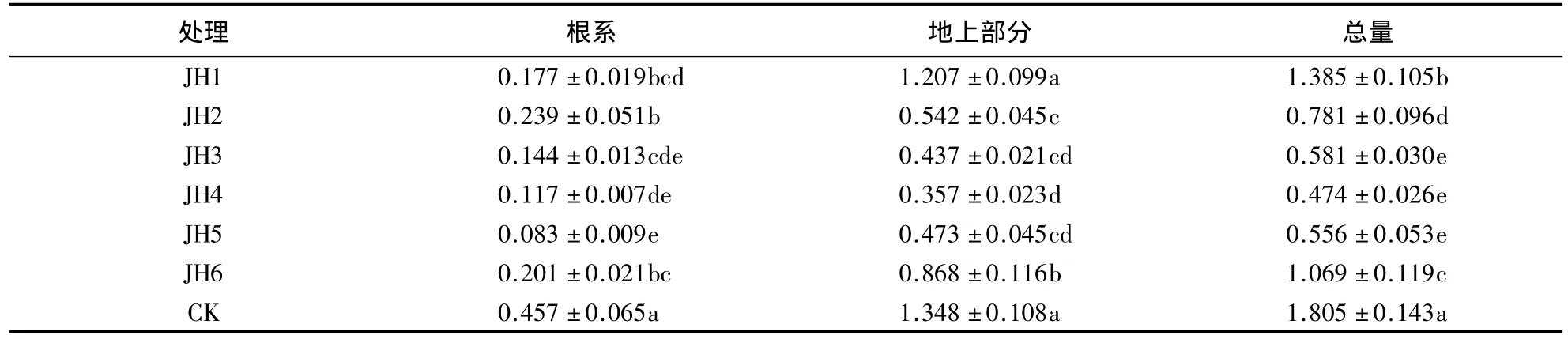
表3 Pb胁迫下金丝草根系和地上部分的生物量1)Table 3 Root and shoot biomass of P.crinitum under Pb stress condition g
2.2 Pb胁迫对金丝草体内Pb含量的影响
由表4可知,Pb胁迫下金丝草根系和地上部分的Pb含量均显著大于对照(P<0.05).随Pb胁迫浓度的增大,根系Pb含量呈先增大后减小的趋势,在Pb胁迫浓度为1000 mg·kg-1时达最大值(2928.14 mg·kg-1);随Pb胁迫浓度的增大,地上部分的Pb含量呈逐渐增大的趋势,1500和2500 mg·kg-1处理的Pb含量显著大于其他处理及对照(P<0.05),且Pb含量大于1000 mg·kg-1,超过Pb超富集植物地上部分Pb富集量的标准.金丝草对Pb的转移系数随Pb胁迫浓度的增加呈逐渐增大的趋势,2500 mg·kg-1处理的转移系数为1.153,超过Pb超富集植物转移系数的标准.表明金丝草对Pb有较强耐性,且可将大量的Pb从土壤中转移到地上部分,达到修复土壤Pb污染的目的.
2.3 Pb胁迫对金丝草根系中Pb存在形态及其分布的影响
由表5可知,随Pb胁迫浓度的增大,金丝草根系中的乙醇提取态、盐酸提取态和残渣态Pb均呈先增大后减小的趋势.Pb胁迫浓度为1000 mg·kg-1时,3种形态的Pb含量均最大;Pb胁迫下根系中不同形态的Pb含量均显著大于对照(P<0.05).由图1可知,根系中的Pb主要以盐酸提取态为主,占70.61%-85.92%,其次为残渣态Pb,乙醇提取态Pb含量最低.
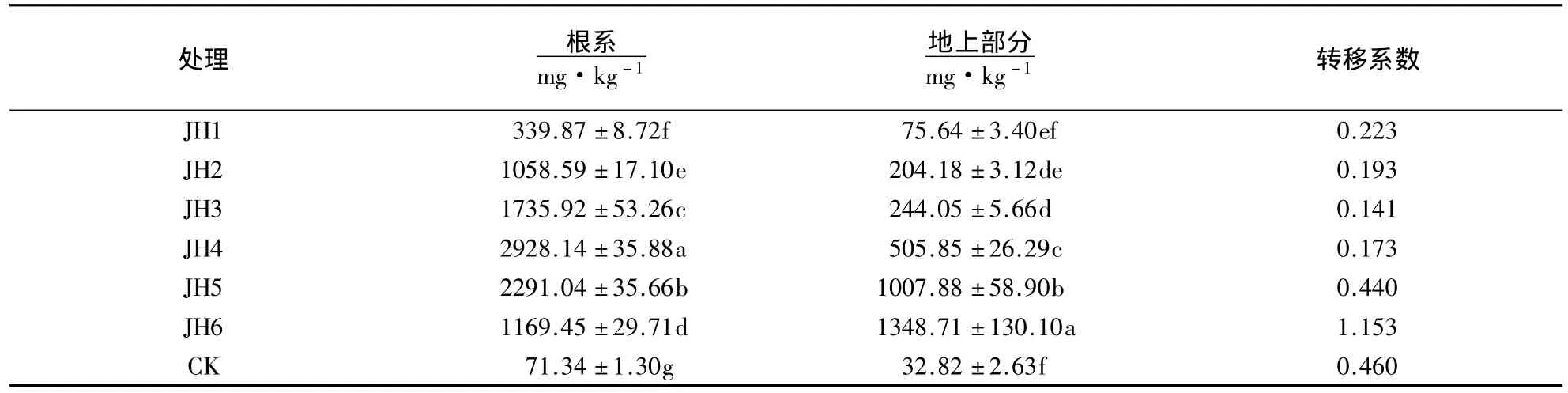
表4 Pb胁迫下金丝草体内的Pb含量1)Table 4 Pb content of P.crinitum under different Pb stress condition
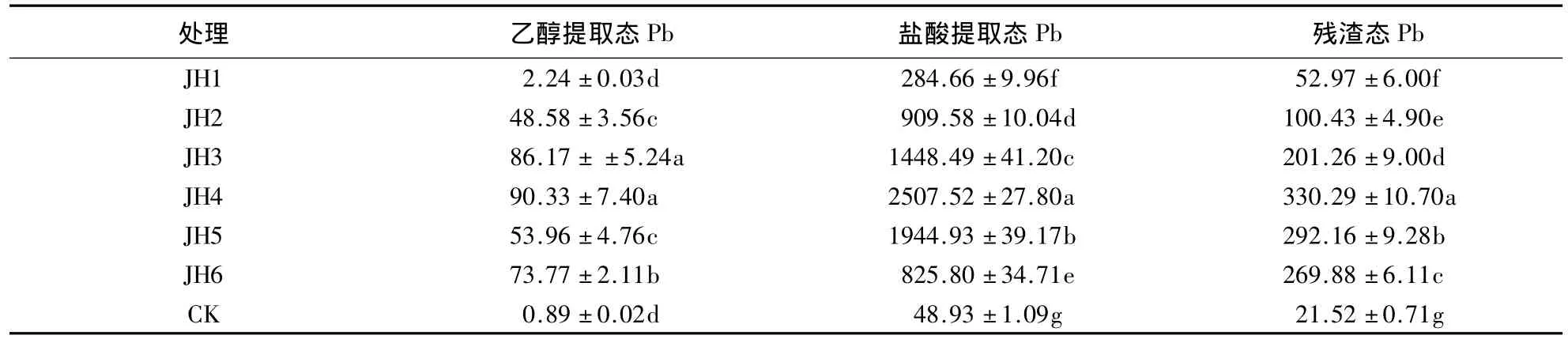
表5 Pb胁迫下金丝草根系中Pb的存在形态1)Table 5 Pb existence form in root of P.crinitum under different Pb stress condition mg·kg-1
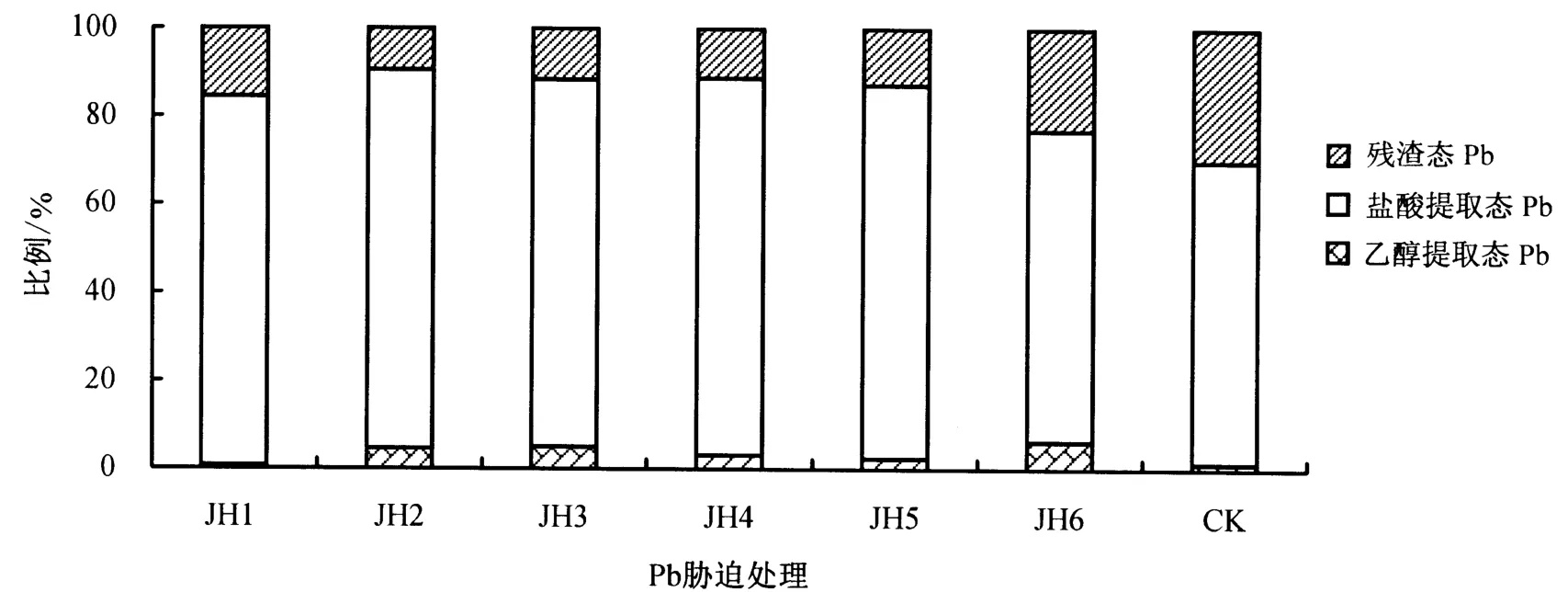
图1 Pb胁迫下金丝草根系中各提取态Pb所占比例Fig.1 Percentage of different existence form of Pb in root of P.crinitum under different Pb stress condition
2.4 Pb胁迫对金丝草地上部分Pb存在形态及其分布的影响
由表6可知,随Pb胁迫浓度的增大,金丝草地上部分乙醇提取态Pb呈先增大后减小的趋势,而盐酸提取态和残渣态Pb则呈逐渐增大的趋势.Pb胁迫浓度小于1000 mg·kg-1处理的乙醇提取态Pb、150 mg·kg-1处理的盐酸提取态Pb和小于250 mg·kg-1处理的残渣态Pb含量均与对照无显著差异,但2500 mg·kg-1处理的地上部分不同形态Pb含量均显著大于其他处理及对照(P<0.05).由图2可知:Pb胁迫下,地上部分的Pb主要以盐酸提取态为主,占79.04%-94.37%;低浓度(150和250 mg·kg-1)Pb胁迫下,残渣态Pb含量大于乙醇提取态Pb,其他处理则相反.
金丝草根系和地上部分Pb的存在形态及分布表明:除150 mg·kg-1处理的乙醇提取态Pb、2500 mg·kg-1处理的盐酸提取态Pb外,其他处理的乙醇提取态、盐酸提取态和残渣态Pb含量均表现为根系大于地上部分;根系和地上部分的Pb均以盐酸提取态Pb为主,根系占70.61%-85.92,地上部分占79.04%-94.37%.表明Pb胁迫下,金丝草体内的Pb主要以有机酸盐、果胶酸盐、蛋白质结合态为主,降低其活性和迁移能力,减小Pb对自身的毒害.
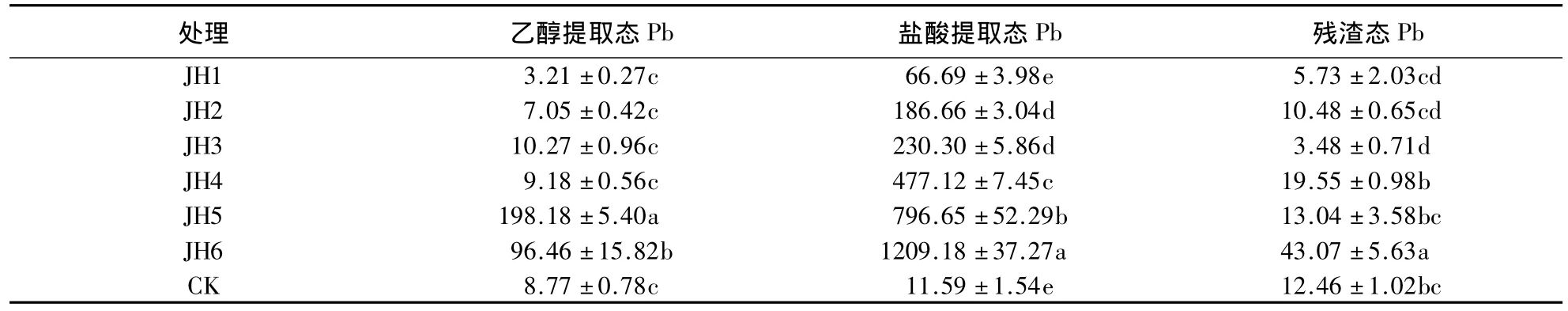
表6 Pb胁迫下金丝草地上部分Pb的存在形态1)Table 6 Pb existence form in shoot of P.crinitum under different Pb stress condition mg·kg-1
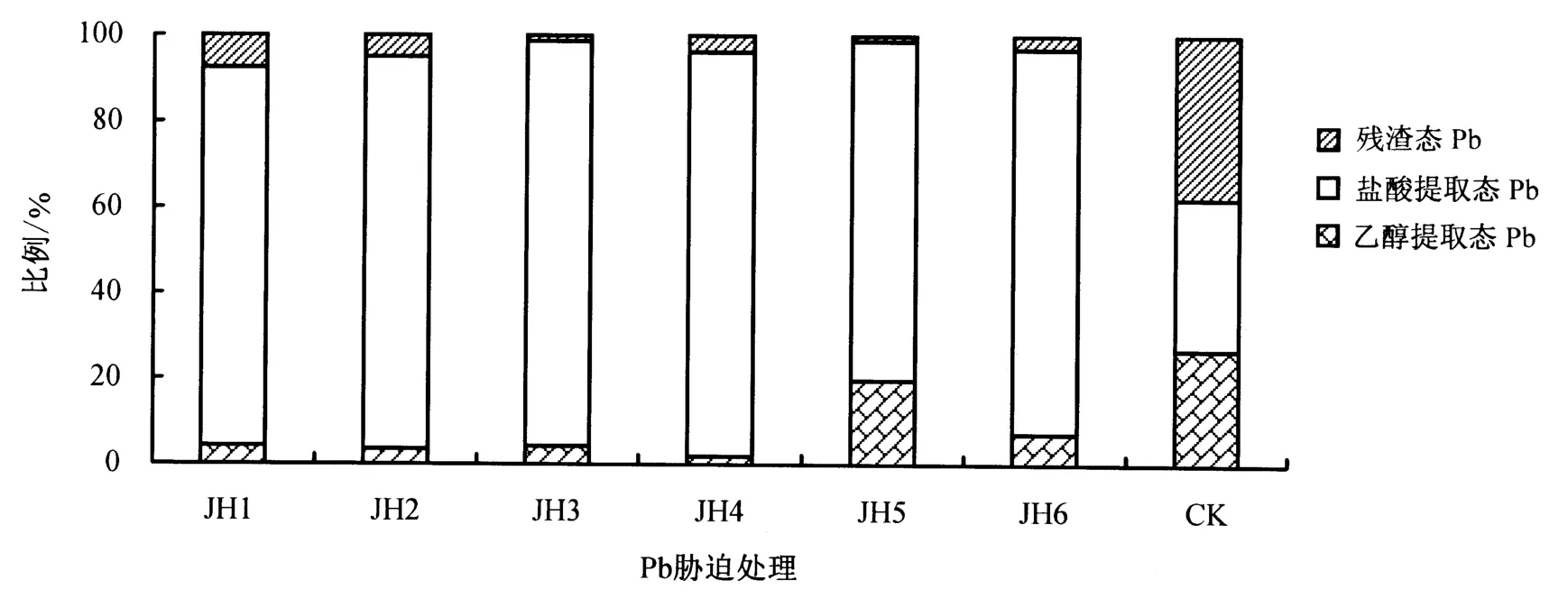
图2 Pb胁迫下金丝草地上部分各提取态Pb所占比例Fig.2 Percentage of different existence form of Pb in shoot of P.crinitum under different Pb stress condition
2.5 Pb胁迫对金丝草Pb富集量的影响
由表7可知,随Pb胁迫浓度的增大,金丝草根系中Pb的富集量呈先增大后减小的趋势,而地上部分Pb的富集量和总富集量呈逐渐增大的趋势.Pb胁迫浓度为1000 mg·kg-1时,根系中Pb的富集量最大,显著大于其他处理及对照(P<0.05);Pb胁迫浓度大于1000 mg·kg-1时,地上部分Pb的富集量大于根系中的富集量,且1500和2500 mg·kg-1处理显著大于其他处理及对照(P<0.05).表明金丝草对Pb具有强的转运能力,可将大量土壤中的Pb转移至地上部分.
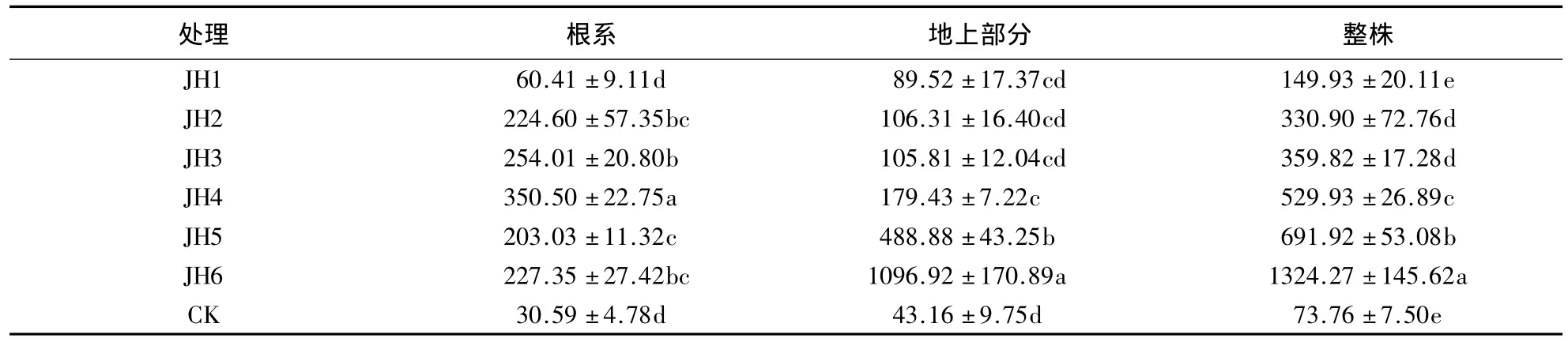
表7 Pb胁迫下金丝草对Pb的富集量1)Table 7 Pb content in P.crinitum under different Pb stress condition μg
3 结论与讨论
研究表明,植物体内的重金属以多种形态存在,不同植物在不同生长发育阶段和不同部位的形态和分布特征存在一定差异,不同形态的活性和迁移能力存在显著差异[18-19].Pb在水稻和小麦中多以活性较低的重金属磷酸盐或草酸盐为主,因此叶片中Pb的总量明显低于根系,使根系的Pb迁移能力低,对地上部分的危害相应减弱[20].汪霞等[21]在干旱区绿洲土壤—油菜系统重金属污染研究中发现,油菜对活动性Ni具有富集作用,而油菜根系对碳酸盐结合态Zn具有吸附作用.本试验结果表明:金丝草根系和地上部分主要以盐酸提取态Pb为主,表明Pb在金丝草体内主要以有机酸盐、果胶酸盐等结合态存在[22];当Pb胁迫浓度大于250 mg·kg-1时,地上部分乙醇提取态Pb含量大于残渣态Pb;Pb胁迫下根系中残渣态Pb含量大于乙醇提取态Pb,表明Pb胁迫下,根系中的Pb与有机酸等结合形成难溶态,减小Pb的毒害作用;高浓度Pb胁迫下,地上部分乙醇提取态Pb含量相对增加,Pb的生物活性增强,从而加快Pb的转移;高浓度Pb胁迫可促进地上部分生物量的增大,从而实现对Pb的大量富集,这可能是金丝草对Pb超富集的机制之一,但高浓度Pb胁迫下金丝草生物量增大的内在机制还有待进一步研究.
本试验结果显示:Pb胁迫对金丝草生物量有一定的抑制作用,但在高浓度Pb胁迫下,金丝草仍有较大生物量;金丝草对Pb有较强耐性和富集能力,在Pb胁迫浓度为2500 mg·kg-1时能较正常生长,且对Pb的富集量及转移系数均达到Pb超富集植物的标准;Pb胁迫下金丝草体内的Pb主要以有机酸盐、果胶酸盐、蛋白质结合态为主,降低迁移能力,减小Pb对自身的毒害.
[1]RYBAK A,MESSYASZ B,TESKA B.Freshwater Ulva(Chlorophyta)as a bioaccumulator of selected heavy metals(Cd,Ni and Pb)and alkaline earth metals(Ca and Mg)[J].Chemosphere,2012,89(9):1066-1076.
[2]王学礼,常青山,侯晓龙,等.三明铅锌矿区植物对重金属的富集特征[J].生态环境学报,2010,19(1):108-112.
[3]RODRIGUEZ-ESTIVAL J,MARTINEZ-HARO M,MONSALVE-GONZALEZ L,et al.Interactions between endogenous and dietary antioxidants against Pb-induced oxidative stress in wild ungulates from a Pb polluted mining area[J].Science of the Total Environment,2011,409(14):2725-2733.
[4]董辰寅,张卫国,王冠,等.上海宝山区城市土壤铅污染来源的同位素判别[J].环境科学,2012,33(3):754-759.
[5]唐文浩,岳平,陈恒宇.海南岛砖红壤中铅、镉的化学形态与转化[J].中国生态农业学报2009,17(1):145-149.
[6]马军,刘爱琴,侯晓龙,等.福州仓山工业密集区周边菜地土壤重金属的含量与评价[J].福建农林大学学报:自然科学版,2011,40(1):74-79.
[7]庚瑞锐,赵运林,董萌,等.土壤重金属镉、铅污染的植物修复技术研究进展[J].贵州农业科学,2011,39(6):216-220.
[8]SUCHKOVA N,DARAKAS E,GANOULIS J.Phytoremediation as a prospective method for rehabilitation of areas contaminated by long-term sewage sludge storage:A Ukrainian-Greek case study[J].Ecological Engineering,2010,36(4):373-378.
[9]侯晓龙,常青山,刘国锋,等.Pb超富集植物金丝草(Pogonatherum crinitum)、柳叶箬(Lsachne globosa)[J].环境工程学报,2012,6(3):989-994.
[10]常青山.重金属超富集植物的筛选与螯合吸附研究[D].福州:福建农林大学,2005.
[11]廖洪波,李洪军.食品中重金属元素形态分析技术及其应用[J].食品科学,2008,29(1):369-373.
[12]朱影影.植物中的重金属形态、分布及其毒性研究进展[J].淮南职业技术学院学报,2011,11(3):68-70.
[13]俞励平,陈志澄,梁友前,等.不同提取方法对巴戟天中金属元素含量影响的初步探讨[J].广东微量元素科学,2004,11(11):41-43.
[14]欧阳荔,刘雅琼,解清,等.若干中草药中25种元素在不同浸提液中的分布[J].中国中药杂志,2004,29(8):754-758.
[15]吴慧梅,李非里,牟华倩,等.两步连续提取法测定植物中重金属的形态[J].环境科学与技术,2012,35(7):133-137.
[16]国家环境保护总局.GB/T 7475-1987水质铜、锌、铅、镉的测定 原子吸收分光光度法[S].北京:中国环境科学出版社,1987.
[17]全国饲料工业标准化技术委员会.GB/T 13080-2004饲料中铅的测定 原子吸收光谱法[S].北京:中国标准出版社,2004.
[18]王友保,张莉,沈章军,等.铜尾矿库区土壤与植物中重金属形态分析[J].应用生态学报,2005,16(12):2418-2422.
[19]AKINCI G,GUVEN D E.Bioleaching of heavy metals contaminated sediment by pure and mixed cultures of Acidithiobacillus spp.[J].Desalination,2011,268(1):221-226.
[20]许嘉琳,鲍子平.农作物体内铅、镉、铜的化学形态研究[J].应用生态学报,1991,2(3):244-248.
[21]汪霞,南忠仁,武文飞,等.干旱区绿洲土壤—油菜系统重金属污染实验研究[J].环境与健康杂志,2010,27(9):824-825.
[22]杨居荣,贺建群,张国祥,等.农作物对Cd毒害的耐性机理探讨[J].应用生态学报,1995,6(1):87-91.

