MMP-2、MMP-14、TIMP-2在胃癌组织中的表达及意义
张金玲, 费 雁, 陈 伟, 冯 刚
华中科技大学同济医学院附属普爱医院肿瘤科,武汉 430033
胃癌是我国最常见的恶性肿瘤之一,年死亡率高,其确切病因尚未完全明了。广泛研究发现,肿瘤细胞在侵袭和转移过程中必须破坏细胞外基质(extracellular matrix,ECM)和血管壁基底膜组成的结构屏障,才能进入宿主微循环。而ECM 的降解主要依靠蛋白水解酶,参与破坏ECM 的酶类中基质金属蛋白酶家族(matrix metalloproteinases,MMPs)起着主要作用,MMP-2、MMP-14是基质金属蛋白酶家族中的重要成员,与肿瘤的侵袭和转移关系较为密切;而组织基质金属蛋白酶抑制剂-2(tissue inhibitor of metalloproteinases-2,TIMP-2),是调节MMP活性的重要物质,对维护ECM 的稳定和完整具有重要作用。本研究旨在检测胃癌、正常胃组织中MMP-2、MMP-14、TIMP-2的表达情况,探讨其与胃癌临床病理特征及预后的相关性。
1 资料与方法
1.1 一般资料
选取本院病理科2007年1月~2009年5月期间经10%甲醛固定和石蜡包埋的胃癌组织标本80例,患者术前均未行放、化疗,中位年龄55.6岁(范围40~75岁),选定的全部病例都有完整的随访资料,包括患者手术后的生存期及死亡原因等,随访时间5~60个月;同期30例癌旁≥5cm 的正常组织作为对照。胃癌患者临床病理特征等参数参考AJCC(第7版)胃癌分类标准。
1.2 方法
1.2.1 抗体和试剂 鼠抗人MMP-2、MMP-14、TIMP-2单抗及HRP 标记鼠抗人IgG(美国Santa cruz公司),SP免疫组化试剂盒和DAB 显色剂(武汉博士德生物技术有限公司)。
1.2.2 免疫组化染色检测 厚约4μm 的石蜡切片脱蜡水化后依免疫组化SP 法染色试剂盒说明书进行操作。用已知阳性组织切片作为阳性对照,以PBS液代替一抗为阴性对照。根据样本阳性细胞百分比和染色强度综合评分,10个随机高倍镜视野下,无阳性细胞计0分,<25%计1分,25%~50%计2分,51%~75%计3分,>75%计4分。染色强度计分:未着色0分,淡黄色1分,棕黄色2分,棕褐色3分。根据样本阳性细胞百分比和染色强度计分之和的结果分为:0~3分为阴性或弱阳性,≥4分为阳性和强阳性[1]。
1.3 统计学处理
所有数据均采用SPSS 15.0 统计软件进行处理,采用χ2检验及相关性分析,以P<0.05为差异有统计学意义。
2 结果
2.1 MMP-2、MMP-14、TIMP-2在胃癌和正常胃组织中的表达
胃癌组阳性表达见图1。MMP-2、MMP-14、TIMP-2的表达多在细胞的胞质。在胃癌、正常胃组织中,MMP-2 阳性表达率分别为75.00%(60/80)、36.67%(11/30),MMP-14阳性表达率分别为82.50%(66/80)、33.33%(10/30),TIMP-2阳性表达率分别为45.00%(36/80)、40.00%(12/30)。胃癌同正常胃组织比较,MMP-2、MMP-14的阳性表达率较高,差异有统计学意义(χ2分别为14.009 9和24.697 5,P 值分别为0.001 2 和0.0000);TIMP-2两组之间差异无统计学意义(χ2=0.221 8,P=0.637 7)。
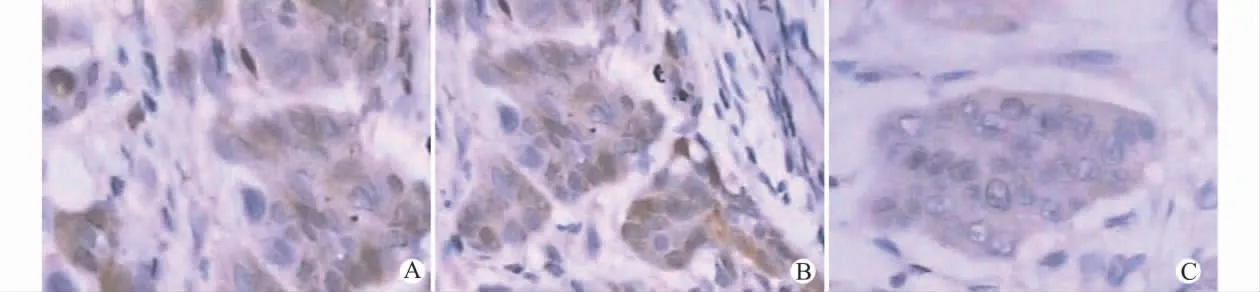
图1 MMP-2、MMP-14、TIMP-2在胃癌组织中阳性表达(SP法,×200)Fig.1 The positive expression of MMP-2,MMP-14,TIMP-2in gastric cancer tissues(SP method,×200)
2.2 MMP-2、MMP-14、TIMP-2的蛋白表达与临床病理特征的关系
MMP-2、MMP-14阳性表达率与分化程度、浸润深度、淋巴结转移及TNM 分期均相关(均P<0.01),低、未分化组表达率高于高、中分化组,侵犯至浆膜、浆膜外者的表达率高于未达浆膜层者,有淋巴结转移者高于没有淋巴结转移者,TNMⅢ+Ⅳ期者的表达率高于Ⅰ+Ⅱ期者。而TIMP-2的表达与分化程度、浸润深度及TNM 分期无关,仅与有无淋巴结转移相关,有淋巴结转移组高于无淋巴结转移组(P<0.05)。见表1。
2.3 MMP-2、MMP-14、TIMP-2蛋白表达与患者生存期的关系
在80例术后患者中,生存期<2年患者34例,都在术后6~24个月间死亡(皆排除其他原因,为肿瘤进展导致死亡)。34例生存期<2年患者,MMP-2阳性表达率97.06%(33/34),MMP-14阳性表达率97.06%(33/34);生存期≥2年患者,MMP-2阳性表达率58.70%(27/46),MMP-14 阳性表达率71.74%(33/46)。生存期<2年同生存期≥2年组比较,差异均有统计学意义(χ2分别为15.345 3 和8.681 0,P 值分别为0.0000和0.003 2)。生存期<2年患者组TIMP-2 阳性表达率50.00%(17/34),生存期≥2 年组阳性率为41.30%(19/46),两者差异无统计学意义(χ2=0.597 3,P =0.439 6)。在34例生存期<2 年患者中,同时表达MMP-2、MMP-14的有32例,阳性率94.14%;46例生存期≥2年患者,同时表达MMP-2、MMP-14的有21例,阳性率45.7%,差异有统计学意义(χ2=20.537 7,P=0.0000)。在34 例生存期<2年患者中,同时表达MMP-2、MMP-14、TIMP-2的有18例,阳性率52.9%;46 例生存期≥2 年患者,同时表达MMP-2、MMP-14、TIMP-2 的有9例,阳性率19.6%,差异有统计学意义(χ2=9.739 9,P=0.001 8)。
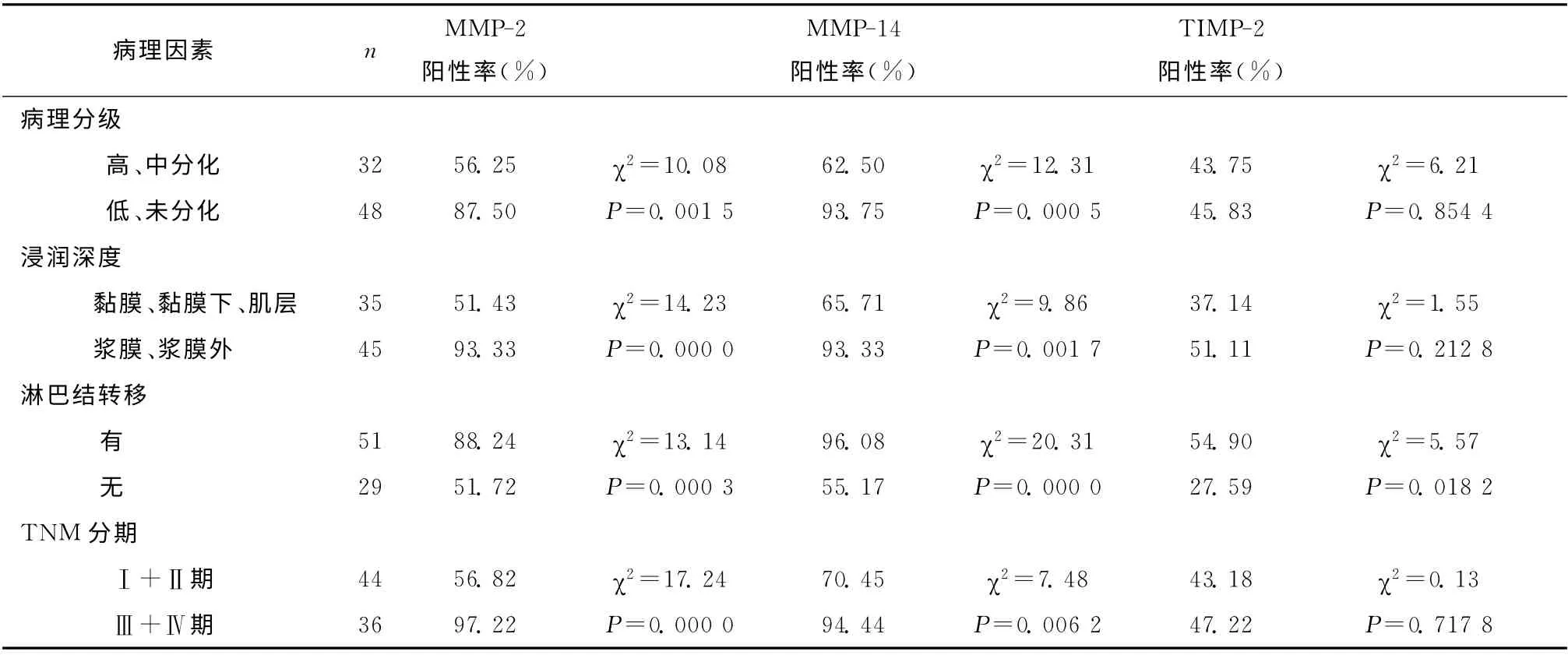
表1 MMP-2、MMP-14、TIMP-2蛋白表达与胃癌临床病理特征的关系Table 1 The relationship between the expression of MMP-2,MMP-14and TIMP-2protein and the clinicopathological characteristics of gastric cancer
3 讨论
MMP-2又称为明胶酶A,或Ⅳ型胶原酶,一方面它能特异性地降解基质膜中的主要成分Ⅳ型胶原,使基底膜丧失完整性;另一方面通过肿瘤内毛细血管新生促进肿瘤生长、侵袭和转移。MMP-2在多种肿瘤中均有表达,在肿瘤发生发展过程中的重要作用已有较多文献报道[2-4]。
MMP-14,又称膜型基质金属蛋白酶-1(MT1-MMP),是第一个发现的具有跨膜序列的MMPs,并且是膜型蛋白酶中最重要的一员。多数研究证实MMP-14在肺癌、胃癌、胰腺癌、卵巢癌、甲状腺癌、乳腺癌、前列腺癌等多种恶性肿瘤中均有表达,在肿瘤的侵袭、转移等过程中发挥重要作用[5-7]。有报道[8],MMP-14 的主要生物学功能在于它介导MMP-2酶原的激活以及通过其表达上调血管内皮生长因子促进血管生成和生长,协同参与了多种肿瘤的侵袭和转移过程。AI-Raawi等[9]研究证实,MMP-14是前体MMP-2(proMMP-2)的细胞表面激活因子,使之激活后具备了降解ECM 的能力,从而加速了乳腺癌的进展。MMP-14表达增加可触发瀑布式的MMPs激活过程并导致细胞周围纤维蛋白溶解[10],这是肿瘤细胞入侵的重要特点。众多研究表明,MMP-14作为MMPs中的重要一员,参与了细胞外基质的降解、肿瘤细胞的侵袭、转移及肿瘤血管形成的各个过程。
组织金属蛋白酶抑制剂(tissue inhibitors of metalloproteinase,TIMPs)是MMPs 的天然抑制物。TIMP-2的作用较为重要,主要由肿瘤细胞及间质细胞分泌。它既有广谱的MMPs抑制作用,是除MMP-9外大多数MMPs的抑制因子,同时又具有一定的选择性,TIMP-2以1∶1的比例非共价键结合抑制MMP-2 酶原及其活性形式,从而保护ECM 的完整性,以对抗肿瘤的侵袭和转移。它还可以以一种浓度依赖方式启动或抑制MMP-2 的活化。同时,Sounni等[11]报道,MMP-14 与TIMP-2之间的平衡也是调节MMPs活性的重要因素。
本文对比研究了80例胃癌以及30例癌旁正常胃组织中MMP-2、MMP-14、TIMP-2的表达情况,发现胃癌组织中MMP-2、MMP-14阳性表达上调,明显高于正常胃组织,与文献[8]所述一致,可能是胃癌具有高转移性的原因之一。本研究显示,胃癌细胞的分化程度越低,MMP-2、MMP-14 阳性表达率越高。随着胃癌TNM 分期的增加,MMP-2、MMP-14阳性表达率升高。同时,生存期<2年的患者同时表达 MMP-2、MMP-14 或 MMP-2、MMP-14、TIMP-2的阳性率较生存期≥2年的患者高。
本研究中,TIMP-2 在胃癌及正常胃组织中均有表达,胃癌组织略高于正常组织,但差异无统计学意义。在本研究中发现TIMP-2在胃癌组织中表达的增高与淋巴结转移相关,而与细胞分化程度、浸润深度及分期无明显相关。这些可能与标本的选择及标本量有关。Honkavuori-Toivola等[12]证实在子宫内膜癌中TIMP-2高表达,并且与预后关系密切,这与本研究中TIMP-2在肿瘤组织中表达略高、合并淋巴结转移者TIMP-2表达增高相一致。TIMP-2的表达与基因的网络反馈调节机制有关,机制还不完全清楚,可能为:①TIMP-2对MMP-2、MMP-14的反应,癌变时MMP-2、MMP-14 增高的同时,机体可通过调节增加TIMP-2 来抑制MMP-2 及MMP-14,从而使肿瘤浸润转移能力下降;②TIMP-2能抑制微血管内皮细胞生长和内皮细胞对基底膜的浸润,即抑制新生血管形成;如通过人工合成等方法增加肿瘤组织中TIMP-2蛋白的表达,竞争性结合MMPs,达到抑制肿瘤侵袭及转移的目的。正常组织中MMPs和TIMPs之间存在着微妙的平衡关系,维持着ECM 的稳定。癌变时MMPs和TIMPs表达上调,TIMPs增高程度不足以抑制MMPs的活性时,二者之间的平衡被打破,导致了ECM 过度降解。因此肿瘤细胞的侵袭转移过程中,ECM 的降解是MMPs和TIMPs表达不平衡的结果[13-16]。
总之,MMP-2、MMP-14、TIMP-2 在胃癌的发生、发展过程中发挥着重要作用,联合检测MMP-2/MMP-14或MMP-2/MMP-14/TIMP-2可为胃癌恶性程度及预后判断提供参考依据,为胃癌患者的治疗提供帮助。
[1] Yu J W,Wu J G,Jiang B J,et al.Study on lymph node metastasis correlated to lymphangiogenesis,lymphatic vessel invasion and lymph node micrometastasis in gastric cancer[J].J Surg Res,2011,168(2):188-196.
[2] 徐亮,郭君红,郭向飞,等.转染RECK 基因对人骨肉瘤MG-63细胞MMP-2活化及侵袭能力的影响[J].华中科技大学学报:医学版,2009,38(3):313-316.
[3] Chen D,Wang Y,Zhang K,et al.Antisense oligonucleotide against clusterin regulates human hepatocellular carcinoma invasion through transcriptional regulation of matrix metalloproteinase-2and e-cadherin[J].Int J Mol Sci,2012,13(8):10594-10607.
[4] Guo X T,Wang J F,Zhang L Y,et al.Quantitative assessment of the effects of MMP-2polymorphisms on lung carcinoma risk[J].Asian Pac J Cancer Prev,2012,13(6):2853-2856.
[5] Koshikawa N,Mizushima H,Minegishi T,et al.Proteolytic activation of heparin-binding EGF-like growth factor by membrane-type matrix metalloproteinase-1in ovarian carcinoma cells[J].Cancer Sci,2011,102(1):111-116.
[6] Soubani O,Ali A S,Logna F,et al.Re-expression of miR-200 by novel approaches regulates the expression of PTEN and MT1-MMP in pancreatic cancer[J].Carcinogenesis,2012,33(8):1563-1571.
[7] Reis S T,Antunes A A,Pontes J Jr,et al.Underexpression of MMP-2and its regulators,TIMP2,MT1-MMP and IL-8,is associated with prostate cancer[J].Int Braz J Urol,2012,38(2):167-174.
[8] Mohammad M A,Zeeneldin A A,Abd Elmageed Z Y,et al.Clinical relevance of cyclooxygenase-2and matrix metalloproteinases(MMP-2and MT1-MMP)in human breast cancer tissue[J].Mol Cell Biochem,2012,366(1/2):269-275.
[9] AI-Raawi D,Abu-EI-Zahab H,EI-Shinawi M,et al.Membrane type Ⅰ-matrix metalloproteinase(MT1-MMP)correlates with the expression and activation of matrix metalloproteinase-2(MMP-2)in inflammatory breast cancer[J].Int J Clin Exp Med,2011,4(4):265-275.
[10] Shi F,Sottile J.MT1-MMP regulates the turnover and endocytosis of extracellular matrix fibronectin[J].J Cell Sci,2011,124(Pt 23):4039-4050.
[11] Sounni N E,Rozanov D V,Remacle A G,et al.TIMP-2binding with cellular MT1-MMP stimulates invasion-promoting MEK/ERK signaling in cancer cells[J].Int J Cancer,2010,126(5):1067-1078.
[12] Honkavuori-Toivola M,Talvensaari-Mattila A,Soini Y,et al.Immunoreactivity for TIMP-2is associated with a favorable prognosis in endometrial carcinoma[J].Tumour Biol,2012,33(4):935-941.
[13] Zhang M,Zhu G Y,Gao H Y,et al.Expression of tissue levels of matrix metalloproteinases and tissue inhibitors of metalloproteinases in gastric adenocarcinoma[J].J Surg Oncol,2011,103(3):243-247.
[14] 陈杰,庞江琳,覃燕梅,等.5F 对人高转移巨细胞肺癌PGCL-3细胞PTEN、MMP-9表达的影响[J].华中科技大学学报:医学版,2012,41(2):147-151.
[15] 饶玉梅,王鸿雁,范良生,等.MTA1通过β-catenin、MMP-9调节HeLa细胞粘附、侵袭、转移[J].华中科技大学学报:医学版,2011,40(1):32-36.
[16] 黄加权,焦云桃,李兰,等.siRNA 干预CTGF 和TIMP-1对大鼠肝星状细胞胶原分泌的影响[J].华中科技大学学报:医学版,2012,41(1):22-26.

