脑桥外髓鞘溶解症的影像学特征*
胡 琦, 张存泰, 刘 建, 江 红, 舒红格, 康慧聪, 许 峰, 刘晓艳, 朱遂强△
华中科技大学同济医学院附属同济医院 1综合科2放射科3神经内科,武汉 430030
脑桥外髓鞘溶解症(extrapontine myelinolysis,EPM)和脑桥中央髓鞘溶解症(central pontine myelinolysis,CPM)是一类常见于快速纠正低钠血症后的渗透性脱髓鞘疾病,CPM 常累及脑桥基底部,而EPM 则多累及基底节、皮层、小脑等脑桥外结构,两者可独立或同时发生。相对于CPM 而言,目前EPM 尚未被充分认识,尤其是孤立性EPM 易被误诊,我们现报告10例EPM,对其MRI及CT 影像特点进行分析总结,以期在临床中减少误诊。
1 资料和方法
1.1 一般资料
对于2007年1月~2012年1 月收集的10例EPM 患者的MRI和CT 的影像资料进行回顾分析。纳入标准:①发病前均有低钠血症;②低钠血症纠正后出现神经系统症状体征及影像改变。排除标准:①缺血缺氧病史;②中毒史;③血清铜、铜蓝蛋白、眼K-F环异常及肝豆状核变性家族史;④腰穿示脑脊液检查异常。本组10例患者中男性6例,女性4例,发病年龄为26~63岁,平均为43.1岁。低钠血症的病因分别为:腺垂体功能减退症3例,咯血后静滴垂体后叶素2例,肝硬化并消化道出血1例,门静脉海绵样变性并消化道出血1例,肝移植术后1例,肠梗阻1例,慢性腹泻1例。
1.2 检查方法
所有患者CT 扫描采用GE lightspeed 16排螺旋CT 扫描仪,层厚、层距5~10mm。MRI检查采用GE Signa 1.5T 磁共振扫描仪,扫描层厚6mm,间隔8mm,8NA 头颈联合线圈,T1FLAIR:TR/TE=1 886.35/11.36、FA =90,T2WI:TR/TE =4 000/107.69、FA =90,T2FLAIR:TR/TE =8 402/128.09、FA=90,常规行横轴面及矢状面平扫,增强按0.1mmol/kg静脉注射Gd-DTPA 后行横轴面、矢状面和冠状面增强扫描。采用SE 序列平面回波(EPI)成像技术行多次激发弥散加权成像(diffusion-weighted imaging,DWI)轴位扫描,扩散梯度因子b=1 000s/mm2,矩阵TR/TE=6 000/106,层厚6 mm,层距8 mm。根据T2FLAIR 或T2WI确定病变范围,使用AW 4.2工作站functool 2 软件获得病变区域及对侧大脑对称区域的表观弥散系数(apparent diffusion coefficient,ADC)图。1HMRS 以轴位T2WI或FLAIR 作为定位像,选择病灶最明显的层面定位,先后行单体素波谱(single voxel spectroscopy,SVS)采集,选择点分辨率波谱(PRESS)序列采集,TE=144ms,TR=1 500ms,兴趣区选择豆状核,尽量避开颅骨、脂肪和颅内大血管。
2 结果
10例患者均行头颅MRI平扫,其中3 例行增强扫描,5 例行DWI,1 例行MRS,3 例行头颅CT平扫,所有扫描均获得满意图像(图1)。
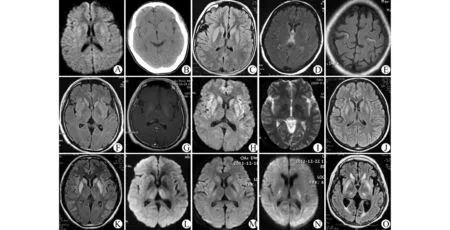
图1 10例EPM 患者的影像学表现Fig.1 The neuroimaging presentations of 10EPM patients
2.1 病灶部位
病变共累及尾状核(caudate nucleus,CN)8次、豆状核(lenticular nucleus,LN)8 次、丘脑(thalamus,Thal)5次、颞叶(temporal lobe,TL)3次、顶叶(parietal lobe,PL)3 次、额叶(frontal lobe,FL)2次、枕叶(occipital lobe,OL)1次,另有3例同时累及脑桥(pons)(表1)。

表1 脑桥外髓鞘溶解症的病灶分布特征Table 1 Distribution characteristics of lesions in extrapontine myelinolysis
2.2 常规MRI信号特点
所有患者行MRI平扫,扫描时间为发病第1~14天,平均为4.5d,均成功发现病灶。T1FLAIR表现为低信号,T2WI呈稍高信号,T2FLAIR 异常高信号更加明显,病灶边界清,形状较规则,均无水肿和占位效应,在基底节和丘脑多呈对称分布,而在皮层则呈多发散在分布。
2.3 增强扫描特点
病例4、6、7行增强扫描,相应病灶均未见明显强化。
2.4 DWI扫描特点
病例1、4、7、8、9行DWI扫描,显示与T2WI相对应的斑片状高信号,即T2WI呈高信号者在DWI亦为高信号,在ADC图上呈等信号或稍低信号。
2.5 MRS特点
病例4行MRS扫描,所得波谱基线稳定,N-乙酰基天门冬氨酸(NAA)峰减低,胆碱复合物(Chol)峰未见明显变化,NAA/Chol比值减低,未出现明显乳酸(Lac)峰(图2)。
2.6 CT表现
病例2和病例7在24h内行急诊CT,未见异常;病例1在发病2周后检查显示双侧尾状核及豆状核低密度,间隔3周后再次复查显示病灶消失。
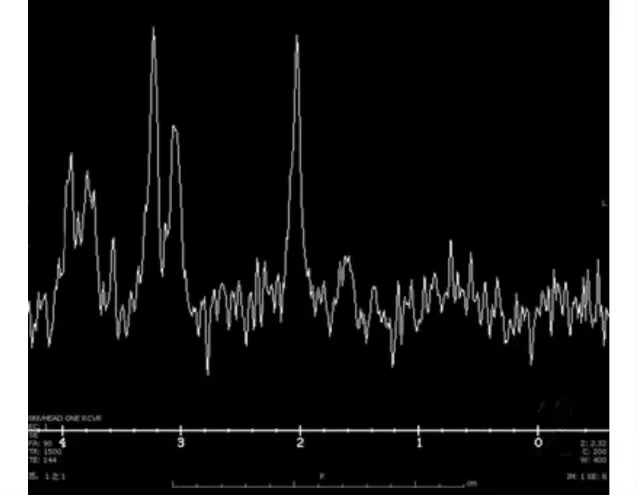
图2 病例4的磁共振波谱分析Fig.2 MRS imaging of case 4
3 讨论
EPM 和CPM 是一类常见于快速纠正低钠血症后出现的中枢神经系统渗透性脱髓鞘疾病。目前多认为发病机制与渗透性应激有关,当发生慢性低钠血症时,神经细胞排出胞内的Na+、K+等无机盐及谷氨酰胺、肌醇、牛磺酸等有机溶质,以平衡胞内外渗透压,若在此时补充浓钠,快速纠正低钠血症,由于牛磺酸等有机溶质将难以迅速回到胞内,胞外渗透压反而升高,进而引起脑细胞急剧缺水,血脑屏障功能受损及损伤因子的释放,从而导致髓鞘破坏和少突胶质细胞损伤[1]。由于少突胶质细胞多位于富含血管的灰质附近,因此病灶常累及灰白质混合处[2],如CPM 多发生在脑桥基底部,而EPM 则常累及小脑、外侧膝状体、外囊、最外囊、海马、壳核、皮层、丘脑及尾状核[3],本组资料则以基底节、皮层和丘脑为主,未见累及小脑者,与国外报道[3-4]有差异,分析原因可能与样本量小有关,尚有待于进一步观察。
EPM 在CT 上多表现为脑桥外对称性低密度区,但极易漏诊。Chua等[5]在24h内给4例EPM患者行急诊脑CT 检查,均未能显示病灶,其中1例在2d后再次复查则于丘脑等处发现病灶。同样,本研究中也有2 例患者在24h 内的急诊头颅CT扫描未见病灶,而另有1例则在发病后2周后行CT检查提示双侧基底节区低密度灶。因此,CT 应用于EPM 可能存在时间窗和阳性率低,阳性率可能与扫描时间、病变部位、病损程度等因素相关,临床分析时需警惕假阴性。
目前认为MRI是诊断EPM 的首选检查,在急性期即表现出长T1、长T2信号。本组EPM 患者也多数在3d内即出现影像改变,有1例患者24h内即发现病灶,故有条件者宜尽早行MRI以确诊。Kawahara等[6]报道1例CPM 患者经过10个月治疗完全痊愈,后复查MRI,脑桥病灶几乎完全消失。因此,髓鞘溶解症急性期影像学异常可能为水肿所引起,而病程后期残留病灶则可能为神经纤维脱髓鞘,从而导致早期影像学异常与病情严重程度、疾病预后并不一致[7]。另由于EPM 患者的血脑屏障仅功能受损而未完全破坏,因此MRI增强扫描常无强化或仅轻度强化,此结果与多数文献报道一致。
DWI由于对早期脱髓鞘病灶和细胞内水肿更敏感,因此在T2WI和FLAIR 之前即发现病灶[8],可用于早期诊断。本组5例患者DWI均成功发现病灶,且较T2WI、FLAIR 信号明显增高。DWI高信号和ADC图上呈等信号或稍低信号表明病变区域细胞内水分增多及水分子扩散受限,有研究表明ADC 测量值的下降程度与病灶部位及病程相关[4]。
现MRS也逐渐应用于髓鞘溶解症,Smith等[9]报道CPM 患者脑桥出现Chol峰、NAA 峰及脂质(Lipids)峰的下降,Karakas等[10]则发现EPM 患者的丘脑处NAA 峰下降及Chol峰升高,分析原因可能与胶质细胞增生有关,Aslan等[11]的研究显示病变的豆状核出现标志着坏死或缺氧的乳酸(Lac)峰。而本组中第4 例患者MRS 也发现豆状核处NAA峰减低,Chol峰未见明显变化,但NAA/Chol比值减低,而未见明显Lac峰,提示该患者病变区域神经细胞可能仅为功能性受损,而后续复查磁共振恢复正常也证实神经细胞无结构性坏死。
目前多数教科书仍描述EPM 为罕见的脱髓鞘疾病,但在临床实际工作中却并不少见。因此,腺垂体功能减退、肝脏疾病及咯血患者等在纠正低钠血症后出现基底节、丘脑或皮层处T1 低信号,T2 高信号,且无占位效应和强化者,则应高度警惕EPM。
[1] Martin R J.Central pontine and extrapontine myelinolysis:the osmotic demyelination syndromes[J].J Neurol Neurosurg Psychiatry,2004,75(Suppl 3):22-28.
[2] Kleinschmidt-Demasters B K,Rojiani A M,Filley C M.Central and extrapontine myelinolysis:then and now[J].J Neuropathol Exp Neurol,2006,65(1):1-11.
[3] Gocht A,Colmant H J.Central pontine and extrapontine myelinolysis:a report of 58cases[J].Clin Neuropathol,1987,6(6):262-270.
[4] Bekiesińska-Figatowska M,Bulski T,Rózyczka I,et al.MR imaging of seven presumed cases of central pontine and extrapontine myelinolysis[J].Acta Neurobiol Exp(Wars),2001,61(2):141-144.
[5] Chua G C,Sitoh Y Y,Lim C C,et al.MRI findings in osmotic myelinolysis[J].Clin Radiol,2002,57(9):800-806.
[6] Kawahara I,Tokunaga Y,Ishizaka S.Reversible clinical and magnetic resonance imaging of central pontine myelinolysis following surgery for craniopharyngioma:serial magnetic resonance imaging studies[J].Neurol Med Chir(Tokyo),2009,49(3):120-123.
[7] Kumar S,Fowler M,Gonzalez-Toledo E,et al.Central pontine myelinolysis,an update[J].Neurol Res,2006,28(3):360-366.
[8] Ruzek K A,Campeau N G,Miller G M.Early diagnosis of central pontine myelinolysis with diffusion-weighted imaging[J].AJNR Am J Neuroradiol,2004,25(2):210-213.
[9] Smith J K,Londono A,Castillo M,et al.Proton magnetic resonance spectroscopy of brain-stem lesions[J].Neuroradiology,2002,44(10):825-829.
[10] Karakas H M,Erdem G,Yakinci C.Osmotic demyelination syndrome in a 40-day-old infant[J].Diagn Interv Radiol,2007,13(3):121-124.
[11] Aslan H,Donmez F Y,Hekimoglu O K,et al.The magnetic resonance spectroscopy findings of extrapontine myelinolysis in a patient with acute lymphoblastic leukemia[J].Neurol Sci,2012,33(2):391-394.

