5-羟色胺转运体基因长度多态性与孤独症谱系障碍易感性关系的Meta分析*
莫胜男, 戚小兵, 邵珊珊, 孙 昭, 宋然然△
1武汉大学人民医院,武汉 430060
2广东省珠海市妇幼保健院,珠海 519001
3华中科技大学同济医学院公共卫生学院儿少卫生与妇幼保健学系,武汉 430030
孤独症谱系障碍(autism spectrum disorder,ASD)是以社会交往障碍、语言发育障碍、兴趣范围狭窄、重复刻板行为为主要临床表现的综合征,是常见的儿童广泛性发育障碍之一。它起病于婴幼儿期,最新的一项系统评价显示全球ASD 发病率的平均水平为6.2‰[1]。孤独症患儿的感知思维、言语、注意、智力等认知功能都可能受到损害,并持续一生,给整个家庭和社会带来沉重负担[2]。
ASD 的病因和发生机制仍不十分清楚。大量研究显示遗传因素在ASD 的发病过程中发挥着重要的作用[3-5]。而在目前研究的数百种与ASD 相关的基因中,针对5-羟色胺转运体基因(5-HTT,也称SLC6A4)长度多态性(5-HTTLPR)的研究最多,其原因在于:①5-羟色胺参与调节中枢神经系统的发育,与社交行为、攻击行为及焦虑等情绪相关[6];②多项研究发现部分孤独症患儿全血中5-羟色胺浓度较高[7-9];③5-羟色胺重摄取抑制剂(对5-羟色胺转运体有特异性的靶向作用)能够改善孤独症患儿的行为障碍,如减少重复刻板的动作、减少攻击性行为[10-11]。Cook等[12]在1997年首次报道了5-HTTLPR 的S等位基因与ASD 发病相关,然而随后的20 多项研究的结果并不一致。因此,本研究采用Meta分析的方法整合已发表的研究数据,以期通过扩大样本量对5-HTTLPR 与ASD 发病风险之间关系进行更加稳定和可靠的评价。
1 资料与方法
1.1 文献检索策略
本研究首先在PubMed数据库中,以“serotonin AND transporter AND autism”,“autistic disorder/genetics AND SLC6A4protein,human”,“autism AND SLC6A4”和“autism AND 5-HTTLPR”检索式进行检索;其次,在Embase及ISI Web of Science等英文数据库中以检索式“autism AND SLC6A4”和“autism AND 5-HTTLPR”再次进行检索;最后,以“孤独症、SLC6A4、5-HTTLPR、多态性”为检索词检索CNKI、维普、万方等中文文献库。检索时,无语种限制,并采用了参考文献回溯法以求全面检索截止于2012年10月公开发表的相关文献。如果研究数据有重叠,本研究只纳入最早或最完整的数据;如果文献中对孤独症的诊断同时采用了严格和宽泛的标准,本研究仅摘录基于严格标准诊断所产生的数据。
1.2 文献纳入标准
①研究对象为孤独症患者,且文中提供了详细的诊断标准;②研究为分析5-HTTLPR 与孤独症易感性关系的病例对照研究或家系研究,且家系研究采用传递/不平衡检验(transmission/disequilibrium test,TDT);③文献中提供相关等位基因的频数分布或有可以计算出相关频数分布的信息。摘要、综述、个案报道、动物研究的数据不纳入本研究。
1.3 数据提取
所有数据由2名作者分别独立提取,以确保数据提取无误。提取的信息包括:第一作者、发表年份、诊断标准、研究对象所属的国家、研究设计类型、样本量及等位基因频数。
1.4 统计分析
参照Kazeem 等[13]提供的方法合并TDT 和病例对照研究的数据。采用Cochran’s Q 检验对纳入研究进行异质性评价,若Q 统计量的Pheterogeneity<0.1则认为各研究间存在异质性,从而采用随机效应模型对数据进行合并,反之,采用固定效应模型。分层分析依次以研究设计类型、样本量大小和研究人群来源作为分层因素。采用漏斗图和Egger’s回归检验来识别发表偏倚,并通过敏感性分析评价Meta分析结果的稳定性。以上所有统计分析均采用R 软件的Catmap V 1.6 软件包完成(http://www.r-project.org)。除 Q 检验的Pheterogeneity外,其余P 值的显著性水平均为0.05。
2 结果
2.1 Meta分析所引用文献的基本情况
根据上文所述的检索方法和纳入标准,本次Meta分析初步纳入英文文献23 篇和中文文献3篇。其中Coutinho等[14]2007 年发表的文章疑似与其在2004年发表的文章数据重合,因此未纳入本研究。另外,Guhathakurta等[15]在2006 年发表的文章中,其病例对照研究和家系研究存在样本重叠的情况,为与2008 年Huang等[16]发表的一篇Meta分析文章进行比较,本研究选取其家系研究的数据。因此,本次Meta分析最终纳入22 篇英文文献和3 篇中文文献,其中包括家系研究19项,累积家庭1 788个;病例对照研究6项,累积病例510例,对照835 例。纳入文献的基本情况见表1。
2.2 Meta分析结果
异质性检验显示纳入Meta分析的25 项研究之间存在异质性(Pheterogeneity=0.000),因此采用随机效应模型合并数据。合并后OR 值为1.10(95%CI=0.95~1.26),显示5-HTTLPR 与ASD 易感性之间不存在统计学关联。图1 为合并病例对照和TDT 研究的Meta分析森林图。
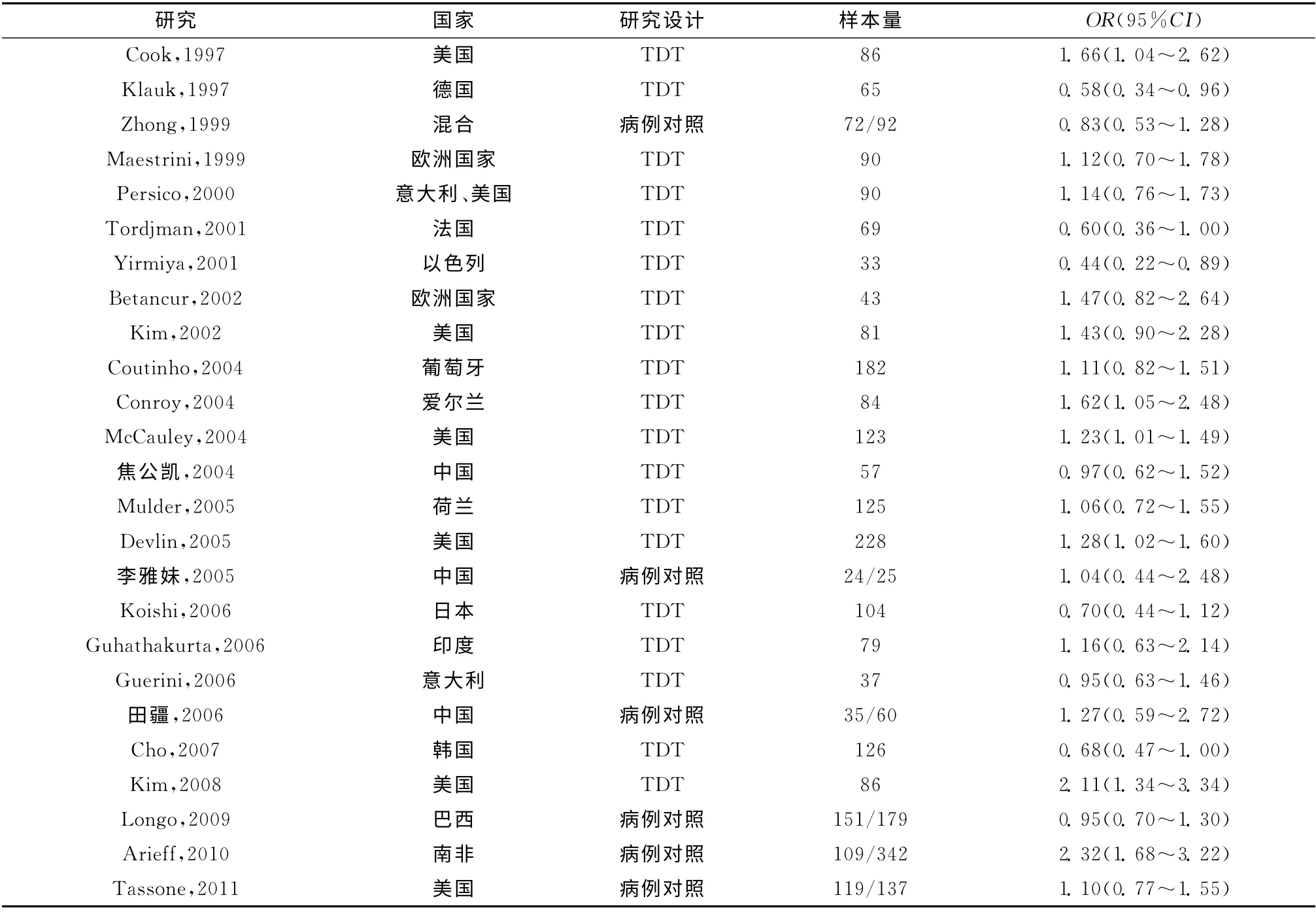
表1 Meta分析中引用文献的基本特征Table 1 Characteristics of studies included in the meta-analysis
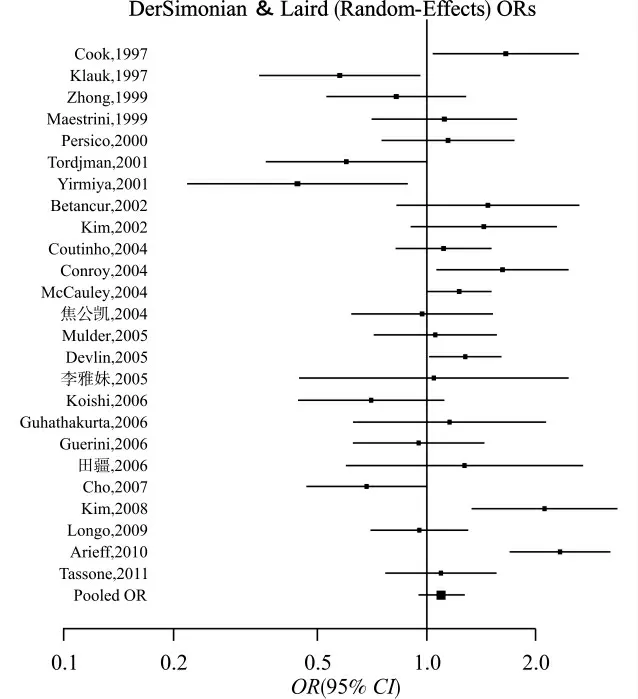
图1 合并病例对照研究和TDT 研究的Meta分析森林图Fig.1 The forest plots of the combined result of case-control and TDT studies on the association between 5-HTTLPR and ASD
2.3 分层分析
首先,按研究设计类型进行分层。分别对6项病例对照研究和19 项TDT 研究进行Meta分析,异质性检验的Pheterogeneity分别为0.001和0.000,故均采用随机效应模型。病例对照研究的合并OR 值为1.19(95%CI=0.83~1.72),TDT 研究的合并OR 值为1.07(95%CI=0.92~1.25),表明无论是对病例对照研究还是对TDT 研究的Meta分析均显示,5-HTTLPR与ASD 发病风险无关。
其次,按样本量大小进行分层。本次研究把家庭数大于150的TDT 研究和病例数大于150的病例对照研究归为大样本研究,小于等于150的归为小样本研究。异质性检验结果显示,大样本研究之间不存在异质性(Pheterogeneity=0.317),采用固定效应模型合并数据,合并OR 值为1.14(95%CI=0.98~1.34);而小样本研究之间依然存在异质性(Pheterogeneity=0.000),随机效应模型合并OR 值为1.09(95%CI=0.92~1.29),表明无论是对大样本研究还是对小样本研究的Meta分析均显示,5-HTTLPR 与ASD 发病风险无关。
最后,按研究人群来源进行分层分析。根据每个研究的研究对象所来自的地域不同,我们将纳入的研究划分为美洲人群、欧洲人群和亚洲人群3层。结果显示,8项针对美洲人群研究的合并OR 值为1.25(95%CI=1.12~1.40,Pheterogeneity=0.154),显示5-HTTLPR与ASD 发病风险有关,且等位基因S为危险型;9项针对欧洲人群的研究的合并OR 值为1.03(95%CI=0.84~1.28,Pheterogeneity=0.043),未发现5-HTTLPR 与ASD 发病风险相关;4 项针对亚洲人群的研究的合并OR 值为0.81(95%CI=0.66~0.99,Pheterogeneity=0.267),支持5-HTTLPR与ASD 发病风险相关,但等位基因L 为危险型。另外2项研究由于研究人群分别是非洲人群[17]和混合人群[18],所以未纳入本次分层分析。分层分析结果见表2。
2.4 敏感性分析
为考察各研究对于总体合并OR 值的影响,我们采用了文献逐一剔除的敏感性分析方法。敏感性分析的结果显示,剔除任何一项独立研究之后本研究结果均未发生本质变化,表明本次Meta分析的结果较为稳定(表3)。
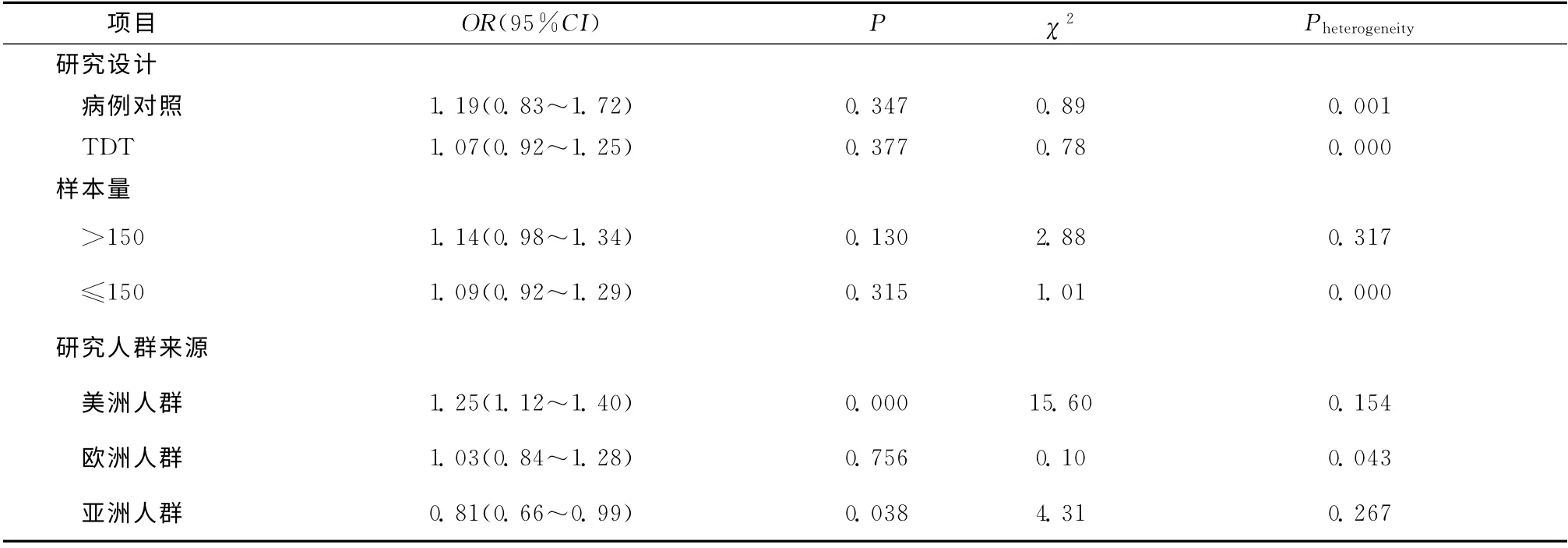
表2 分层分析Table 2 Stratified analysis
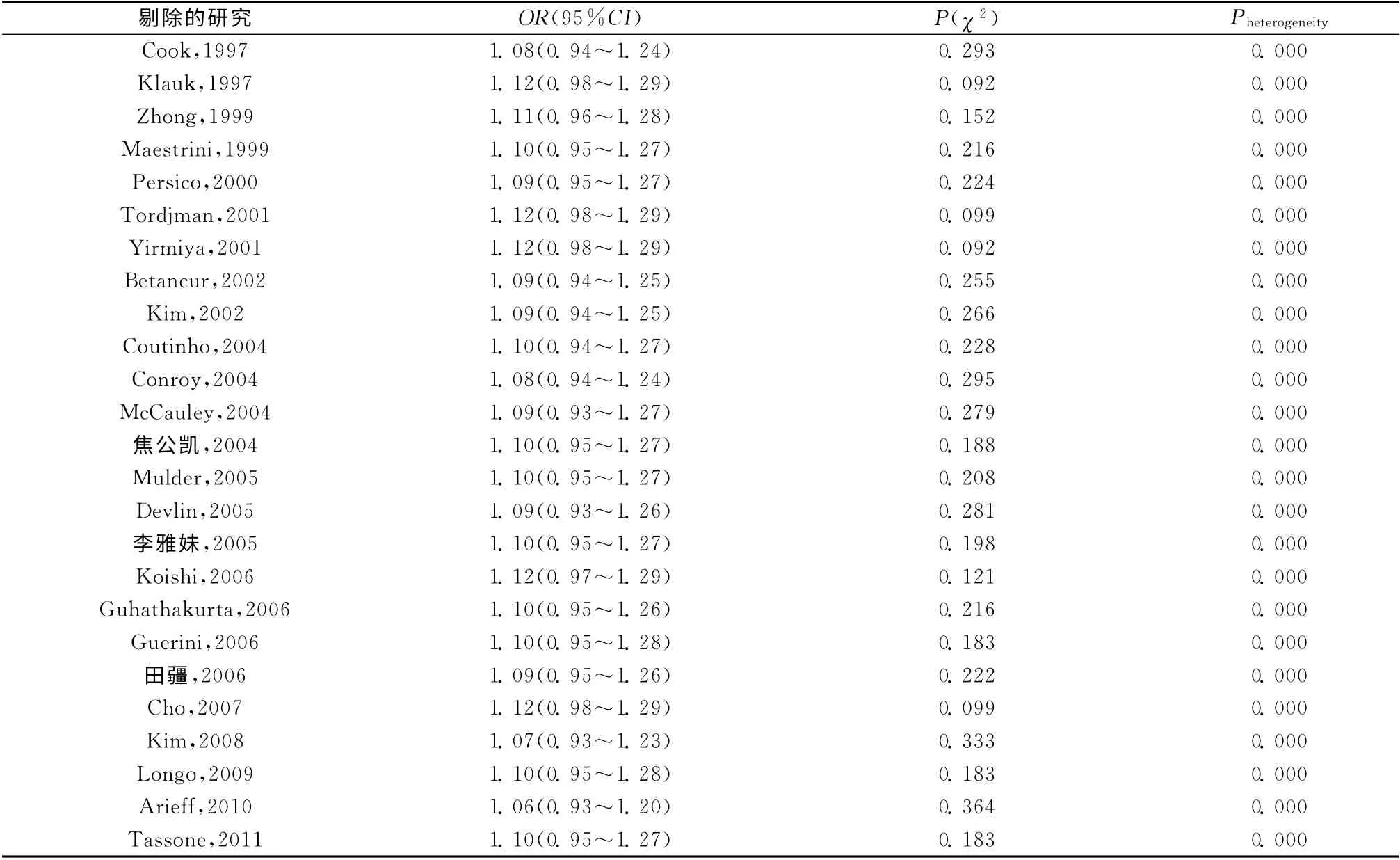
表3 敏感性分析Table 3 Sensitivity analysis
2.5 发表偏倚的估计
漏斗图显示(图2),散点分布基本对称,且Egger’s回归检验表明本次Meta分析不存在明显发表偏倚(P=0.366)。
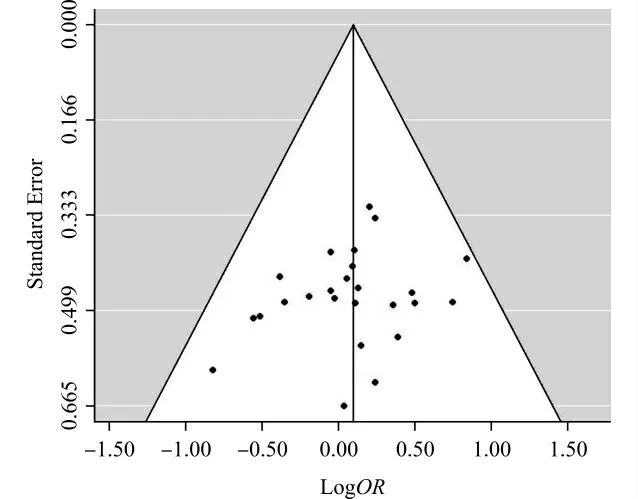
图2 合并病例对照研究和TDT 研究的Meta分析漏斗图Fig.2 The funnel plots of the combined result of case-control and TDT studies on the association between 5-HTTLPR and ASD
3 讨论
本研究采用Meta分析的方法整合1 788个孤独症家系、510例病例和835例对照的研究数据后发现,5-HTTLPR与ASD 的发病风险之间无显著相关。敏感性分析显示该结果具有较好的稳定性,且经漏斗图和Egger’s回归检验,本次Meta分析不存在明显的发表偏倚。此外,由于TDT 研究可以有效避免在病例对照研究中由于人群分层问题而导致的虚假关联,因而将两种设计类型的研究进行合并分析,无疑可以在较大程度上保证结果的准确性。
5-羟色胺转运体基因(5-HTT)是位于17号染色体端粒区的长度为37.8kb的一段序列[19],该基因启动子区域的一段22bp的可变数目串联重复序列(variable number of tandem repeat,VNTR)的存在,使得它有2 个等位基因S(14 次重复)和L(16次重复)[20],表现为5-羟色胺转运体长度多态性(5-HTTLPR)。5-羟色胺是中枢神经系统发育的重要神经递质,多项研究发现在部分患者体内存在5-羟色胺的高表达,且5-羟色胺转运体抑制剂能有效改善孤独症患儿的重复刻板行为和攻击行为。基于以上原因,一直以来5-HTTLPR 作为影响ASD 风险发病的重要多态位点之一而被广泛研究。然而,有关5-HTTLPR与ASD 之间关系的多项研究结果并不一致。在Cook等[12]首次报道5-HTTLPR 的S等位基因会显著增加ASD 发病风险之后,有5项研究支持他的结论[17,21-24],但有2项研究的结论与之相反[25-26],认为L 等位基因才是增加ASD 发病风险 的 危 险 等 位 基 因,另 外 17 项 研究[15,17-18,21-24,27-41]并没有发现5-HTTLPR 与ASD之间存在显著关联。为了明确二者之间的关系,本次Meta分析整合了这25个研究,其结果是尚无足够的证据表明5-HTTLPR 与ASD 之间存在显著关联。
为了探索异质性的来源,我们进行了分层分析。以研究设计类型作为分层因素进行分析后,各层异质性并未消失,显示该因素不是异质性的来源。然而,以样本量大小和研究人群来源作为分层因素进行分析后,在大样本、美洲人群及亚洲人群的各研究间并未发现显著异质性,提示这两个因素可以解释部分异质性。值得关注的是,5-HTTLPR 与ASD之间的关系在不同地域人群中存在较大差异,体现为:在美洲人群中,S等位基因与ASD 发病风险的增加显著相关;在亚洲人群中,L 等位基因与ASD发病风险的增加显著相关;而在欧洲人群中,未发现两者之间的关联。这一现象可能是由于不同人群中5-HTT 的突变率不同所致。然而,由于纳入本次Meta分析的大部分研究仅提供了研究人群选取的地域信息,缺乏相关的人种信息,因而在本研究中只能以研究人群来源地域作为分层因素,从而可能存在同一地域种族混杂的情况,在一定程度上影响了结果的解释。
综上所述,本研究尚未发现5-HTTLPR 与ASD 发病风险之间存在明显关联。然而,基于ASD是一种由环境因素和遗传因素共同作用而导致的复杂性疾病,本研究只考虑了遗传因素对ASD 的影响,且只提取了5-HTT 基因上一个位点的多态性信息,从而限制了基因-基因,基因-环境交互作用的探讨,具有一定局限性。此外,5-HTTLPR 与ASD发病风险之间的关系在不同地域人群中可能存在较大差异,今后仍需进一步探讨。
[1] Elsabbagh M,Divan G,Koh Y J,et al.Global prevalence of autism and other pervasive developmental disorders[J].Autism Res,2012,5(3):160-179.
[2] 王佳,于聪,孙彩虹,等.孤独症患儿236名家庭疾病负担状况调查[J].中国学校卫生,2010,31(2):138-140.
[3] Freitag C M.The genetics of autistic disorders and its clinical relevance:a review of the literature[J].Mol Psychiatry,2006,12(1):2-22.
[4] Bailey A,Le Couteur A,Gottesman I,et al.Autism as a strongly genetic disorder:evidence from a British twin study[J].Psychol Med,1995,25(1):63-77.
[5] Muhle R,Trentacoste S V,Rapin I.The genetics of autism[J].Pediatrics,2004,113(5):e472-e486.
[6] Murphy D L,Lerner A,Rudnick G,et al.Serotonin transporter:gene,genetic disorders,and pharmacogenetics[J].Mol Interv,2004,4(2):109-123.
[7] Abramson R K,Wright H H,Carpenter R,et al.Elevated blood serotonin in autistic probands and their first-degree relatives[J].J Autism Dev Disord,1989,19(3):397-407.
[8] Piven J,Tsai G,Nehme E,et al.Platelet serotonin,apossible marker for familial autism[J].J Autism Dev Disord,1991,21(1):51-59.
[9] Anderson G M,Freedman D X,Cohen D J,et al.Whole blood serotonin in autistic and normal subjects[J].J Child Psychol Psyc,1987,28(6):885-900.
[10] McDougle C J,Naylor S T,Cohen D J,et al.A double-blind,placebo-controlled study of fluvoxamine in adults with autistic disorder[J].Arch Gen Psychiat,1996,53(11):1001-1008.
[11] Hollander E,Phillips A T,Yeh C C.Targeted treatments for symptom domains in child and adolescent autism[J].Lancet,2003,362(9385):732-734.
[12] Cook E,Courchesne R,Lord C,et al.Evidence of linkage between the serotonin transporter and autistic disorder[J].Mol Psychiatry,1997,2(3):247-250.
[13] Kazeem G,Farrall M.Integrating case-control and TDT Studies[J].Ann Hum Genet,2005,69(3):329-335.
[14] Coutinho A M,Sousa I,Martins M,et al.Evidence for epistasis between SLC6A4and ITGB3in autism etiology and in the determination of platelet serotonin levels[J].Hum Genet,2007,121(2):243-256.
[15] Guhathakurta S,Ghosh S,Sinha S,et al.Serotonin transporter promoter variants:Analysis in Indian autistic and control population[J].Brain Res,2006,1092(1):28-35.
[16] Huang C H,Santangelo S L.Autism and serotonin transporter gene polymorphisms:A systematic review and meta-analysis[J].Am J Med Genet B,2008,147B(6):903-913.
[17] Arieff Z,Kaur M,Gameeldien H,et al.5-HTTLPR polymorphism:analysis in South African autistic individuals[J].Hum Biol,2010,82(3):291-300.
[18] Zhong N,Ye L,Ju W,et al.5-HTTLPR variants not associated with autistic spectrum disorders[J].Neurogenetics,1999,2(2):129-131.
[19] Ramamoorthy S,Bauman A L,Moore K R,et al.Antidepressant-and cocaine-sensitive human serotonin transporter:molecular cloning,expression,and chromosomal localization[J].Proc Natl Acad Sci USA,1993,90(6):2542-2546.
[20] Heils A,Teufel A,Petri S,et al.Allelic variation of human serotonin transporter gene expression[J].J Neurochem,2002,66(6):2621-2624.
[21] Conroy J,Meally E,Kearney G,et al.Serotonin transporter gene and autism:a haplotype analysis in an Irish autistic population[J].Mol Psychiatry,2004,9(6):587-593.
[22] McCauley J,Olson L,Dowd M,et al.Linkage and association analysis at the serotonin transporter(SLC6A4)locus in a rigid-compulsive subset of autism[J].Am J Med Genet B Neuropsychiatr Genet,2003,127(1):104-112.
[23] Devlin B,Cook E,Coon H,et al.Autism and the serotonin transporter:the long and short of it[J].Mol Psychiatry,2005,10(12):1110-1116.
[24] Kim S J,Brune C W,Kistner E O,et al.Transmission disequilibrium testing of the chromosome 15q11-q13region in autism[J].Am J Med Genet B Neuropsychiatr Genet,2008,147(7):1116-1125.
[25] Kluck S M,Poustka F,Benner A,et al.Serotonin transporter(5-HTT)gene variants associated with autism?[J].Hum Mol Genet,1997,6(13):2233-2238.
[26] Yirmiya N,Pilowsky T,Nemanov L,et al.Evidence for an association with the serotonin transporter promoter region polymorphism and autism[J].Am J Med Genet,2001,105(4):381-386.
[27] Maestrini E,Lai C,Marlow A,et al.Serotonin transporter(5-HTT)and gamma-aminobutyric acid receptor subunit beta3(GABRB3)gene polymorphisms are not associated with autism in the IMGSA families.The International Molecular Genetic Study of Autism Consortium[J].Am J Med Genet,1999,88(5):492-496.
[28] Persico A M,Militerni R,Bravaccio C,et al.Lack of association between serotonin transporter gene promoter variants and autistic disorder in two ethnically distinct samples[J].Am J Med Genet,2000,96(1):123-127.
[29] Tordjman S,Gutknecht L,Carlier M,et al.Role of the serotonin transporter gene in the behavioral expression of autism[J].Mol Psychiatry,2001,6(4):434-439.
[30] Betancur C,Corbex M,Spielewoy C,et al.Serotonin transporter gene polymorphisms and hyperserotonemia in autistic disorder[J].Mol Psychiatry,2002,7(1):67-71.
[31] Kim S,Cox N,Courchesne R,et al.Transmission disequilibrium mapping at the serotonin transporter gene(SLC6A4)region in autistic disorder[J].Mol Psychiatry,2002,7(3):278-288.
[32] Coutinho A,Oliveira G,Morgadinho T,et al.Variants of the serotonin transporter gene(SLC6A4)significantly contribute to hyperserotonemia in autism[J].Mol Psychiatry,2004,9(3):264-271.
[33] Mulder E J,Anderson G M,Kema I P,et al.Serotonin transporter intron 2polymorphism associated with rigid-compulsive behaviors in Dutch individuals with pervasive developmental disorder[J].Am J Med Genet B Neuropsychiatr Genet,2005,133(1):93-96.
[34] Koishi S,Yamamoto K,Matsumoto H,et al.Serotonin transporter gene promoter polymorphism and autism:a familybased genetic association study in Japanese population[J].Brain Dev,2006,28(4):257-260.
[35] Guerini F R,Manca S,Sotgiu S,et al.A family based linkage analysis of HLA and 5-HTTLPR gene polymorphisms in Sardinian children with autism spectrum disorder[J].Hum Immunol,2006,67(1):108-117.
[36] Cho I H,Yoo H J,Park M,et al.Family-based association study of 5-HTTLPR and the 5-HT2A receptor gene polymorphisms with autism spectrum disorder in Korean trios[J].Brain Res,2007,1139:34-41.
[37] Longo D,Schüler-Faccini L,Brandalize A P C,et al.Influence of the 5-HTTLPR polymorphism and environmental risk factors in a Brazilian sample of patients with autism spectrum disorders[J].Brain Res,2009,1267:9-17.
[38] Tassone F,Qi L,Zhang W,et al.MAOA,DBH,and SLC6A4 variants in CHARGE:a case-control study of autism spectrum disorders[J].Autism Res,2011,4(4):250-261.
[39] 田疆.儿童孤独症危险因素的研究[D].天津:天津医科大学,2006.
[40] 李雅妹,孙晓勉,何文,等.儿童孤独症与5-羟色胺转运体基因连锁多态性区域的关联性研究[J].临床精神医学杂志,2005,15(5):264-266.
[41] 焦公凯,王伟勇,张志珺,等.5-羟色胺转运体基因多态性与儿童孤独症核心家系的关联研究[J].中国神经精神疾病杂志,2004,30(5):382-383.

