南极磷虾中虾青素超临界CO2 萃取方法研究
翁 婷,金银哲,陶宁萍 ,王锡昌
上海海洋大学食品学院,上海201306
磷虾是一类多年生的海洋浮游甲壳动物,属节肢动物门、甲壳纲、磷虾目,体形似小虾,长4~5 cm,最大的可达7 cm。目前共发现的磷虾共有85种,生活在南极水域的11 种磷虾统称为南极磷虾,其中数量最多、个体最大的是南极大磷虾,也就是我们平常所称的南极磷虾(Euphausia superba)[1]。据最新预测数据,南极约有6.5~10 亿吨的磷虾资源,几乎整个南极海域都有分布。开发和利用南极磷虾资源不仅具有重要的经济价值,而且具有重要的社会意义。俄罗斯和日本等国将南极磷虾加工成传统的海产品,已经上市很多年。欧美等西方国家也相继成功开发南极磷虾油,该制品被认为可预防心脑血管疾病、炎症、恶性肿瘤、痴呆症、糖尿病、视力减退等多种疾病。这些功能被推测是由多种不饱和脂肪酸和其它脂溶性物质(类胡萝卜素、维生素、甾醇等)相互叠加效应造成的。类胡萝卜素主要存在于南极磷虾的甲壳中,含量约为3~4 mg/100 g 冰鲜样,其中含有丰富的虾青素[2]。因此,南极磷虾是提取虾青素的良好原料。
类胡萝卜素(Carotenoids),分子式一般为C40H56,是一类呈黄色、橙红色或红色的多烯类物质。它是国际公认的具有生理活性的功能性色素,是人体及动物维生素A 的重要来源;同时也是一类非常有效的抗氧化剂,具有很高的经济价值。虾青素(Astaxanthin)是类胡萝卜素的含氧衍生物,属于酮式类胡萝卜素,全称为3,3'-二羟基-4,4'-二酮基-β,β'-胡萝卜素。虾青素中4 个异戊二烯以共轭双键结构存在,其自由基淬灭活力是β-胡萝卜素的10倍、维生素E 的100 倍,同时具有抵御紫外线、抗肿瘤、提高免疫力、增强神经连通和改善生育等作用,在食品添加剂、水产养殖、化妆品及保健品等方面具有广阔的应用前景。
类胡萝卜素的提取方法有很多种,一般采用溶剂法来提取甲壳类动物的类胡萝卜素[3]。选用提取剂在考虑提取效果的同时,也要考虑溶剂的毒性。氯仿等试剂,提取效果明显,但毒性较大,易挥发,并存在致癌风险。工业上,常用正己烷等溶剂提取类胡萝卜素,这些溶剂提取效果差,成本高,提取过程中易造成活性成分的氧化降解。超临界CO2萃取技术(Supercritical CO2extraction,SC-CO2extraction)是近年来发展的一种新型的分离技术,因具有低温、操作简单、效率高、无污染、选择性强等特点,被称为天然产物研究与开发中的一种具有相当发展潜力的高新提取分离方法,可适用于虾青素的提取。
分光光度法(Spectrophotometry)和高效液相色谱法(High performance liquid chromatography,HPLC)是常用的两种类胡萝卜素分析方法,这两种方法各有特点,分别适用于不同的分析测定要求。HPLC 法测定因其分析精确度高,重复性高等优点可用于虾青素的定量测定。分光光度法虽然不能分离测定单种类胡萝卜素的量,但作为总类胡萝卜素测量的常用方法,具有快速、简单、易操作、经济实用的特点。
目前,超临界CO2流体萃取虾青素的研究集中于藻类和甲壳类废弃物,主要影响因素有:样品原料特性、萃取压力、温度、时间、CO2用量和流速、夹带剂的选择和用量。国内外以超临界CO2流体萃取南极磷虾中虾青素的研究报道较少。Abdelkader[4]等以超临界CO2萃取南极磷虾虾青素,比较超临界CO2法和有机溶剂法,实验结果显示,超临界CO2法萃取效果明显优于有机溶剂法。该研究仅讨论了萃取温度,压力对虾青素萃取率的影响。Reverchon E[5]等人的研究结果显示,超临界CO2流体为非极性溶剂,在提取过程中,添加适量的极性夹带剂,可以有效地提高虾青素的溶解力和选择性。一般常用的夹带剂有乙醇,二氯甲烷等,从食品安全的角度考虑,乙醇因其无毒的特点而成为人们使用最多的夹带剂。本研究选用冻干的南极磷虾作为研究对象,采用超临界CO2萃取法萃取南极磷虾中的虾青素,并结合高效液相色谱法,分析讨论夹带剂(无水乙醇)用量,萃取压力和温度对萃取率的影响,从而确定最佳工艺参数,为工业大规模提取南极磷虾虾青素提供基础理论依据,促进加工企业的发展和渔业资源的可持续利用。
1 材料与方法
1.1 实验材料
南极磷虾由我国“南极海洋生物资源开发利用项目组”于南极FAO 48.1 区捕捞,船上冻结后-20℃左右冻藏,冷冻方式运至实验室。每块完整的南极磷虾约20 kg(规格为23 ×14 ×6 cm)经塑料密封包装,并贮藏于-30 ℃冰柜直至使用。经测定,该批次南极磷虾中水分含量为78.26 ±0.03%,粗脂肪含量为3.87 ±0.05%,灰分含量为3.08 ±0.03%,粗蛋白含量为13.68 ±0.04%。对其进行冷冻干燥后,经测定水分含量为2.19~3.81 g/100 g,迅速碾磨粉碎,颗粒大小约为0.180~0.250 mm,分别装入自封袋中,避光、密封于-80 ℃以下待用。
CO2、N2纯度大于99.99%,购自上海利旦气体有限公司;虾青素标准品,CA10307000,纯度为>95. 5%,购自Dr. Ehrenstorfer GmbH,德国;甲醇(MeOH)、二氯甲烷(DCM)、乙腈(ACN)、水为色谱纯,其余试剂为分析纯,GF254硅胶薄层板,购自国药试剂有限公司。
1.2 主要仪器、设备
Spe-ed SFE-2 超临界萃取仪,美国Applied Separations 公司;Waters e2695 高效液相色谱仪,配有2998 紫外检测器,美国Waters 公司;XbridgeTMC18色谱柱(4. 6 × 250 mm,5 μm),美国Waters 公司;Avanti J-26 XP 真空冷冻离心机,美国Beckman Coulter 公司;UV-2000 型紫外可见分光光度计,尤尼柯(上海)仪器有限公司;A11 组织匀浆机,德国IKA公司;BT224S 分析天平;层析缸,10 ×20 cm,上海生工生物工程公司。
1.3 实验方法
1.3.1 类胡萝卜素的提取和测定
总类胡萝卜素的提取和测定参照Chalida Niamnuy 等的方法[6],在其基础上进行改进。称取3.5 g左右冻干的南极磷虾样品,置于50 mL 离心管,加入20 mL 丙酮,均质2 min,4 ℃、5000 g 离心10 min,收集上清液,重复4 次萃取,直至上清液基本无色,合并丙酮萃取液于分液漏斗中。向分液漏斗中加入等量的石油醚(80 mL),充分摇动,再加入100 mL 的氯化钠溶液(0.1%,w/v),静置分层,弃去下相,无水Na2SO4干燥、过滤,滤液40 ℃以下减压浓缩至干,即得南极磷虾类胡萝卜素提取物。将提取物溶解于25 mL 的正己烷中,以相应的有机溶剂作对照,置于1 cm 加盖石英吸收池内,扫描样品的吸收光谱,扫描范围为350~600 nm,虾青素标样作对照品,分光光度计法测定提取物中类胡萝卜素的含量。
1.3.2 类胡萝卜素的分离
类胡萝卜素的鉴定方法参照文献中的方法[7]。薄层层析展开剂体积比为丙酮:正己烷=1∶3,层析板为硅胶G 薄层板,使用前110 ℃下活化30 min。取一定量样品、虾青素标准品多次点样于硅胶板上,待点样点风干后,放入已盛有展开剂的层析缸进行展开,待展开剂到达距硅胶板上层边缘2 cm 左右时取出。
1.3.3 超临界CO2流体萃取南极磷虾虾青素
称取12 g 左右样品均匀填置于50 mL 萃取釜内,加入夹带剂无水乙醇,设定萃取温度、分离温度,检查设备的气密性。打开CO2、N2贮气罐阀门,从钢瓶中流出的CO2经净化进入冷凝箱液化冷凝至流体,与N2一起经高压计量泵加压至所需的萃取压力,然后经加热器加热至设定温度,由底部进入萃取釜内进行萃取,静态萃取30 min 后,打开分离阀动态萃取3 h,收集萃取物待用。考察以下3 个因素对虾青素的提取效果:夹带剂用量(0.30、0.50、0.67、0.83、1.00 mL/g 干样)、萃取温度(45、50、55、60、65℃)、萃取压力(20、25、30、35、40 MPa)。
1.3.4 HPLC 测定虾青素含量
色谱柱为XbridgeTMC18柱(4. 6 × 250 mm,5 μm);流动相为MeOH-DCM-ACN-H2O(85∶5∶5∶5,v/v);流速为1.0 mL/min;柱温为30 ℃;进样量为20 μL;紫外检测器;检测波长480 nm;采用色谱峰保留时间定性,外标法峰高定量。准确称取虾青素对照品10 mg,用混合溶剂(MeOH-DCM,2∶1,v/v)溶解定容至25 mL 棕色容量瓶中作为虾青素的对照品储备液,实验所用低浓度的对照品溶液由混合溶剂稀释而得,溶液保存于4 ℃冰箱。将减压浓缩的类胡萝卜素提取物和不同条件下的超临界萃取物,用混合溶剂定容至一定体积,混匀得样品溶液,微孔滤膜(0.45 μm)过滤后测定虾青素的含量,计算虾青素得率(%)=超临界萃取物中虾青素含量/原料中虾青素含量×100%。
1.4 数据处理
分析测定均做三次平行,数据统计分析用SPSS 13.0 处理,描述性统计值使用平均值± 标准差(mean±SD)表示。
2 结果与讨论
2.1 类胡萝卜素的吸收光谱
以正己烷为溶剂,配置一定浓度的虾青素溶液,用分光光度计对其进行波长扫描(350~600 nm),实验结果如图1 所示,虾青素溶液和南极磷虾类胡萝卜素样品的吸收光谱基本相同,在470~475 nm的范围内,虾青素和南极磷虾类胡萝卜素样品的吸光值之间的差别不大,这与相关研究中报道的虾青素是南极磷虾主要类胡萝卜素的结果相符合[2]。因此可选择该范围内的472 nm 作为测量波长。

图1 类胡萝卜素提取物和虾青素标准品的紫外吸收光谱Fig.1UV absorption spectra of carotenoids extract and astaxanthin standard
2.2 标准曲线的绘制
精密称取1.0 mg 虾青素标准品,用二氯甲烷溶解后移入25 mL 棕色容量瓶中,稀释至刻度,混匀,配成40 μg/mL 的虾青素标准溶液。分别取配制好的虾青素标准溶液0.1、0.2、0.3、0.4、0.5、0.6 mL于25 mL 容量瓶中,加正己烷定容至刻度混匀,相当于0.16、0.32、0.48、0.64、0.80、0.96 μg/mL 作为标准系列对照液。以正己烷为空白调零,可见分光光度计测定472 nm 处的吸光值为纵坐标,虾青素浓度为横坐标,绘制标准曲线,回归线性方程可表示为Y=0.63X-0.0178,相关线性系数为R2=0.9991,结果表明虾青素在0.16~0.96 μg/mL 范围内,吸光度与虾青素浓度呈良好的线性关系。经检测,南极磷虾中含类胡萝卜素的含量为4.80 ±0.08 mg/100 g 干样。
2.3 薄层层析分离类胡萝卜素
本实验中,从右至左依次将虾青素标样、南极磷虾类胡萝卜素的提取物(平行样1、2、3)展开于薄层上,所得图谱如图2,测量各Rf值。由图2 可知,类胡萝卜素的提取物均展开6 个点:A(Rf=0.235,橙色)、B(Rf=0.364,橙色)、C(Rf=0.411,橙色)、D(Rf=0.652,黄色)、E(Rf=0.727,橙色)、F(Rf=0.838,橙色);而在与之对应的虾青素标准品的水平位子上有一对应的橙色斑点,其Rf值为0.232,因此可初步判断样品中存在虾青素。为了进一步确证南极磷虾中含有虾青素。

图2 类胡萝卜素提取物和虾青素标准品的TLC 图谱Fig.2 TLC chromatograms of carotenoids extract and astaxanthin standard
本文采用HPLC 来进一步鉴定。虾青素标准品和南极磷虾类胡萝卜素供试液按HPLC 色谱条件进实验。色谱图如3 所示:南极磷虾类胡萝卜素供试液中相应峰(T=4.30)与虾青素标准品保留时间(T=4.31)极为接近,经二极管阵列检测器210~800 nm 紫外扫描表明,二者紫外吸收图谱极为相似,均在480 nm 处有最大吸收,结合TLC 图谱分析,判断南极磷虾类胡萝卜素供试液保留时间为4.30 min峰为虾青素。经检测,南极磷虾中虾青素的含量为0.80 ±0.04 mg/100 g 干样。
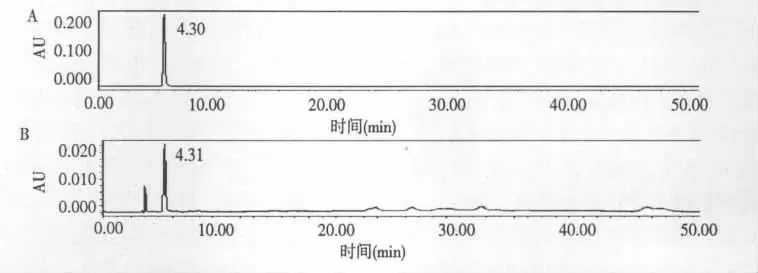
图3 虾青素标准品(A)和类胡萝卜素提取物(B)的HPLC 色谱图Fig.3 Chromatograms of standard astaxanthin (A)and carotenoids extract (B)
2.4 超临界CO2 萃取南极磷虾虾青素研究
2.4.1 超临界CO2萃取南极磷虾虾油
前期的实验[8]中,以超临界CO2萃取南极磷虾虾干中的虾油(图4),考察了萃取压力,温度和时间对于萃取率的影响。实验结果表明,萃取压力,温度和时间对虾油萃取效果影响为:压力>温度>时间。随着压力的增加,超临界CO2流体的密度增加,使得流体的溶解能力增加,同时分子间传质的距离减少,虾油与CO2流体之间的传质效率增加,有利于虾油的萃取。
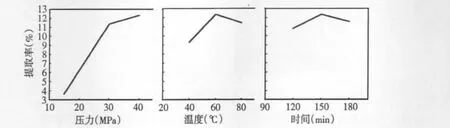
图4 萃取压力、温度和时间对南极磷虾虾油提取率的影响Fig.4 Effects of extraction pressure,temperature and time on the extraction yield of Antarctic krill oil
虾青素是南极磷虾中一种弱极性的脂溶性色素。超临界CO2萃取虾青素过程中添加适量的夹带剂可有效提高虾青素在CO2流体中的溶解力和选择性。Krichnavaruk 等人[9]对比讨论了夹带剂添加前后对虾青素的提取效果的影响,实验结果显示夹带剂添加后,虾青素的提取效果明显提高。本实验采用超临界CO2萃取法提取南极磷虾虾青素,以无水乙醇为夹带剂,考察了夹带剂用量,萃取温度和压力对于南极磷虾中虾青素提取的影响。
2.4.2 夹带剂用量对南极磷虾虾青素得率的影响
固定萃取温度45 ℃、萃取压力25 MPa、静态浸提30 min、动态萃取180 min,考察夹带剂用量(0.30~1.00 mL/g 样品)对南极磷虾虾青素得率的影响,结果见表1。在萃取压力、温度、时间不变的条件下,随着夹带剂用量的增加,南极磷虾虾青素的得率快速增加,伴随着时间的延长,增加幅度减小,萃取趋于饱和。这可能是由于夹带剂的添加,改变了CO2的密度,显著地改变超临界CO2流体的极性,同时与虾青素形成氢键或其他特定的化学作用力,大大增加被分离组分在超临界CO2中的溶解度[10]。随着夹带剂用量的增加,样品萃取近乎饱和,相应溶解度增加效应变缓,所以选择1.00 mL/g 作为超临界CO2萃取南极磷虾虾青素的最佳夹带剂用量。
2.4.3 萃取温度对南极磷虾虾青素得率的影响
固定萃取压力25 MPa、静态浸提30 min、动态萃取180 min、夹带剂用量1.00 mL/g 样品,考察萃取温度(40~65 ℃)对南极磷虾虾青素得率的影响,结果见表1。在萃取压力,时间和夹带剂用量不变得条件下,南极磷虾虾青素的得率随着萃取温度的升高而增加,在60 ℃时达到最大值81. 34 ±1.37%,超过60 ℃时,虾青素的得率略有下降。超临界CO2萃取过程中,升高温度增加了物质的扩散系数而有利于萃取,同时降低了超临界流体的密度,使物质的溶解度降低而不利于萃取。因此,得率的高低取决于温度改变后,超临界流体密度和物质的扩散系数二者之间的相互作用[10]。低于60 ℃时,得率随着温度升高而增大,这由于物质的扩散系数增加占主导地位;高于60 ℃时,得率随着温度的升高而减小,这由于超临界流体密度降低占主导地位。此外,虾青素是热敏性物质,萃取温度过高容易导致降解,活性失活。所以选择60 ℃作为超临界CO2萃取南极磷虾虾青素的最适宜萃取温度。
2.4.4 萃取压力对南极磷虾虾青素得率的影响
固定夹带剂用量1.00 mL/g 样品、萃取温度60℃、静态浸提30 min、动态萃取180 min,考察压力从20~40 MPa 变化对南极磷虾虾青素得率的影响,结果见表1。在20~40 MPa 之间,南极磷虾虾青素的得率随压力的升高而增加,在35 MPa 时达到最大值84.41 ±0.57%。这主要是因为随着压力的增加,超临界CO2流体的密度增加,使得流体的溶解能力增加,同时分子间传质的距离减少,虾青素与CO2流体之间的传质效率增加,有利于虾青素的萃取。超过35 MPa 后,颗粒之间堆积密度过大,减少了虾青素与CO2流体的接触面积及萃取通道[10],达不到最佳的萃取效果,因此得率略有下降。此外,压力的增加导致仪器的要求提高,实验成本的增加,同时也增加了不安全因素。所以选择35 MPa 为超临界CO2萃取南极磷虾虾青素的最适宜萃取压力。
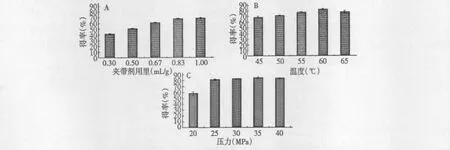
图5 夹带剂用量(A)、萃取压力(B)和温度(C)对南极磷虾虾青素得率的影响Fig.5 Effects of the concentration of entrainer (A),pressure (B)and temperature(C)on the astaxanthin extraction yield of Antarctic krill
2.5 多元逐步回归模型的建立
SPSS 13.0 软件中多元逐步回归模型建立可用于揭示被解释变量与其他多个解释变量间的线性关系。逐步回归分析时,软件对自变量逐步引进并检验、剔除不显著变量,直到没有显著的变量引入回归方程为止。本研究中,3 个变量夹带剂用量,萃取温度和萃取压力分别以A、B、C 表示,利用SPSS 13.0软件建立逐步回归模型,综合考虑夹带剂用量,萃取温度和萃取压力对南极磷虾虾青素得率的影响。
表1 是当各步引入影响最大的变量后对其各自的偏回归系数的方差分析。在模型1,变量夹带剂用量(A)引入方程,其偏回归系数的F =30.026,P(sig.)≈0. 000 <0. 01。在模型2,变量萃取压力(C)引入方程,其偏回归系数的F=30.422,P(sig.)≈0.000 <0.01,可见变量夹带剂用量(A),萃取压力(C)依次被引入回归方程时对回归方程的影响均极显著,变量萃取温度(B)的偏回归系数无统计学意义,即对回归方程影响不大,故未被引入回归方程。
表2 是当各步引入对回归方程影响最大的变量时有关的偏回归系数及t 检验。引入变量夹带剂用量(A),得第一回归方程Y =26.388 +49.73A。第二次引入变量萃取压力(C),得第二回归方程Y =4.896 +44.984A +0.952C。变量夹带剂用量(A)、萃取压力(C)所对应的P 值分别为0,0.013 均小于0.05,说明它们的回归检验均有显著性。综上所述,逐步回归方程Y =4.896 +44.984A +0.952C 可用于综合解释夹带剂用量,萃取温度和萃取压力对南极磷虾虾青素得率的影响,其中夹带剂用量和萃取温度对虾青素的提取有着显著性的影响。

表1 多元逐步回归模型的方差分析表cTable 1 ANOVA of stepwise multiple regression modelc

表2 多元逐步回归模型的偏回归系数及其t 检验Table 2 Coefficients of stepwise multiple regression model
3 结论
由以上研究表明,超临界CO2萃取南极磷虾虾青素的适宜工艺条件为:萃取压力为35 MPa,萃取温度60 ℃,夹带剂用量1.00 mL/g,萃取时间3.5 h,虾青素得率达到84.41 ±0.57%。多元逐步回归的模型的建立,得到最优模型为Y = 4. 896 +44.984A+0.952C,结果显示,夹带剂用量和萃取温度对虾青素的提取效果有着显著性影响。本研究为超临界超二氧化碳萃取南极磷虾虾青素提供基础理论依据,增加资源的附加值,促进加工企业的发展和渔业资源的可持续利用,使其发挥更大的社会效益和经济效益。
1 Chen XZ(陈雪忠),Xu ZL(徐兆礼),Huang HL(黄洪亮).Development strategy on Antartic krill resource utilization in China.J Fish Sci Chin (中国水产科学),2009,16:451-458.
2 Yamaguchi K,Miki W,Toriu N,et al.The composition of carotenoid pigments in the Antarctic krill Euphausia superb.Bull Jpn Soc Sci Fish,1983,49:1411-1415.
3 Sachindra NM,Bhaskar N,Mahendrakar NS.Recovery of carotenoids from shrimp waste in organic solvents.Waste Manage,2006,26:1092-1098.
4 Ali-Nehari A,Kim SB,Lee YB,et al. Characterization of oil including astaxanthin extracted from krill (Euphausia superba)using supercritical carbon dioxide and organic solvent as comparative method.Korean J Chem Eng,2012,3:329-336.
5 Reverchon E,Marco ID,Supercritical fluid extraction and fractionation of natural matter. J Supercrit Fluids,2006,38:146-166.
6 Niamnuy C,Devahashtion S,Soponronnari S,et al. Kinetics of astaxanthin degradation and color changes of dried shrimp during storage.J Food Eng,2008,87:591-600.
7 Sánchez-Camargo AP,Almeida Meireles MĀ,Fontoura Lopes BL,et al.Proximate composition and extraction of carotenoids and lipids from Brazilian redspotted shrimp waste (Farfantepenaeus paulensis).J Food Eng,2011,102:87-93.
8 Weng T,Tao NP,Wang XC,et al.Supercritical carbon dioxide extraction of volatile compounds from Antarctic krill (Euphausia superba). Adv Mater Res,2012,396-398:2074-2080.
9 Krichnavaruk S,Shotipruk A,Goto M,et al.Supercritical carbon dioxide extraction of astaxanthin from Haematococcus pluvialis with vegetable oils as co-solvent.Bioresour Technol,2008,99:5556-5560.
10 Siti M,Artiwan S,Motonobu S,et al.Extraction of Astaxanthin from Haematococcus pluvialis using Supercritical CO2as Entrainer.Ind Eng Chem Res,2006,45:3652-3657.

