姜黄素衍生物的合成及抑菌活性研究
王华森,怀其勇
山东大学(威海)海洋学院,威海264209
姜黄素(Curcumin)是多年生草本植物姜黄的主要有效成分之一,是一种黄色略显酸性的二苯基庚烃物质。近年来,大量研究发现姜黄素具有抗氧化、抗菌及免疫调节、抗肿瘤、抗动脉粥样硬化等生理和药理作用[1]。而且,姜黄素作为一种天然药物,并对人畜几乎无毒,其药用价值已经拓展到现代医学的各个领域而倍受关注[2]。文献显示生物素在医药方面除了用于生物素缺乏症的治疗外还可以辅助治疗糖尿病,并且有良好的耐受性和生物兼容性,通过人和各种动物实验发现即便大量的用药也不会产生副作用[3]。硫辛酸具备一般抗氧化剂所不能及的抗氧化性,在德国用于治疗糖尿病性神经病已有数十年历史,其它医用价值也正在得到认可,国内一些厂家亦将其用作肝保护剂,并不断有新用途的报道[4]。而烟酸是临床上常用的调节血脂异常药物[5],而异烟酸为其同分异构体,对其研究也有很大意义。文献研究表明姜黄素结构中的两个酚基、一个活性亚甲基是连接生物分子的抗菌活性潜在靶点,并且含有杂原子的姜黄素酯化物在药效上要强于姜黄素本身[6]。受此启发,本论文利用前药设计原理,针对酚羟基而选用含有杂原子的生物素、异烟酸、硫辛酸和姜黄素进行拼合,利用化学方法成功合成了杂原子化姜黄素,在相同条件下测定了三种产物和姜黄素对金色葡萄球菌的的抑制性能,以期获得稳定性好,生物利用度高,毒副作用小的新型药物。
1 材料与仪器
XT-4 型显微熔点仪(北京泰光仪器公司),WZZ-2S 自动旋光仪(上海精密科学仪器有限公司);1100 液相色谱-G1969A 飞行时间质谱(Agilent);500 MHz 超导核磁共振谱仪(瑞士Bruker Avance);360 FT-IR 型傅里叶变换红外光谱仪(美国Nicolet);必要的有机合成玻璃仪器。
姜黄素AR、生物素BR、二氯亚砜AR、(DL)-α硫辛酸AR、异烟酸AR(国药集团化学试剂有限公司);三氯甲烷AR、二氯甲烷AR、丙酮AR、三乙胺AR、甲醇AR(烟台双双化工有限公司)。实验过程中的溶剂均经过二次干燥重蒸处理。
2 试验方法
2.1 合成
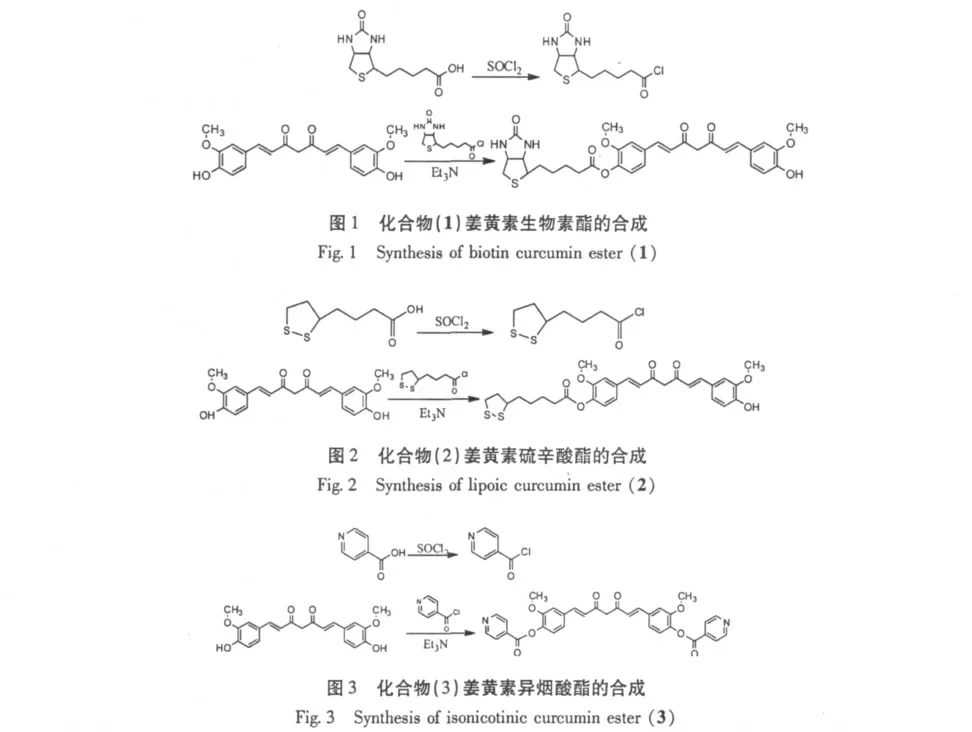
姜黄素生物素酯和姜黄素硫辛酸酯的制备参考文献[7]并作适当改进。TLC 板监测反应完毕,过滤,滤液依次用饱和碳酸氢钠溶液、饱和氯化钠溶液洗涤,有机层用无水硫酸镁干燥,过滤,滤液浓缩。姜黄素生物素酯分离以甲醇:三氯甲烷配比1∶10 为洗脱剂,以F254 硅胶(200~300 目)为固定相,进行柱色谱分离,取第二分离组分,浓缩,真空干燥24 h,得到浅黄色针状晶体,收率为56%。姜黄素硫辛酸酯的分离以同样的方法,以甲醇:三氯甲烷配比1∶25 为洗脱剂,取第一分离组分,浓缩,真空干燥24 h,得深黄色针状晶体,收率为51%。
姜黄素异烟酸酯的合成参考文献[5]并作适当的改进。TLC 板监测反应完毕,过滤,滤液浓缩,依次用饱和碳酸氢钠溶液、饱和氯化钠溶液洗涤,有机层用无水硫酸镁干燥,过滤,滤液浓缩,以甲醇:三氯甲烷配比1∶20 为洗脱剂,取第二分离组分,浓缩,真空干燥24 h。得到深黄色针状晶体,收率为62%。
化合物1 淡黄色针晶(CHCl3):mp. 174~175 ℃;[α]25 D + 83°(c = 0. 42,CH3OH);IR(KBr,ν/cm-1):1762 (C =O),1701 (C = O),1628(C=O),1595,1511 (Ar-H),3536~3290 (br,Ar-OH);1H NMR (500 MHz,CDCl3)δ:0.89~1.37(m,8H,CH2CH2CH2CH2),3. 95 (s,6H,2 ×OCH3),4.21 (m,1H,CH),4.36 (m,3H,CH-CH2),4.81 (s,1H,NH),4.9 (s,2H,CH2),5.92 (s,1H,NH),6.94 (d,2H,J = 14.6 Hz,C2-C6),7.11~7.26 (m,6H,ArH),7.64 (d,2H,J = 14.6 Hz,C1-C7);MS (ESI,m/z):[M+H]+595.2。
化合物2 深黄色针晶(CHCl3):mp. 154~155 ℃;IR (KBr,ν/cm-1):1764 (C=O),1729 (C =O),1629 (C=O),1598,1507 (Ar-H),3536~3290(br,Ar-OH);1H NMR (500 MHz,CDCl3)δ:1. 65(m,2H,CH2),1.49 (m,4H,CH2CH2),2.35~2.37(m,2H,CH2环),3.15 (m,2H,CH2CO),3.88 (m,1H,SCH),4.12 (s,6H,2 × OCH3),6.59 (d,2H,J= 15.0 Hz,C2-C6),7.11~7.26 (m,6H,ArH),7.64 (d,2H,J = 15.0 Hz,C1-C7);MS (ESI,m/z):[M+H]+557.7。
化合物3 深黄色针晶(CHCl3):mp. 225~226 ℃,IR (KBr,ν/cm-1):1743 (C=O),1630 (C =O),1563,1511 (Ar-H);1H NMR (500 MHz,CDCl3)δ:3.88 (s,6H,2 × OCH3),6.64 (m,2H,J = 15.3 Hz,C2-C6),7.11~7.29 (m,6H,ArH),7.64 (d,2H,J = 15.3 Hz,C1-C7),8.03 (d,2H,Pyr-H),8.87(d,2H,Pyr-H);MS (ESI,m/z):[M+H]+579.5。
2.2 产物对金色葡萄球菌的抑制作用[8,9]
2.2.1 菌液的制备
将金色葡萄球菌于最适温度活化2 h 再接入新鲜配制的活化培养基中,摇床培养24 h,将所得菌液稀释成108cfu/mL。
2.2.2 最小抑菌浓度的测定(MIC)
在培养皿中接入108cfu/mL 金色葡萄球菌的试验菌种100 μL,取0.625~200 mg/mL 的浓度梯度杂原子化姜黄素和姜黄素的乙醇溶液,涂于各个培养皿,其中每个浓度做三个平行实验,以无菌生理盐水为空白对照实验,于金色葡萄球菌最佳培养温度培养一个生长周期。
2.2.3 抑菌圈的测定
以经过无菌过滤的乙醇为溶剂空白和阳性对照,以无菌生理盐水为阴性对照。于各培养皿中分别接入108cfu/mL 实验菌种100 μL,将6.0 mm 灭菌滤纸片分别蘸取等量的姜黄素溶液,杂原子化姜黄素溶液,乙醇,无菌生理盐水,贴于已接入试验菌种的平板上,于最佳培养温度培养一个生长周期,测量各抑菌圈的直径。

表1 杂原子化姜黄素对金色葡萄球菌的最小抑菌浓度的测定(37 ℃,24 h)Table 1 MICs of products against Staphylicoccus aureus (cultured 24 h in 37 ℃)
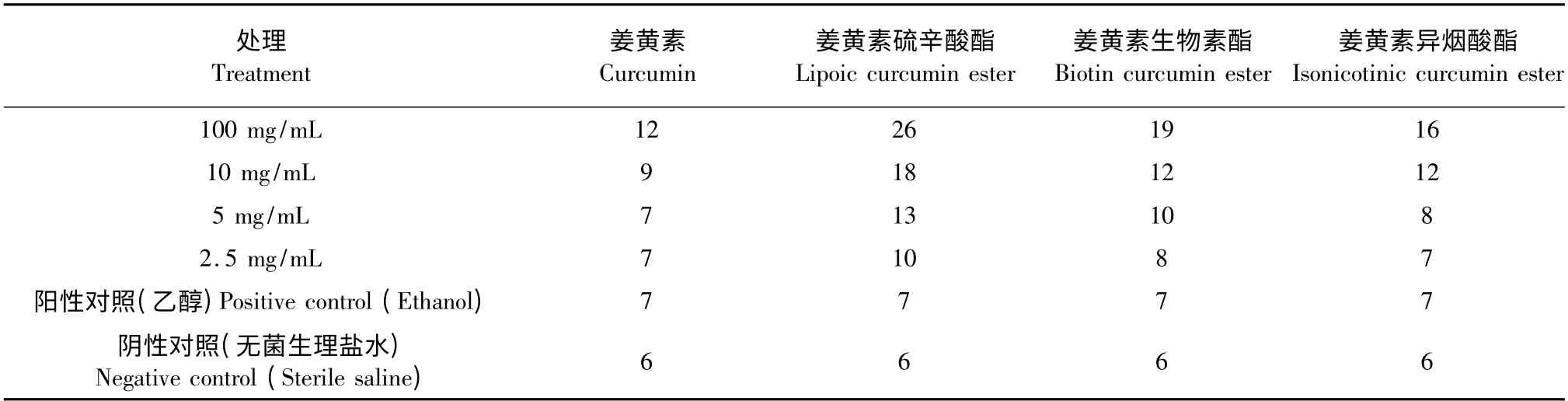
表2 杂原子化姜黄素以及姜黄素对金色葡萄球菌的抑制作用(37 ℃,24 h)Table 2 Diameters of inhibition zone of products against Staphylicoccus aureus (cultured 24 h in 37 ℃)
2.3 实验结果
由实验数据可以明显的看出:对金色葡萄球菌的最小抑菌浓度,姜黄素浓度为10 mg/mL,姜黄素硫辛酸酯为2. 5 mg/mL,姜黄素生物素酯浓度5 mg/mL,姜黄素异烟酸酯为5 mg/mL。在最小浓度条件下,姜黄素硫辛酸酯抑菌圈直径为10 mm,姜黄素生物素酯抑菌圈直径为10 mm,姜黄素异烟酸酯抑菌圈直径为8 mm,对金色葡萄球菌的抑菌活性分别是姜黄素的4 倍、2 倍、2 倍。
3 结论
我们利用化学方法成功的合成了三种杂原子修饰的姜黄素衍生物,在抑菌实验的环节中,我们可以明显的看出姜黄素以及其衍生物对金色葡萄球菌有良好的抑制作用。其中含有硫原子的分子修饰的姜黄素抑菌活性要高于含有氮原子分子修饰的姜黄素。金色葡萄球菌是对人体有害的一种细菌,我们合成的姜黄素衍生物具有强有力的抑菌效果,这会明显的减少药物的摄入量,故在临床上应用的意义重大。因此,对姜黄素衍生物尤其是杂原子修饰的衍生物体外抑菌活性研究将扩大姜黄素的药用范围,并能为其抗菌活性的机制提供理论依据。
1 Forst-Ludwig A,Neumann M,Schneider-Brachert W,et al.Curcumin blocks NF-κB and the motogenic response in Helicobacter pylori-infected epithelial cells.Biochem Biophys Res Commun,2004,316:1065-1072.
2 Selvam C,Jachak SM,Thilagavathi R,et al. Design,synthesis,biological evaluation and molecular docking of curcumin analogues as antioxidant,cyc1ooxygenase inhibitory and antiinflammatory agents.Bioorg Med Chem Lett,2005,15:1793-1797.
3 Mishra S,Karmodiya K,Surolia N,et al.Synthesis and exploration of novel curcumin analogues as anti-malarial agents.Bioorg Med Chem,2008,16:2894-2902.
4 Hu YM(胡玉梅),Xiong L(熊亮),Huang T(黄涛),et al.Synthesis and characterization of lipoylamide. J South-Cent Univ Natl,Nat Sci Ed(中南民族大学学报,自科版),2008,27(4):13-15.
5 He LQ(何黎琴),Wang XS(王效山),Luo D(罗丹).Synthesis of curcumin nicotinate. Chem World(化 学 世 界),2011,3:175-177.
6 Huang SF(黄淑芳),Ying HZ(应华洲),Hu YZ(胡永洲).Synthesis and antitumor activity study of nitrogen containing curcumin derivatives.Chin J Med Chem(中国药物化学杂志),2011,21(2):88-95.
7 Yan CH(颜成虎). Biofunctionalization of polylactide-polyethylene glycol(PLA-PEG)nanoparticles for targeting to brain glioma.Tianjin:Tianjin University(天津大学),MSc.2007.
8 Zhong YY(钟英英),Huang XC(黄晓畅),Chen SY(陈世益).Study on Antibacterial Activity of curcumin in vitro. J Anhui Agri Sci(安徽农业科学),2010,38:19369-19370.
9 Kim KJ,Yu HH,Cha JD,et al.Antibacterial activity of curcuma longa L.against methicillin-resistant Staphylococcus aureus.Phytother Res,2005,19:599-604.

