卤代黄酮类化合物的合成及生物活性的研究
黄初升,陈积常,刘红星
广西师范学院化学与生命科学学院,南宁 530001
黄酮类化合物是一类重要的天然有机化合物,其基本骨架如图 1。它们具有抗病毒[1]、抗肿瘤[2-4]、抗氧化[5,6]、抗菌[7-9]、抗心脑血管[10,11]等广泛的生物活性。主要存在于自然界中,该类化合物不仅类种多,而且结构复杂,作用靶点多,但其具有溶解度差、生物利用度不高等缺点,从而限制它们应用的价值。因此,药物化学家尝试通过在黄酮不同的位置引入卤原子来提高它们的生物利用度、提高其生物活性、改善它们在生物体内新陈代谢的稳定性等,本文笔者综述了目前国内外在黄酮不同位置引入卤素的合成方法及一些卤代黄酮类化合物的生物活性。

图1 黄酮类化合物的基本骨架Fig.1 Basic chemical skeleton of flavonoid
1 C环3位卤代黄酮的合成
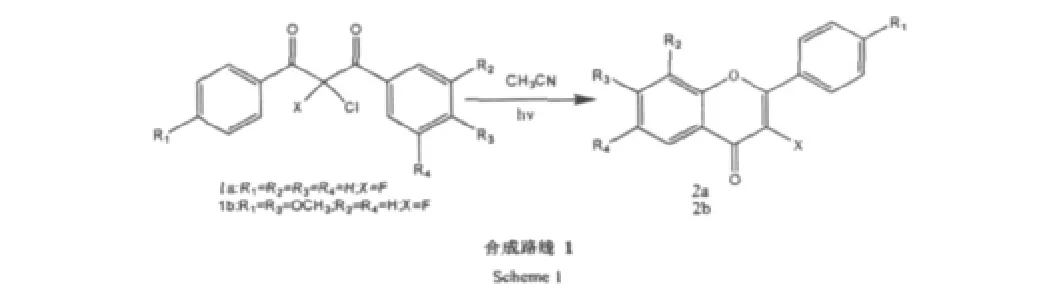
Košmrlj[12]等人以 2-氯-取代 1.3-二芳基 β-1.3丙-二酮为原料在光照及乙腈的作用下合成一系列的3-F黄酮,反应时间短,获得良好的产率。合成路线见Scheme 1。
Quintin[13]等人通过半合成的方法以3'-硝基橘皮素为中间体分别合成3-氯黄酮和3-溴代黄酮,发现这几种黄酮对KB细胞和HL60细胞都具有良好的活性,化合物8对两种细胞的IC50值分别是0.14 μM 、4.5 μM,化合物9对 HL60细胞的 IC50值3.6 μM,对KB细胞有良好的抑制作用,化合物8、9对两种癌细胞活性比这两个化合物3位没有卤素取代还好。可见,在该类化合物3位引入卤原子可提高他们的生物活性,引入氯原子比引入溴原子对两种癌细胞活性更好。化合物8、9合成路线见Scheme 2。

Menichincheri[14]等人以 2-羟基-3,4-二甲氧基苯乙酮与 3,4-二甲氧基苯甲酰氯反应成脂,在KOH/Py的作用下发生Baker-Venkataraman重排得到β-丙二酮,然后在SOCl2/dioxane回流状态下生成3-氯-3',4',7,8-四甲氧基黄酮产率达到 77% ,再经BBr3/DCM常温下进行脱甲氧基得到目标产物3-氯-3',4',7,8-四羟基黄酮产率为 42% ,该化合物对端粒酶的IC50值是0.8 μM。他们同时以 β-丙二酮为中间体,在(PhSO2)2NF/DCM作用下在β-丙二酮的亚甲基上引入氟,然后在H2SO4/CH3COOH条件下关环,再经过BBr3/DCM脱甲氧基得到3-氟-3',4',7,8-四羟基黄酮产率达到71%,该化合物对端粒酶有良好的抑制活性,IC50值达到0.6 μM,在3位引入氟对端粒酶活性比引入氯活性提高0.2 μM。
Dyrager[15]等人以邻羟基苯乙酮与相应的酰氯反应生成酯,通过微波加热方法对Baker-Venkataraman重排进行改良,缩短反应时间,获得良好的产率,然后在酸性条件下经过微波加热对β-丙二酮关环得到相应的黄酮,在LDA/I2/THF条件下经过微波加热短时间成功地在黄酮母核3位引入I原子,产率达到80% ~88%。以同样的方法,在 NBS/DMF作用下发生亲核取代反应得到3-溴黄酮,产率高达94%。该方法比以上几种在黄酮母核3位引入卤原子的方法更好,不仅缩短反应时间,也获得良好的产率。合成路线见Scheme 3

2 A环不同位置卤代黄酮的合成
Righi[16]等人以 5,7-二甲氧基黄酮为原料,用TBATB/CHCl3体系,可选择性在黄酮6位引入溴,反应条件比较温和,产率高达97%,反应时间才用1.5 h。用NBS/DMF体系,则选择性的在8位上溴,该反应温度比用TBATB/CHCl3体系选择性在黄酮6位上溴的反应温度低,反应时间多1 h。也获得良好的产率80%。在黄酮的6位被溴取代后,可以通过溴的这个中间体很好的合成5,6,7-三羟基黄酮,合成路线见Scheme 4。

Zembower[17]等人以 5,6,4'-三甲氧基黄酮为原料,经过3~4步合成了两种碘代黄酮。控制三溴化硼的用量,使其只脱下5位上的甲氧基,然后在TlOAc作用下,加入适量的I2,可以选择性在黄酮6位上引入碘,产率达到73%,再经过硫酸二甲酯再5位上保护基。以这个碘代黄酮为中间体,可以合成一系列黄酮衍生物,特别是通过偶联反应能选择性再6位上合成双黄酮。其合成路线见Scheme 5。

Lee[18]等人以 5,6,7-三羟基黄酮为原料通过NBS/THF/H2SO4体系直接在8位上溴原子,他还通过乙酰基先保护羟基然后在8位上上溴的同时脱掉5位上的乙酰基,主要是5位的羟基跟4位的羰基形成氢键。然后测定KB细胞的活性来比较四个化合物的生物活性,化合物24对KB细胞的IC50值为14.1±1.4 μM,而化合物23对KB细胞的IC50值为62.3±3.7 μM,化合物26对KB细胞的IC50值为12.4±2.7 μM左右,化合物25对KB细胞的IC50值为14.5±2.1 μM左右。实验数据表明,在黄酮的8位引入溴可提高对KB细胞的活性。它们的合成路线见Scheme 6。

Gurung[19]等人以 5,7-二羟基黄酮为原料经硫酸二甲酯保护酚羟基生成5,7-二甲氧基黄酮,再通过不同的卤试剂 NaCl/OxoneTM、NBS/chloroform、I2/AcOH、70%HNO3,可选择在5,7-二甲氧基黄酮 8 位分别引入氯、溴、碘原子。最后,在AlCl3/CH3CN条件下选择性在5位上脱去甲基,得到相对应的3种卤代黄酮,在BBr3/chloroform体系中同时脱下两个保护基,分别得到 8-氯-5,7-二羟基黄酮、8-溴-5,7-二羟基黄酮、8-碘-5,7-二羟基黄酮。这九种卤代黄酮化合物对前列腺素E2的抑制作用比5,7-二羟基黄酮及5,7,8-三羟基黄酮对前列腺素E2的抑制作用好。实验表明,在5,7-二羟基黄酮8位引入拉电子基团是一个活性基团,随着氯、溴、碘拉电子能力减弱对PGE2活性逐渐减少。合成路线见Scheme 7。

Lewin[20]等人通过半合成的方法,以橙皮苷(hesperidin)为原料在TFA和NBS体系中合成4'-甲氧基-3',3,5,7-四羟基-6,8-二溴代黄酮,再以它为中间体合成一系列的黄酮衍生物,合成路线见Scheme 8。

3 黄酮B环不同位置卤代黄酮的合成
Liu[21]等人通过对氟苯乙酰乙酸乙酯为原料经过3步反应得到最终产物,化合物3-4、3-5对anti PTrkB和anti TrkB酶具有良好的活性。合成路线见Scheme 9。
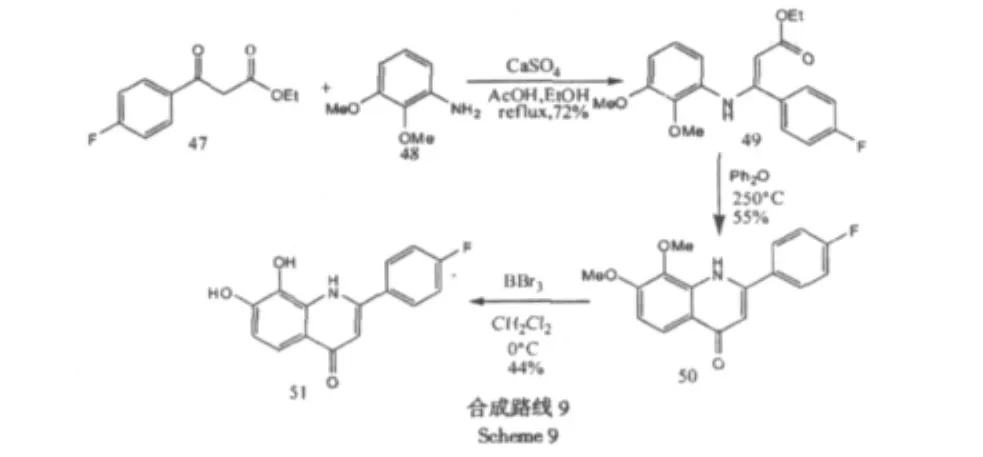
他们同时也用经典合成黄酮的方法,以2-羟基-3,4-二甲氧基苯乙酮与对氟苯甲酰氯在碱性条件下发生酰基化成脂,然后在碱性条件发生Baker-Venkataraman重排得到β-丙二酮,最后在酸性条件下关环得到4'-氟-7,8-二羟基黄酮,该化合物对anti TrkB酶也具有良好的抑制作用。
Alvim[22]等人在碱性条件下发生羟醛缩合获得50%产率的查尔酮,然后在I2催化及DMSO作用下关环得到2'氯-5'-甲氧基-7-氟黄酮,以同样的方法合成6-溴-2',4'-二甲氧基黄酮。实验表明,两个化合物对Cathepsin V都表现良好的抑制作用,6-溴-2',4'-二甲氧基黄酮对Cathepsin V的IC50值为1.2±0.1 μM。合成路线见Scheme 10。

4 结论
氟试剂易分解,氟代黄酮一般都是用带有氟的芳环通过羟醛缩合成查尔酮,在催化剂作用下关环得到相应的氟代黄酮。要么先酰基化反应成脂,在碱性条件下发生Baker-Venkataraman重排得到β-丙二酮,最后在酸性条件下关环得到相应的氟代黄酮。氯、溴、碘代黄酮的合成一般通过氯、溴、碘试剂选择性在黄酮不同位置上相应的卤原子,在黄酮C环3位引入氟原子的方法:①以2-氯-2-氟-1.3-二芳基β-1.3丙-二酮在CH3CN及光照下合成两种3-氟代黄酮;②在(PhSO2)2NF/DCM作用下在β-丙二酮的亚甲基上引入氟,然后在H2SO4/CH3COOH条件下关环得到相应的3-氟代黄酮。在黄酮C环3位引入氯原子的方法:①NCS/CH2Cl2/Py作用下,常温反应48 h直接在黄酮3位引入氯原子得到3-氯代黄酮产率达95%;②以 β-1.3丙-二酮在SOCl2/dioxane回流状态下生成 3-氯-3',4',7,8-四甲氧基黄酮产率达到77%。在黄酮C环3位引入溴原子的方法:①NCS/CH2Cl2/Py作用中在常温下反应5.25 h直接在黄酮3位引入溴原子产率高达95%;②NBS/DMF体系中在80℃下微波加热反应1 h,获得产率为94%的3-溴代黄酮,方法②比方法①更好,缩短反应时间。在黄酮C环3位引入碘原子的方法:①LDA/I2/THF中在零下78℃下15 min微波加热反应15 min生成3-碘代黄酮,产率为80% ~88%。在黄酮A环8位引入氯原子的方法:NaCl/OxoneTM作用下反应2 h获得90%产率的8-氯代黄酮。在黄酮A环8位引入溴原子的方法:①NBS/DMF体系中,0℃下反应2.5 h可选择在5,7-二甲氧基黄酮8位引入溴原子,产率为80%;②在NBS/THF/H2SO4体系中常温反应 12 h,才得到产率为 57% 的 8-溴-5,6,7-三羟基黄酮;③在NBS/CHCl3体系中回流条件下反应5 h,获得产率为91%。可见,方法③优越于方法①,方法①优越于方法②5,7-二甲氧基黄酮8位引入溴原子是在TBAB/CHCl3体系作用下反应0.25 h可选择性在5,7-二甲氧基黄酮6位引入溴原子。在黄酮A环6、8位引入碘原子的方法:①在TIOAc/I2体系中可选择性在黄酮6位引入碘原子;②在AcOH/I2/70%HNO3作用下可选择性在黄酮6位引入碘原子。为黄酮母核引入卤素的方法提供参考。
在黄酮的母核引入卤素原子大多数情况下都是增加它们的生物活性,有时候活性变化不大。这取决于它们的作用机理,该类化合物的理化性质,靶标和化合物的相互作用。卤代黄酮类化合物可发生亲核取代、偶联等有机反应,作为黄酮类化合物结构修饰的中间体,期待为黄酮类化合物研究开发出结构新颖的先导化合物。
1 Liu AL,et al.Structure-activity relationship of flavonoids as influenza virus neuraminidase inhibitors and their in vitro anti-viral activities.Bioorg Med Chem,2008,16:7141-7147.
2 Cárdenas M,et al.Antitumor activity of some natural flavonoids and synthetic derivatives on various human and murine cancer cell lines.Bioorg Med Chem,2006,14:2966-2971.
3 EI-Subbagh HI,et al.Synthesis and biological evaluation of certain α,β-unsaturated ketones and their corresponding fused pyridines as antiviral and cytotoxic agents.J Med Chem,2000,43:2915-2921.
4 Shukla S,et al.Blockade of β-catenin in signaling by plant flavonoid apigenin suppresses prostate carcinogenesis in TRAMP mice.Cancer Res,2007,67:6925-6935.
5 Cai YZ,et al.Structure-radical scavenging activity relationships of phenolic compounds from traditional Chinese medicinal plants.Life Sci,2006,78:2872-2888.
6 Sadik CD,et al.Inhibition of 15-lipoxygenases by flavonoids:structure-activity relations and mode of action.Biochem Pharmacol,2003,65:773-781.
7 Brunskole M,et al.Trihydroxynaphthalene reductase of Curvularia lunata-a target for flavonoid action.Chem Biol Interact,2009,178:259-267.
8 Blasubramanian R,et al.Cytotoxic activity of flavone glycoside from the stem of Indigofera aspalathoides Vahl.J Nat.Med,2007,61:80-83.
9 Wang ZY,et al.Comparison of supercritical fluid chromatography and liquid chromatography for the separation of urinary metabolites of nobiletin with chiral and non-chiral stationary phases.Biomedical chromatography,2006,20:1206-1215.
10 Dong XW,et al.Synthesis,biological evaluation and quantitative structure-activities relationship of flavonoids as vasorelaxant agents.Bioorg Med Chem,2009,17:716-726.
11 Woodman OL,et al.Vasorelaxant and Antioxidant Activity of Flavonols and Flavones:Structure-Activity Relationships.J Cardiovasc Pharmacol,2005,46:302-309.
12 Košmrlj B,Šket B.Photocyclization of 2-chloro-Substituted 1,3-diarylpropan-1,3-diones to flavones.J Org Lett,2007,9:3993-3996.
13 Quintin J,et al.Semisynthesis and antiproliferative evaluation of a series of 3'-aminoflavone.Bioorg Med Chem Lett,2009,19:3502-3506.
14 Menichincheri M,et al.Catecholic flavonoids acting as telomerase inhibitors.J Med Chem,2004,47,6466-6475.
15 Dyrager C,et al.Design,synthesis,and biological evaluation of chromone-based p38 MAP kinase inhibitors.J Med Chem,2011,54:7427-7431.
16 Righi G,et al.Convergentsynthesis of mosloflavone,negletein and baicalein from crysin.Tetrahedron,2010,66:1294-1298.
17 Zembower DE,Zhang HP.Total synthesis of robustaflavone,a potential anti-hepatitis B agent.J Org Chem,1998,63:9300-9305.
18 Lee Y,et al.Increased anti-p-glycoprotein activity of baicalein by alkylation on the A ring.J Med Chem,2004,47:5555-5566.
19 Gurung SK,et al.Inhibition of prostaglandin E2productionby synthetic wogonin analogs.J Arch Pharm,2009,32:1503-1508.
20 Lewin L,et al.Semisynthesis of natural flavones inhibiting tubulin polymerization,from hesperidin.J Nat Prod,2010,73:702-706.
21 Liu X,et al.A synthetic7,8-dihydroxyflavone derivative promotes neurogenesis and exhibits potent antidepressant effect.J Med Chem,2010,53:8274-8286.
22 Alvim J,et al.Solution phase synthesis of a combinatorial library of chalcones and flavones as potent cathepsin V inhibitors.J comb Chem,2010,12:687-695.

