春夏季闽江口和兴化湾虾类数量特征
徐兆礼,孙 岳
(1.中国水产科学研究院东海水产研究所农业部海洋与河口渔业重点开放实验室,上海 200090;2.国家海洋局海洋咨询中心,北京 100860)
虾类属于甲壳动物十足目(Decapoda),是海洋渔业资源重要的组成部分,以有机碎屑或浮游动物等为食,本身也作为鱼类饵料[1],因而是海洋食物链的重要部分。
对虾类的研究,早期主要在分类方面[2]。我国对虾类资源的调查,则多在50m等深线以外的海域,例如,对浙江大陆架海域虾类资源量进行的评估[3],对东海陆架虾类资源变动特征的分析[4-5]等。实际上,河口和海湾才是经济虾类生活的主要场所[6-7]。虽然也开展了一些研究工作,例如徐兆礼[8]对瓯江口虾类资源和数量变化的研究;黄梓荣等[9]对珠江口甲壳动物研究等,但对我国以往其它河口和海湾虾类资源数量变化的研究较少。
国外对沿海虾类数量变化的报道较为丰富,Boddeke[10]研究了荷兰沿海褐虾(Crangon crangon)种群动态的变化,Susan[11]研究了旧金山沿海Crangon franciscorum分布和数量的季节变化和年间变化,Hoese[12]研究了墨西哥湾沿岸浅滩虾类的幼体数量。
由于环境不同,海湾和河口渔场虾类资源数量变化有着各自不同的特征,需要采用不同的资源管理措施[13]。本文选取我国沿海中部亚热带的兴化湾和闽江口作为研究水域,比较河口和海湾虾类资源分布特征和数量变化。其研究,对于虾类资源形成的原因,对于渔场开发和渔汛的确定等都具有重要的科学价值。
1 材料与方法
1.1 调查地点和采样方法
2008年4月14—16日、9月3—6日在兴化湾水域布设16个站(图1),于2008年4月17—19日、9月7—9日在闽江口水域布设12个站位(图1)进行虾类资源调查,在闽江口平行于岸线设置3个断面,在兴化湾,由于内湾水浅依据水深可允许与否酌情设站,在外湾和湾口均匀布站,由于这两处出水域水下地形复杂,具体调查站位设置,还要依据拖网作业允许与否调整。每个站位拖网次1。调查采用单拖网(7.5 m×3.5 m),网目范围2.5—12 cm,每网拖曳约0.5 h,平均拖速4.63km/h(即2.5 节),按《海洋水产资源调查手册》[14]进行。对渔获物中虾类进行分物种的重量和尾数统计。
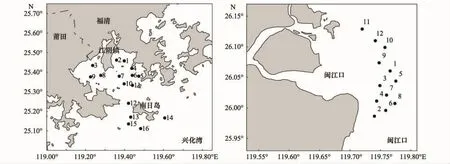
图1 调查站位分布Fig.1 Sampling stations
1.2 数据处理方法
虾类资源密度的估算采用扫海面积法[14]。在对拖网渔获统计基础上,计算各站位生物量和尾数密度,公式如下:

式中,ρi为第i站的虾类资源密度(重量:kg/km2;尾数:103尾/km2);Ci为第i站的每小时拖网渔获物中虾类数量(重量:kg/h;尾数:尾/h);ai为第i站的网具每小时扫海面积(km2/h)(网口水平扩张宽度(km)(本网具为0.0075 km)×拖曳距离(km)),拖曳距离为拖网速度(km/h)和实际拖网时间(h)的乘积;q为网具捕获率(可捕系数 =1-逃逸率),依据本拖网网具,逃逸率取0.5。
用Pinkas等[15]的相对重要性指数IRI来研究虾类优势种的优势度,计算公式如下:

式中,N%为某一物种尾数占总尾数的百分比;W%为该物种重量占总重量的百分比;F%为某一物种出现的站数占调查总站数的百分比。为了分析群落优势种的结构特征,本文取相对重要性指数前4为的种作为优势种进行分析。另外,在兴化湾,由于9月出现高密度中国毛虾,尽管重要性指数有限,为保留这一重要信息,仍将其例如优势种并且加以讨论虾类数量变化的动力学,主要分析优势种对虾类总数量变化的影响。在计算中,以虾类总重量或总尾数为因变量,各优势种重量或尾数为自变量分析,具体计算方法可以参考Christensen[16]。
2 结果
2.1 兴化湾和闽江口水域水温和盐度的比较
兴化湾较闽江口水域的水温稍高,兴化湾和闽江口的环境主要是盐度的差别,闽江口是咸淡水的盐度环境,而兴化湾基本是海洋的盐度环境,特别在9月丰水期其间,这两个不同环境盐度差别更加明显。

表1 兴化湾和闽江口海域水温和盐度的比较Table 1 Comparison of water temperature and salinity between Xinghua bay and Minjiang estuary
2.2 主要优势种相对重要性指数
虾类相对重要性前4位优势种见表2,虽然9月兴化湾中国毛虾IRI值较低,然而该种是尾数密度最高的种类,因而也列入优势种。在闽江口和兴化湾,哈氏仿对虾同属4月最重要的虾类,其生物量均为最高值。但是哈氏仿对虾在两处海域的重要性有所不同,兴化湾哈氏仿对虾占总重量的89.43%,总尾数的62.62%,相对重要性指数IRI明显高于其它物种,因而是绝对优势种。闽江口的主要优势种还有中国毛虾和脊尾白虾。其中,中国毛虾占总尾数的50.66%,脊尾白虾占总重量的27.84%,因而分散了当地水域哈氏仿对虾重要性。因此,闽江口哈氏仿对虾重要性值明显低于兴化湾。
9月情况相仿。哈氏仿对虾,周氏新对虾和中国毛虾是是闽江口海域最重要的虾类物种,其IRI值几乎相同。哈氏仿对虾,周氏新对虾具有较高的出现率和重量百分比,而中国毛虾占总尾数的63.01%,都是重要的优势种。而在兴化湾,哈氏仿对虾生物量都远远高于其它虾类,每个站位均有出现,相对重要性指数IRI远高于其它物种,是9月兴化湾最重要的虾类优势种。
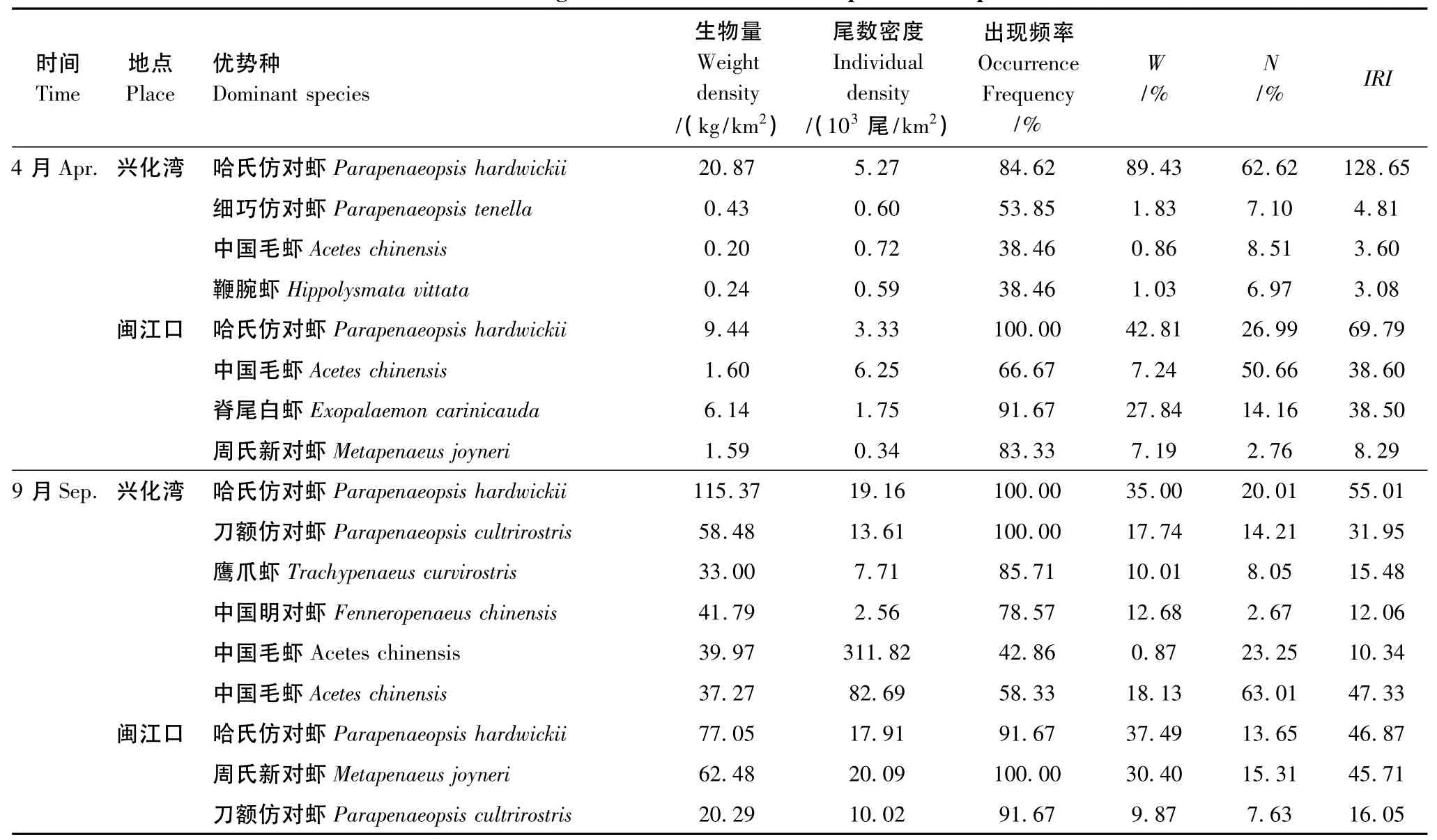
表2 虾类主要优势种生态特征Table 2 Ecological character of main shrimp dominant species
2.3 优势种数量对虾类总数量的贡献
在闽江口,4月虾类总生物量与所有的优势种相关,贡献率较大的有哈氏仿对虾、脊尾白虾和周氏新对虾,β值分别是0.65、0.51和0.27。而同期总尾数密度也与所有的优势种都相关,其中贡献率最大的是中国毛虾(β值为0.87)。9月,对虾类总生物量变化贡献较大的是周氏新对虾和刀额仿对虾,β值为0.69和0.52,总尾数密度与所有的优势种密切相关,但中国毛虾有较高的贡献率,β值为0.82,远远超过其他优势种(表3)。
在兴化湾,4月对虾类总生物量贡献几乎全部来自哈氏仿对虾,β值为0.96,其它优势种的β值较小。而同期总尾数密度与其它优势种都相关,其中贡献率最大的仍然是哈氏仿对虾,β值为0.86。其次是中国毛虾和鞭腕虾(Hippolysmata vittata),β为 0.27和 0.23。9月虾类总生物量变化受鹰爪虾(Trachypenaeus curvirostris)影响最大,β为0.55,其次是哈氏仿对虾,β值为0.40。而总尾数密度与所有的优势种都有十分密切的关系,中国毛虾贡献率最高,β值为0.80。其次是刀额仿对虾和鹰爪虾,β值分别为0.58和0.45(表3)。
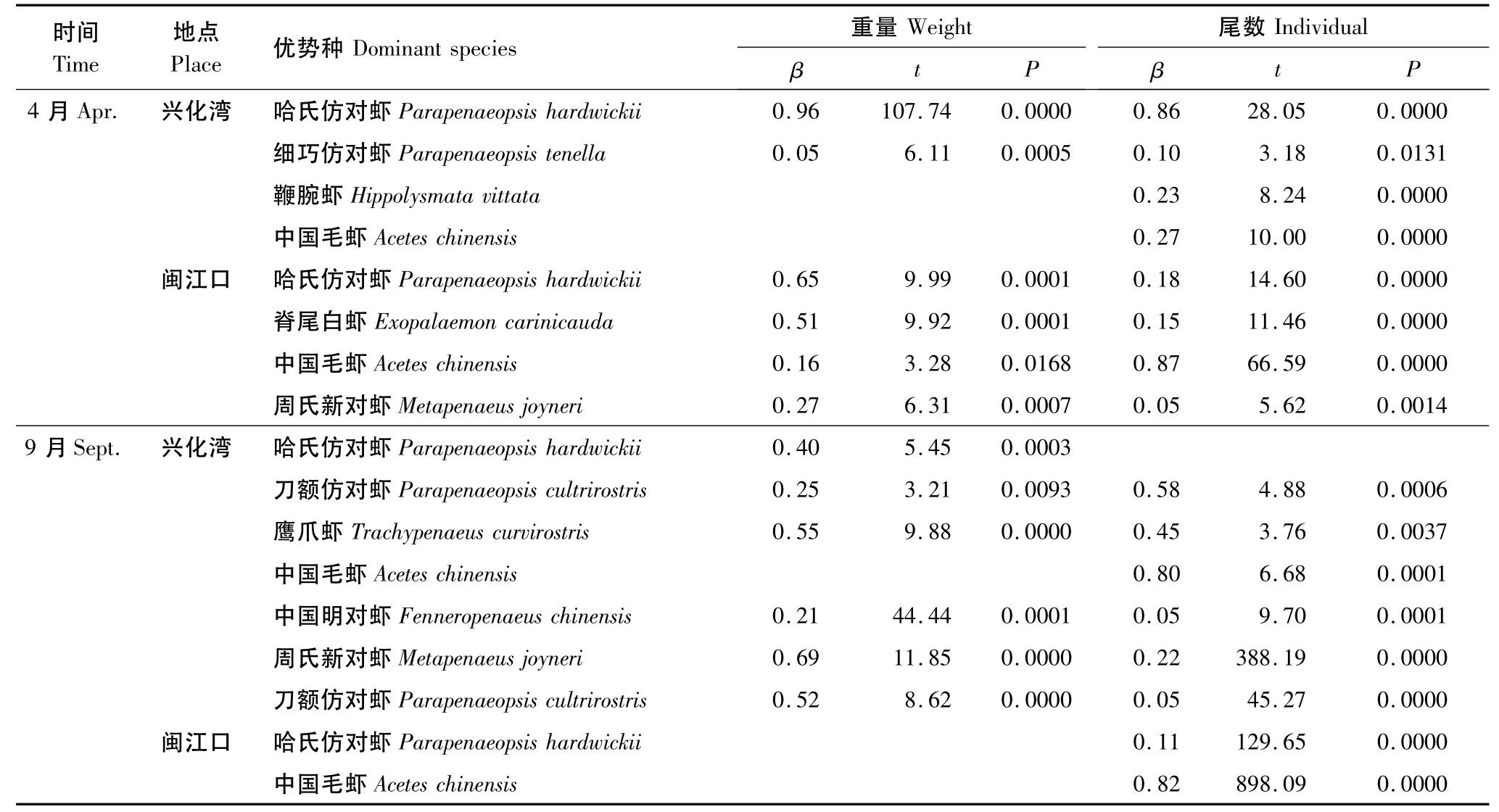
表3 虾类优势种密度对总密度的贡献Table 3 Contribution of main dominant species to total weight and individual of shrimps
2.4 闽江口外海域虾类密度的分布特征
在4月,闽江口虾类生物量较高水域位于调查区南部的6号站 (26.00°N,119.76°E)。最高为39.21kg/km2(图2)。主要品种是哈氏仿对虾(Parapenaeopsis hardwickii)。此外,南部海域的4号站位,中部的5号和北部的11号站位也有较高的生物量(图2),分别为34.85,27.96、25.82kg/km2。4号和5号站均主要由哈氏仿对虾构成,而11号站主要由脊尾白虾(Exopalaemon carinicauda)构成。
4月,闽江口虾类尾数密度较高水域在北部的9号、10号和11号站位(图2),虾类尾数密度分别为 26.23×103、21.94×103、25.54×103尾/km2。主要是由中国毛虾(Acetes chinensis)组成。此外在北部的 12 号和南部的4号站位也有尾数密度较高水域,密度分别为15.39×103尾/km2和15.71×103尾/km2(图2),主要是由哈氏仿对虾和中国毛虾组成。
9月闽江口虾类生物量较高水域位于调查区南部的2号和8号站位,分别为659.55kg/km2和473.45kg/km2。主要种类为周氏新对虾(Metapenaeus joyneri)和中国毛虾组成。
9 月闽江口虾类尾数密度较高水域也是南部的 1、2 和8 号站位,分别是 432.69×103、219.35×103、203.04×103尾/km2,主要种类也是中国毛虾和周氏新对虾。
2.5 兴化湾海域虾类密度的分布特征
4月,兴化湾虾生物量最高值出现在南日岛以南的15号站位(图2),为105.12 kg/km2。主要是规格较大的哈氏仿对虾构成。其次是中部近湾口的6号站位,密度分别为63.36kg/km2。也是由哈氏仿对虾组成。兴化湾南日岛以南的15号站位和中部近湾口的4号和6号站位是虾类尾数密度最高的水域 (图2),分别为21.06×103、17.28×103、17.82×103尾/km2,因为出现了大量的哈氏仿对虾。
9月,兴化湾虾类生物量较高水域主要是位于中部近湾口的6号和5号站,及湾口的11号站位,分别为970.42、716.44、680.98kg/km2,其中,5号和11号站位主要由哈氏仿对虾,6号和11号站位主要是刀额仿对虾(Parapenaeopsis cultrirostris)。尾数密度较高的则是南日岛北部的12号和湾口的11号和5号站位,分别为239.30×103、175.67×103、169.70×103尾/km2。刀额仿对虾、哈氏仿对虾和中国毛虾是其中最要的种类。

图2 春秋季闽江口和兴化湾虾类生物量分布Fig.2 Distribution of shrimp in weight in the Minjiang estuary and Xinghua bay during Spring an Autumn
2.6 闽江口和兴化湾虾类密度的比较
4月和9月兴化湾虾类总生物量密度分别为23.33kg/km2和329.60kg/km2,总尾数密度分别为8.42×103尾/km2和 95.79×103尾/km2。
4月和9月闽江口虾类总生物量密度分别为22.05kg/km2和205.54kg/km2,总尾数密度分别为12.34×103尾/km2和 131.25×103尾/km2。
3 讨论
3.1 闽江口和兴化湾虾类资源数量的比较
比较闽江口和兴化湾虾类资源密度,无论是4月还是9月,闽江口虾类总生物量(22.05kg/km2和205.54kg/km2)均低于兴化湾虾类总生物量(23.33kg/km2和329.60kg/km2)。其中,4月总生物量值相近,而9月差别明显。但是尾数密度相反,4月和9月闽江口虾类总尾数密度(12.34×103尾/km2和131.25×103尾/km2)都明显高于兴化湾虾类的总尾数密度(8.42×103尾/km2和95.79×103尾/km2)。这一现象的产生,与闽江口和兴化湾虾类各自资源种类生物特征和生态习性有一定的关系。
4月,兴化湾的虾类种类,就重量百分比而言,以规格较大的哈氏仿对虾和刀额仿对虾为主(表1),其中哈氏仿对虾的数量接近总重量的90%。来自水深大于50m的东海陆架调查结果[17-18],哈氏仿对虾是那里重要的虾类,在东海127°E以西有大量的分布。徐兆礼[8]通过瓯江口虾类组成研究,认为哈氏仿对虾还是东海沿海最主要的虾类品种,显示出该种对东海不同环境的广泛的适应。此外,本文结果显示,哈氏仿对虾是兴化湾虾类最主要的种类(表2),其中4月,哈氏仿对虾占了虾类总重量的89.43%,相对重要性指数为128.65。远远高于其他优势种。9月哈氏仿对虾和刀额仿对虾合计占了虾类总重量的52.74%,相对重要性指数合计为86.96。均为兴化湾虾类资源的主体。而闽江口哈氏仿对虾虽然也是主要优势种,但重要性远远低于其在兴化湾的重要性。闽江口哈氏仿对虾仅占4月虾类总重量的42.85%,9月的37.49%,这是兴化湾虾类总生物量高于闽江口水域密度的重要原因。

图3 春秋季闽江口和兴化湾虾类尾数密度分布(103尾/km2)Fig.3 Distribution of shrimp in number in the Minjiang estuary and Xinghua bay(103 ind./km2)during Spring an Autumn
尾数密度相反,闽江口海域虾类高于兴化湾海域虾类。在闽江口优势种多为小型虾类,其中最为典型的是俗称“虾米”的中国毛虾(表2),该种4月占了虾类总尾数的50.66%,9月占了63.01%。这是闽江口虾类总尾数密度高于兴化湾密度的原因。
两个不同水体虾类优势种特征出现差异,是因为闽江口属于河口生态系统,具有较低的盐度,而兴化湾属于海湾生态系统,海水盐度高于闽江口海域。这两个海洋生态系统差异,主要是海水盐度上的差异,不同虾类的盐度适应,导致不同种类栖息与繁殖,导致了虾类优势种种类和数量的差异。
3.2 闽江口虾类数量分布特征和环境背景分析
在闽江口海域,不同季节,虾类数量的差异十分显著。4月重量资源密度仅为9月的10%略多一点,而尾数密度还不到9月的10%,无论是总重量资源密度,还是总尾数密度,9月数量远远高于4月。
在空间分布上,4月,虾类的生物量最大的分别是南部6、4、5号站位,这3个站位除了哈氏仿对虾较多以外,还有一定数量的日本囊对虾(Marsupenaeus japonicus)。余下的北部11号站位生物量较高,但主要种类是脊尾白虾。4月,闽江口外海域虾类尾数密度呈现出北部高于南部的趋势,这是因为北部的9—12号4个站位出现了大量个体规格较小的中国毛虾所致。到了9月,生物量和尾数密度高值均出现在南部,这是因为南部出现了数量很多的哈氏仿对虾,中国毛虾和刀额仿对虾缘故。
闽江径流量充沛,特别是9月,因而表现为河口咸淡水的环境特征(表1)。在近河口段,闽江径流分为南北两支,受地形影响,闽江径流主要通过闽江口海域中部的外石川水道外泄,径流愈大,外泄余流愈大[19]。且外泄余流在柯氏力的作用下主要为东南流向,丰富的闽江径流带来大量的营养物质[20]。因此丰水期的9月,虾类资源主要集中在南部水域,这是9月虾类的生物量和为数密度高于北部的主要原因。4月是平水期,受潮水顶托,闽江径流外泄的余流较弱,地形差异其主要作用。从地形地貌上讲,闽江口海域南部多为浅滩[19],适合于规格较大,底层栖息性的虾类繁殖和生活,例如哈氏仿对虾和刀额仿对虾。因此4月闽江口南部海域是大规格底层性虾类栖息场所。这就是4月南部海域虾类生物量高于北部的海域的主要环境原因。由于闽江口北部水域浅滩发育程度较低[19],适于偏浮游性的中国毛虾生长。这是4月虾类北部尾量密度高于南部尾量密度的原因。由此可以认为,闽江口南部渔场是当地主要的渔场,9月份是主要的渔汛。
3.3 兴化湾虾类数量分布特征和环境背景分析
与闽江口类似,兴化湾虾类9月生物量(329.60 kg/km2)高于4月(23.33kg/km2)。9月尾数密度(95.79×103尾/km2)也高于4月(8.42×103尾/km2)。兴化湾是一个浅水型的海湾,湾内多浅滩和湿地,湾口多岛屿和礁石[21]。4月,兴化湾的虾类以哈氏仿对虾占绝对优势,该种是一个暖水种[18]。在水温较低的4月,该种主要分布在南日群岛以南的深水海域,例如15号站生物量高达102.48kg/km2,远远高于同一季节其它站位。到了9月,湾口由于不同水团交汇[21]。成为许多虾类共同栖息的场所。例如,在湾口5号和6号站位,除了有较多的哈氏仿对虾,还有刀额仿对虾、中国明对虾(Fenneropenaeus chinensis)、鹰爪虾、大管鞭虾(Solenocera crassicornis)和须赤虾(Metapenaeopsis barbata)。由此推断,兴化湾湾口是虾类的主要产卵场和索饵场,湾外则是虾类越冬场。
3.4 虾类优势种数量特征的比较
哈氏仿对虾是闽江口和兴化湾经济虾类最主要的优势种。哈氏仿对虾在兴化湾4月IRI值为128.65,远远高于其他种类。即便在闽江口9月,该种仍然是第2位的优势种,IRI值与第1位的中国毛虾非常接近。无论在4月还是9月,该种在闽江口和兴化湾的生物量都是最大,且在大多数站位出现,具有较高的经济价值,因而是闽江口和兴化湾的最重要的虾类资源品种。
不同盐度环境、种类对不同盐度环境的适应是形成闽江口和兴化湾优势种不同格局的主要原因。哈氏仿对虾在兴化湾重要性非常突出,重要性指数在4月和9月都远远高于其他优势种。与此不同,闽江口有两个重要优势种,除了哈氏仿对虾,另一个就是中国毛虾,尾数密度占总尾数密度一半以上。4月,重要种类还有脊尾白虾(表2)。中国毛虾和脊尾白虾都是半咸水种,能够适应闽江口海域较低的盐度环境。在9月,中国毛虾在闽江口海域的重要性指数甚至高于哈氏仿对虾。
对当地不同环境的广泛适应能力,为是否可以成为当地虾类主要资源品种的一个必要条件。方差贡献分析表明,哈氏仿对虾、中国毛虾在不同的季节对闽江口虾类总生物量和总尾数密度提高有较大的贡献(表3),显示出这两个种对不同温盐环境的广泛适应,因而能够成为闽江口和兴化湾最重要的经济虾类。脊尾白虾只在4月是重要的优势种,对4月对虾类生物量的贡献较大(表3)。周氏新对虾在闽江口4月的重要性并不突出,生物量仅为1.59kg/km2,到了9月迅速增长到62.48kg/km2(表2),是4月到9月数量增长最明显的品种。仅在9月,对虾类生物量贡献较大,显示出这两个种类环境适应的局限性。
3.5 虾类资源多样性特征的比较
随着从春季到夏季的季节变化,虾类资源品种呈现多样化的趋势。4月,哈氏仿对虾是兴化湾唯一重要的经济虾类,闽江口海域哈氏仿对虾资源量也超过其它优势种资源量的总和。到了9月,无论是兴化湾还是闽江口,哈氏仿对虾资源重量均不超过其它优势种资源量。
闽江口虾类资源品种呈现更加多样化的特征。4月,除了哈氏仿对虾,中国毛虾和脊尾白虾也是闽江口的优势种,到了9月,周氏新对虾在生物量上接近哈氏仿对虾资源重量,中国毛虾在尾数密度远远超过近哈氏仿对虾,形成闽江口虾类资源品种多样化的格局。这样的特征形成与闽江口海域不同盐度水团交汇(表1),水文环境多样化有一定的关系。
[1]Minello T J,Zimmerman R J.Fish predation on juvenile brown shrimp,Penaeus aztecus Ives:The effect of simulated Spartina structure on predation rates.Journal of Experimental Marine Biology and Ecology,1983,72(3):211-231.
[2]Dong L M,Hu Y Y,Wang Y B.The report on swim shrimp at coastal area of Zhejiang provinceⅢ.Chinese Journal of Zoology,1986,21(5):4-6.
[3]Yu C G,Song H T,Ding Y P,Xu Y J.A primary estimation on shrimp resource of Zhejiang coastal area.Journal of Zhejiang Ocean University,1994,13(3):149-155.
[4]Ding Y P,Song H T,Yu C G,Xu Y J.A Study on Shrimp Species and its Regional Composition and Regional Character of Zhejiang.Journal of Zhejiang Ocean University,2003,22(2):132-136.
[5]Lv Q H,Song H T,Chris B,Temporal and spatial distributions of dominant shrimp stocks and their relationship with the hydrological environment in the East China Sea.Chinese Journal of oceanology and limnology,2007,25(4):386-397.
[6]Parker JC.Distnbution of juvenile brown shnmp(Penaeus aztecus Ives)In Galveston Bay,Texas,as related to certain hydrographic features and sahnity.Contr.mar.SCI,Univ Tex,1970,15:1-12.
[7]Young P C,Carpenter S M.Recruitment of postlarval penaeid prawns to nursery areas in Moreton Bay,Queensland.Aust.J.mar.Freshwat.Res.1977,28:745-774.
[8]Xu Z L,Shen A L,LI X Z,Distribution of Hoplocarida and Decapoda shrimp in the Oujiang river estuary.Journal of Fisheries Science of China,2009,16(1):104-112.
[9]Huang Z R,Sun D R,Chen Z Z,Zhang H H,Wang X H,Wang Y Z,Fang H D,Dong Y H.Faunal character istics and distr ibution pa ttern of crustaceans in the vicinity of Pearl River estuary.Chinese Journal of Applied Ecology,2009,20(10):2535-2544.
[10]Boddeke R.Changes in the brown shrimp(Crangon crangon L.)population off the Dutch coast in relation to fisheries and phosphate discharge.ICESJournal of Marine Science,1996,53(6):995-1002.
[11]Susan E H.Seasonal and interannual variation in distribution and population abundance of the shrimp Crangon franciscorum in San Francisco.Hydrobiologia,1985,129(1):199-210.
[12]Hoese,H D.Juvenile penaeid shrimp on the shallow Gulf of Mexico.Ecology,1960,41:592-593.
[13]Kutkuhn JH.The role of estuaries in the development and perturbation of commercial shrimp resources.Spec.Publ.Am.Fish.Soc,1966,3:16-36.
[14]Yellow Sea Fisheries Research Institute.Investigation handbook of marine fisheries resource.Shanghai:Shanghai Science and Technology Press,1981:5-45.
[15]Pinkas L M.Oliphant Sand Iverson ILK,Food habits of albacore,bluefin tunaand bonito in Californian waters.Calif.Fish Game,1971,152:1-105.
[16]Christensen R.Analysis of variance,design and regression:applied statistical methods,New York:Chapman and Hall,1996:75-98.
[17]Li Y M,Ni H L,Zhu JQ,Song H T,Yu CG.Population dynamics and estimation of maximum sustaining yield for Parapenaeopsis hardwickii in the northern area of East China Sea.Journal of Fisheries of China,2000,24(4):364-369.
[18]Song H T,Ding TM.Distribution and fishery of different ecological groups of shrimp in the waters of north East China Sea.Journal of oceanography in Taiwan Strait,1995,14(1):67-72.
[19]Pan D A,Shen H T.The mixing of salt and fresh water in the Mnjiang River estuary.Oceanogia et Liminogia Sinica.1993,24(6):599-608.
[20]Cao Y F.Evaluation on seawater quality in south sea area of Minjiang Estuary in Fujian Province from 2002 to 2006.Marine Environmental Science,2009,28(S1):40-42.
[21]Li M G.Hydrographic and Sediment Analyses of Xinghua Bay.Journal of Waterway and Harbou,2001,22(4):155-159.
参考文献:
[2]董聿茂,胡萸英,汪宝永.浙江沿海游泳虾类报告Ⅲ.动物学杂志,1986,21(5):4-6.
[3]俞存根,宋海棠,丁跃平,许源剑.浙江近海虾类资源量的初步评估.浙江海洋学院学报,1994,13(3):149-155.
[4]丁跃平,宋海棠,俞存根,许源剑.浙江近海游泳虾类的种类与区系组成及区系性质的研究.浙江海洋学院学报(自然科学版),2003,22(2):132-136.
[8]徐兆礼,沈盎绿,李新正.瓯江口海域夏、秋季口足目和十足目虾类分布特征.中国水产科学,2009,16(1):104-11.
[9]黄梓荣,孙典荣,陈作志,张汉华,王雪辉,王跃中,方宏达,董艳红.珠江口附近海区甲壳类动物的区系特征及其分布状况,应用生态学报,2009,20(10):2535-2544.
[14]黄海水产研究所.海洋水产资源调查手册(第二版).上海:上海科学技术出版社,1981:5-45.
[17]李明云,倪海儿,竺俊全,宋海棠,俞存根.东海北部哈氏仿对虾的种群动态及其最高持续渔获量.水产学报,2000,24(4):364-369.
[18]宋海棠,丁天明.东海北部海域虾类不同生态类群分布及其渔业.台湾海峡,1995,14(1):67-72.
[19]潘定安,沈焕庭.闽江口的盐、淡水混合.海洋与湖沼,1993,24(6):599-608.
[20]曹宇峰.2002—2006年福建省闽江口以南近岸海域水质状况评价.海洋环境科学,2009,28(S1):40-42.
[21]李孟国.兴化湾水文泥沙特征分析.水道港口,2001,22(4):155-159.

