P57KIP2和SKP2在卵巢黏液性肿瘤组织中的表达及临床意义
杨 娟 肖 兰
P57KIP2蛋白是1种细胞周期蛋白依赖性激酶抑制因子(CDKI),属CIP/KIP家族,在细胞周期中起负调控作用,能抑制细胞从 G1期到 S期的转化,进而阻止细胞的增殖,被认为具有抑癌基因活性。而SKP2既S期激酶相关蛋白2,是SCF复合物的成员之一,能特异性识别底物并与之结合,使之进入泛素化蛋白酶体降解途径。有关在肿瘤发生发展中SKP2与P57KIP2表达的相关性,目前国内外少有报道。我们采用免疫组化SP法,检测P57KIP2、SKP2在卵巢良性黏液性囊腺瘤、黏液性交界性肿瘤、黏液腺癌中的表达,比较其表达与卵巢黏液性肿瘤临床病理特征的关系,并探讨卵巢良性黏液性囊腺瘤、黏液性交界性肿瘤、黏液腺癌中P57KIP2与SKP2表达的关系。
1 材料与方法
1.1 材料
本组标本均取自孝感市中心医院2009年1月~2012年1月手术切除的标本。卵巢黏液腺癌47例,年龄42~76岁,平均年龄61岁;卵巢黏液性交界性肿瘤12例(不包括交界性肿瘤伴微小浸润),均经充分取材,未见黏液腺癌成分,年龄39~68岁,平均年龄56岁;卵巢良性黏液性囊腺瘤12例,经充分取材,确认为良性,年龄40~58岁,平均年龄45岁。卵巢黏液腺癌:高分化11例,中分化26例,低分化10例;TNM分期:Ⅰ期、Ⅱ期共36例,Ⅲ期、Ⅳ期共11例;有淋巴结转移者10例,无淋巴结转移者37例。
1.2 试剂
即用型单克隆抗体鼠抗人P57KIP2购自福州迈新公司,即用型单克隆抗体鼠抗人SKP2、通用型SP试剂盒及DAB显色试剂盒购自北京中衫金桥生物技术有限公司。
1.3 方法
采用免疫组化SP法,具体步骤按说明书进行。以PBS液代替一抗作为阴性对照。P57KIP2阳性染色位于细胞核或细胞质内,以细胞核染色为主;SKP2阳性染色位于细胞核内,均为黄色或棕黄色颗粒,本组切片均无胞核与胞质同时表达的现象。每张切片在高倍镜(×400)下随机计数1000个肿瘤细胞,根据阳性细胞数占肿瘤细胞总数的百分比计分:①阳性细胞数<5%为阴性(-);②5%~24%为弱阳性(+);③ 25%~49%为阳性(++);④≥50%为强阳性(+++) 。
1.4 统计学处理
应用SPSS11.0软件,采用四格表资料的χ2检验、行×列资料的χ2检验(校正)及Pearson相关分析进行统计。
2 结果
2.1 P57KIP2、SKP2蛋白在卵巢各黏液性肿瘤组织中的表达情况
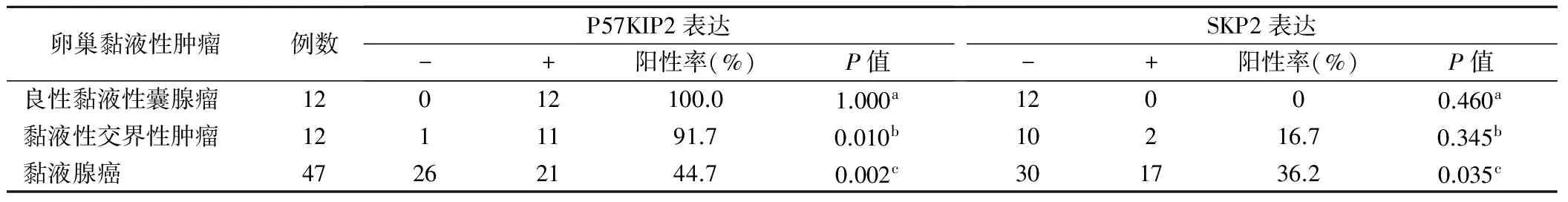
表1 P57KIP2、SKP2蛋白在卵巢各黏液性肿瘤组织中的表达情况(例)
a为良性黏液性囊腺瘤与黏液性交界性肿瘤比较;b为黏液性交界性肿瘤与黏液腺癌比较;c为良性黏液性囊腺瘤与黏液腺癌比较
由表1可见,卵巢良性黏液性囊腺瘤、黏液性交界性肿瘤、黏液腺癌组织中P57KIP2阳性表达率分别为100.0%、91.7%、44.7%,良性黏液性囊腺瘤与黏液性交界性肿瘤其阳性表达率比较无统计学差异(P>0.05),而黏液性交界性肿瘤与黏液腺癌、良性黏液性囊腺瘤与黏液腺癌比较均具有统计学差异(P<0.05);卵巢良性黏液性囊腺瘤、黏液性交界性肿瘤、黏液腺癌中SKP2阳性表达率分别为0、16.7%、36.2%,良性黏液性囊腺瘤与黏液性交界性肿瘤、黏液性交界性肿瘤与黏液腺癌比较无统计学差异(P>0.05),而良性黏液性囊腺瘤与黏液腺癌其阳性表达率比较具有统计学差异(P<0.05)。
2.2 P57KIP2、SKP2蛋白表达与卵巢黏液腺癌临床病理特征的关系
P57KIP2、SKP2表达与卵巢黏液腺癌患者年龄、淋巴结转移无相关性(P> 0.05),与卵巢黏液腺癌组织学分化及TNM分期相关(P< 0.05),在高、中、低分化卵巢黏液腺癌中P57KIP2阳性表达率依次下降,而SKP2阳性表达率依次升高,见表2。
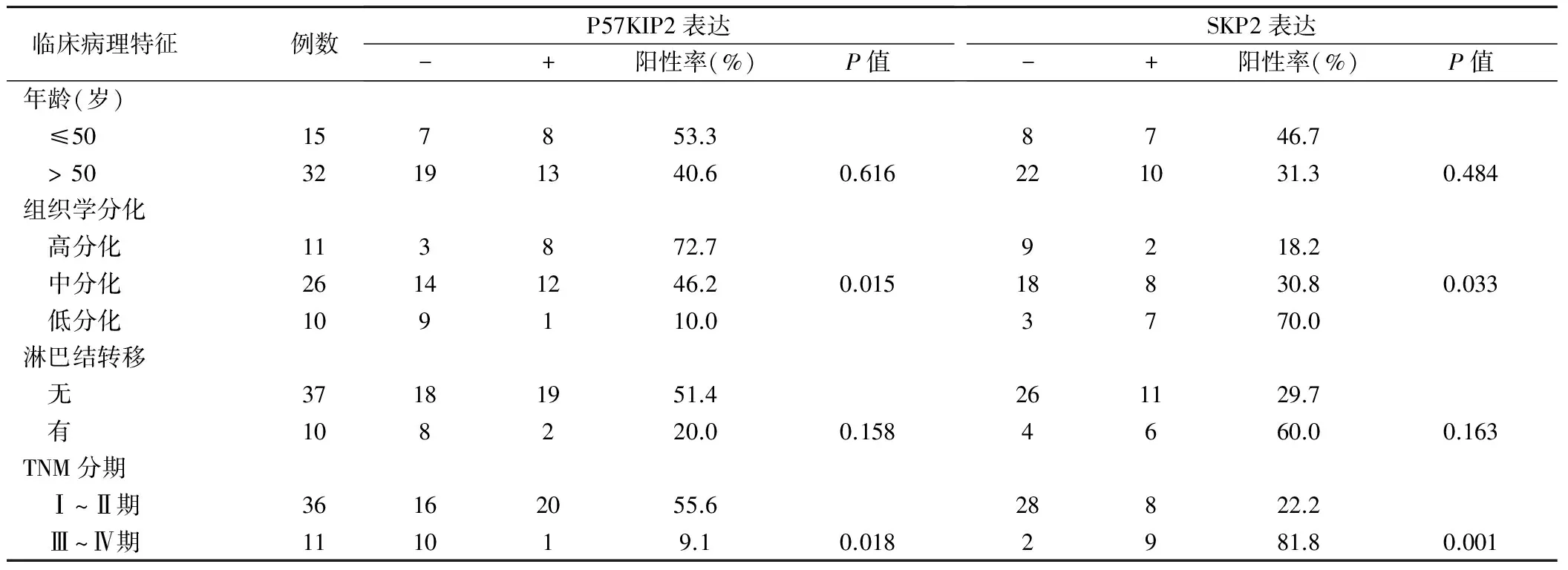
表2 P57KIP2、SKP2蛋白表达与卵巢黏液腺癌临床病理特征的关系(例)
2.3 P57KIP2、SKP2蛋白在胞质中的表达与淋巴结转移的关系
10例有淋巴结转移中,P57KIP2胞质阳性表达4例,阳性率为40.0%(4/10),37例无淋巴结转移中,P57KIP2胞质阳性表达3例,阳性率为8.1%(3/37),两者比较差异有统计学意义(P<0.05);有淋巴结转移病例中SKP2胞质阳性表达1例,阳性率为10.0%(1/10),无淋巴结转移病例中,其胞质阳性表达6例,阳性率为16.2%(6/37),两者比较差异无统计学意义(P>0.05)。
2.4 卵巢黏液腺癌组织中P57KIP2与SKP2表达的相关性
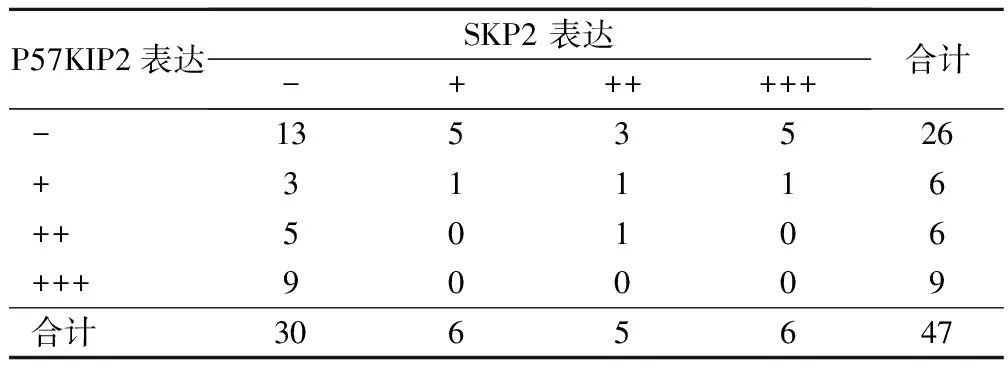
表3 卵巢黏液腺癌组织中P57KIP2与SKP2表达的相关性(细胞核表达)(例)
由表3可见,卵巢黏液腺癌中P57KIP2蛋白和SKP2蛋白同时阳性表达有4例(4/21),P57KIP2蛋白和SKP2蛋白同时阴性表达有13例(13/26) ,经Pearson相关分析两者呈负相关性(γ=-0.292,P=0.046<0.05)。
3 讨论
研究表明P57KIP2蛋白通过与Cyclin-CDK复合物结合而抑制CDK活性,P57KIP2 蛋白主要抑制CyclinE-CDK2、CyclinA-CDK2等G1期和S期激酶复合物,使细胞不能通过 G1期[1],从而抑制细胞的增殖 ,起到肿瘤抑制基因的效应。本研究结果显示P57KIP2在卵巢良性黏液性囊腺瘤、黏液性交界性肿瘤、黏液腺癌中阳性表达率依次降低,良性黏液性囊腺瘤与黏液性交界性肿瘤其阳性表达率比较无统计学差异,而两者与黏液腺癌阳性表达率比较均有统计学差异。在黏液腺癌中,P57KIP2表达与患者年龄、淋巴结转移无关,其低表达与肿瘤分化低及TNM分期晚有关,另外,本研究结果显示有淋巴结转移黏液腺癌P57KIP2胞质阳性表达率较无淋巴结转移黏液腺癌明显升高,差异具有统计学意义。有学者提出P27KIP1蛋白在胞质中表达与CyclinD1和CyclinD3过表达显著相关,并发现P27KIP1突变后(CyclinD结合位点的丢失),则在核中的表达增强[2]。由于P57KIP2与P27KIP1是密切相关的2种CDKI,同属CIP/KIP家族,在结构上也具有一定的同源性,因此推测在细胞恶变的过程中,细胞核中的CyclinD出现过表达,P57KIP2在细胞核中合成后与CyclinD-CDK4结合并被移致胞质,导致胞质中P57KIP2表达水平升高而胞核中P57KIP2表达水平下降。
本研究结果显示,SKP2在卵巢良性黏液性囊腺瘤、黏液性交界性肿瘤、黏液腺癌中阳性表达率依次升高,良性黏液性囊腺瘤与黏液性交界性肿瘤、黏液性交界性肿瘤与黏液腺癌中SKP2阳性表达率比较无统计学差异,而良性黏液性囊腺瘤与黏液腺癌中其阳性表达率具有统计学差异,在黏液腺癌中SKP2表达与患者年龄、淋巴结转移无关,而其高表达与肿瘤分化低及TNM分期晚有关,有淋巴结转移黏液腺癌SKP2胞质阳性表达率较无淋巴结转移黏液腺癌有所降低,但差异无统计学意义。这些结果表明了SKP2高表达与黏液腺癌的发生发展相关。虞志强[3]研究结果发现大肠癌中SKP2阳性表达率与脉管内癌栓、淋巴结转移率呈正相关,显示SKP2在大肠癌中表达水平与组织分化程度和TNM分期有关,在低分化大肠癌中呈高表达,且其表达水平在高、中、低分化癌组织中存在显著性差异,说明SKP2蛋白过表达与大肠癌发生和发展相关。这些结果都表明,SKP2在细胞分化过程中发挥重要作用,因此,SKP2可能作为判断恶性肿瘤恶性程度的辅助指标。
P57KIP2和P27KIP1是2种密切相关的CDKI,同属于CIP/KIP家族,两者的N-末端有40%的同源性,而C-末端均有核触发区域,其中含有磷酸化位点,P57KIP2的磷酸化位点是310位苏氨酸,P27KIP1的磷酸化位点是187位苏氨酸。cyclinE-CDK2促使P27KIP1的187位苏氨酸磷酸化,磷酸化后的P27KIP1能被SKP2识别而进入泛素蛋白酶体途径被降解[4],本研究旨在探讨磷酸化后的P57KIP2是否也能被SKP2识别而进入泛素蛋白酶体途径被降解。本研究结果经Pearson相关分析显示P57KIP2表达与SKP2表达呈负相关,从而初步推测在卵巢粘液性腺癌发生发展的过程中,SKP2参与了P57KIP2的降解,这与Kamura[5]的研究结果基本一致。目前有研究表明,SKP2是在G1期向S期转换的过程中降解P57KIP2,而在G0/G1过度期也可以观察到P57KIP2的降解,至于P57KIP2在G0/G1过度期的降解机制目前仍不清楚,需要进一步探讨。
所以,在卵巢黏液腺癌发生发展的过程中P57KIP2表达水平下降的原因推测如下:① 在卵巢组织恶变的过程中,细胞核中的cyclinE-CDK2复合物的活性增强,使P57KIP2磷酸化而被SKP2识别并进入泛素蛋白酶体途径被降解;②在细胞恶变的过程中,细胞核中CyclinD出现过表达,P57KIP2在细胞核中合成后与CyclinD-CDK4结合并被移致胞质,导致细胞核中P57KIP2的表达水平下降;③在卵巢组织恶变的过程中,P57KIP2基因组出现了基因印记缺失或印记错误导致了基因表达水平下降。细胞核中P57KIP2表达水平下降,使P57KIP2对CyclinE-CDK2 、CyclinA-CDK2的结合抑制作用及对PCNA的结合抑制作用减弱,从而减弱了对细胞周期的抑制作用,又进一步促进卵巢组织的恶变。
综上所述,P57KIP2、SKP2的异常表达与卵巢黏液腺癌的发生、发展密切相关,P57KIP2抑制卵巢黏液腺癌的发生发展,而SKP2促进其发生发展。P57KIP2、SKP2蛋白的检测可为判断卵巢黏液腺癌的恶性程度提供重要参考。目前,国内外关于SKP2与P27KIP1的相关性的研究较多,但对于SKP2与P57KIP2的相关性的研究较少,本研究初步证实了在卵巢组织恶变的过程中SKP2参与了P57KIP2的降解。关于P57KIP2和SKP2的表达及两者相关性的进一步阐述,将有助于揭示卵巢黏液腺癌的发生机制并为临床治疗提供指导意义。
[1] Rosenberg E,Rita I.Exp ression of cell cycle regulators p57
KIP2,cyclinD1,and cyclinE in epithelial ovarian tumors and survival〔J〕.Hum Pathol,2001,32 (8) :808.
[2] Gustavo B,Barbara B,Paola B,et al.Overexpressed cyclinD3 contributes to retaining the growth inhibitor p27 in the cytoplasm of thyroid tumor cells〔J〕.J Clin Invest,1999,104(7):865.
[3] 虞志强.SKP2蛋白在直肠癌及其远端切缘组织中表达的临床意义〔J〕.实用癌症杂志,2009,5(24):471.
[4] Tsvetkov LM,Yeh KH,Lee SJ,et al.p27kip1 ubiquitination and degradation is regulated by the SCFSKP2 complex through phosphorylated Thr187 in p27〔J〕.Curr Biol,1999,9:661.
[5] Kamura T,Hara T,Kotoshiba S,et al.Degradation of p57(K-IP2) mediated by SCFSKP2-dependent ubiquitylation〔J〕.Proceedings of the National Academy of Sciences of the United States of America,2003,100(18):10231.

