5个温郁金居群遗传多样性的RAPD分析
陶银龙 王佐元 丁文勇 郑蔚虹
(温州大学 生命与环境科学学院,浙江 温州325035)
温郁金(Curcumawenyujin)为姜科(Zingiberaceae)姜黄属(Curcuma),多年生草本植物,是著名的“浙八味”之一.温郁金在宋朝《证类本草》(公元1108年前)中即有记载,因产于浙江温州而得名,素有温州逢莪术之称,至今已有近千年的种植历史。由于人类无节制的采挖,野生温郁金几乎绝迹,被浙江省列为重点保护物种。目前市面上见到的温郁金为人工栽培品种,主要种植于瑞安的陶山、荆谷、碧山、马屿及乐清的四都和平阳的梅源一带。温郁金是一种以根和茎两部位均可入药的药材,具有很高的药用价值,可加工成3种功效不一的药材:块根煮透,晒干称为“温郁金”;根茎煮透,晒干为“温莪术”;根茎纵切成片,晒干后为“片姜黄”.[1-2]调查显示,目前温郁金种植面积不断增加,但连年出现未成熟叶子就枯黄的现象(主要在陶山沙洲),导致减产,严重的甚至绝收.初步了解,造成温郁金减产和绝收的主要原因有:(1)温郁金的生长环境受到污染,已不利于其生长;(2)长期的人工种植,种质发生了退化,使得一些优良性状遗失.此外,过多的使用化肥和农药在一定程度上也影响温郁金的产量.
植物的遗传多样性是品种遗传改良的基础.DNA分子标记能客观、较准确地检测作物基因组DNA水平的差异.各种DNA分子标记在群体中都有足够频率的等位性变异,利用分子标记技术可以评价和描述相关品种多样性及亲缘关系的远近,从而达到种质资源鉴定的目的.目前,DNA分子标记已在水稻、小麦和大豆等农作物的种质资源鉴定中得到了广泛应用[3].分子标记的应用为植物育种学开辟了新的研究和应用领域,它使植物育种学家能直接从分子水平了解种间的差异,可使人们在育种筛选过程中节省时间及大量的人力、物力和财力[4-5].
1990年,由Williams[6]和Welsh[7]带领的两个研究小组在PCR(Polymerase Chain Reaction,聚合酶链式反应)的基础上,同时首次运用随机引物扩增多态性DNA片段作为分子标记,并将此方法命名为RAPD(Random Amplified Polymorphic DNA).RAPD标记不要求特别纯的DNA模板,而且RAPD方法具有简单、迅速、可重复性好的特点[8].RAPD技术在国内外已广泛应用于动、植物及微生物遗传多样性的检测、遗传育种、基因诊断、居群遗传学、生物系统学与进化、物种品系鉴定、物种起源进化研究、基因定位、品系鉴定和遗传图谱构建等方面的研究[9-13].
本文旨在用分子标记中的RAPD技术,对从温州瑞安、平阳和乐清温郁金种植地选取的5个居群、每个居群10个个体进行RAPD-PCR分析,以揭示温郁金居群间的亲缘关系以及遗传背景,对人们了解温郁金居群的遗传多样性、各居群之间的亲缘关系以及温郁金遗传资源的收集、保护和利用提供理论基础.
1 材料
本实验的材料来源于瑞安的沙洲、丰和、梅屿,平阳的梅源以及乐清的四都这5个种植地,记为5个居群,每个居群随机选取15~25个个体,分别装袋,用硅胶干燥,并随机对每个个体进行编号(1,2,3,…),置于-70℃超低温冰箱中保存,备用.
2 方法
采用改进的CTAB法[14]提取温郁金的DNA基因组.
2.1 RAPD-PCR扩增反应
反应体系:扩增反应在25 μL反应体系中进行,其中含40 ng左右的基因组DNA模板,1×PCR Buffer,2.5 mmol/L MgCl2,0.2 mmol/L dNTP,0.4 μmol/L 引物,Tag DNA聚合酶1.5 U,加ddH2O至25 μL.
PCR反应在Whatman Biometra的Tpersonal PCR仪上进行[15],反应程序如下:94 ℃预变5min;94 ℃变性0.5 min;35℃退火1.0min,72 ℃延伸1.5 min;循环35次;继续72 ℃延伸10min.反应结束后在4 ℃保存.
2.2 数据处理
利用凝胶成像系统(UVP)对基因组DNA的PCR扩增产物电泳图谱进行记录,通过DL 2000 DNA Marker标注各条带(扩增产物)的分子量,并导出Excel表格.无条带的记为0,有条带的记为1,形成0/1矩阵图并输入计算机.根据所得的0/1矩阵图,利用POPGENE32软件计算多态位点百分率、Nei’ s基因多样性指数、Shannon’ s多态性信息指数、基因分化系数(Gst)、基因多样度(Ht)、居群内基因多样度(Hs)、Nei’ s(1978)遗传一致度和遗传距离(D),并根据Nei的遗传一致度和遗传距离绘制出UPGMA种系发生图.
3 结果与分析
3.1 引物筛选
基因组DNA模板的质量对PCR扩增反应的结果有很大的影响,为了得到较纯的基因组DNA模板,要尽量防止基因组DNA在提取过程中被污染和降解.使用已优化好的RAPD反应体系,对40个引物进行PCR扩增反应,筛选出如下6个引物序列:5′-CAGGCCCTTC-3,5′-TGCCGAGCTG-3,5′-AATCGGGCTG-3,5′-GGGTAACGCC-3,5′-AGGTGACCGT-,5′-GTTGCGATCC-3.
3.2 RAPD-PCR扩增
用所选出引物参照优化反应体系对50个个体基因组DNA模板进行PCR扩增反应.谱带统计表明,不同引物扩增出的带数不同;同一个引物,不同居群之间的扩增带数也略有不同.这反映了各个居群及个体间的多态性.

图1 10个DNA基因组RAPD-PCR扩增条带图
3.3 居群遗传多样性分析
广义的遗传多样性是指地球上所有生物所携带的遗传信息的总和.但一般所指的遗传多样性是指种内的遗传多样性,即种内个体之间或一个群体内不同个体的遗传变异总和[16].遗传多样性的产生是由于遗传信息在外界或内在的因素作用下,在复制过程中出现差错(如DNA片段的倒位、易位、缺失或转座等),从而导致了不同程度的遗传变异.自然界的生物以极低的频率不断发生点突变和多种由DNA更新机制(DNA turn over mechanism)引起的更为复杂的突变,这些突变在漂变和漫长的选择中走向固定和消失,形成了物种间和物种内丰富的遗传多样性[17].
用有效的6个引物对50个个体进行PCR扩增反应,共得到1 551条条带和56个有效位点,其中多态位点有54个,多态性达到96.43%.这5个居群之间的多态位点百分率存在一定的差距,平阳梅源最大,为66.07%,乐清四都最小,为30.36%,平均多态位点百分率为46.07%,其大小依次为平阳梅源>瑞安丰和>瑞安沙洲>瑞安梅屿>乐清四都.具体参数见表1.

表1 5个温郁金居群的遗传多样性
从遗传角度看,遗传多样性的降低往往意味着居群的适应能力降低和有害基因增加,导致物种退化[18].但从表1可知,5个居群总的多态位点百分率为96.43%,说明总体的遗传多样性处于很高的水平;总体的Shannon’s指数为0.546 9±0.164 8,总体的Nei’s基因多样性为0.371 5±0.131 5,也表明温郁金居群的遗传多样性水平很高.但居群间的遗传多样性水平处于中等,多态位点百分率平均值仅为46.07%,Nei’s基因多样性平均值仅为0.181 1±0.207 2,Shannon’s指数平均值仅为0.265 0±0.295 9.居群规模不断缩小,这必然会导致遗传漂变,其直接后果就是遗传变异的下降[19].
扩增的DNA片段出现频率小于0.99的位点为多态位点,是检测到的位点中能反映变异水平的最直接的指标[20].多态位点百分率是衡量物种遗传变异水平高低的一个重要指标[21],是度量遗传多样性的重要参数.实验结果表明,温郁金维持了很高的遗传多样性水平.物种的遗传多样性水平可以为其现状和保护价值的评估以及迁地保护提供非常重要的信息.
在已有的研究中,不同物种基因组DNA多态性的程度是不一样的.与芹菜、茄子等相比,姜品种变异的复杂性和分化程度较明显,DNA的多态性最高,平均每个引物扩增DNA带也较多,表明在DNA分子水平上,姜品种存在比较丰富的遗传变异,这正是姜具有极其丰富品种的分子基础[22].
采用POPGEN32软件进行分析,得到总基因多样度Ht=0.371 5 ±0.017 3,居群内基因多样度Hs=0.181 1±0.009 3.根据遗传多样性水平在居群内(Hs)和居群间(Ht-Hs)的分化,两个居群之间的Nei’s基因分化系数为:
这应该与其为人工栽培有很大的关系.据笔者调查了解,各居群的种植户多是自己留种,而且各种植地之间存在一定的距离.居群间的遗传分化是当地自然选择的结果,由不连续的生境异质性引起的居群分化被认为是自然选择的一种[23],居群间的遗传分化是由遗传漂变引起的.
3.4 居群间遗传关系的分析
利用POPGENE32软件计算温郁金居群间的Nei’s无偏差遗传距离和遗传一致度,结果见表2.由表2可知,5个温郁金居群间的Nei’s无偏差遗传距离在0.134 4~0.473 9之间;其中乐清四都和平阳梅源两居群之间遗传距离最小(0.134 4),两者之间的遗传一致度最大(0.874 3);瑞安沙洲和乐清四都之间的遗传距离最大(0.473 9),两者之间的遗传一致度最小(0.622 6).

表2 温郁金居群间的Nei’s无偏差遗传距离(对角线以下)及遗传相似系数(对角线以上)
使用软件POPGENE32对0/1矩阵图进行分析,根据Nei的遗传一致度和遗传距离最后形成一个树型的UPGMA聚类图,见图2.图2清楚地反映了各居群间的关系:5个居群分为两大支,乐清四都和平阳梅源两个居群之间的遗传距离最小,首先聚为一类;瑞安梅屿和瑞安丰和两居群之间的遗传距离次之,聚为二类;然后这两类又聚在一起.最后和瑞安沙洲再聚在一起.
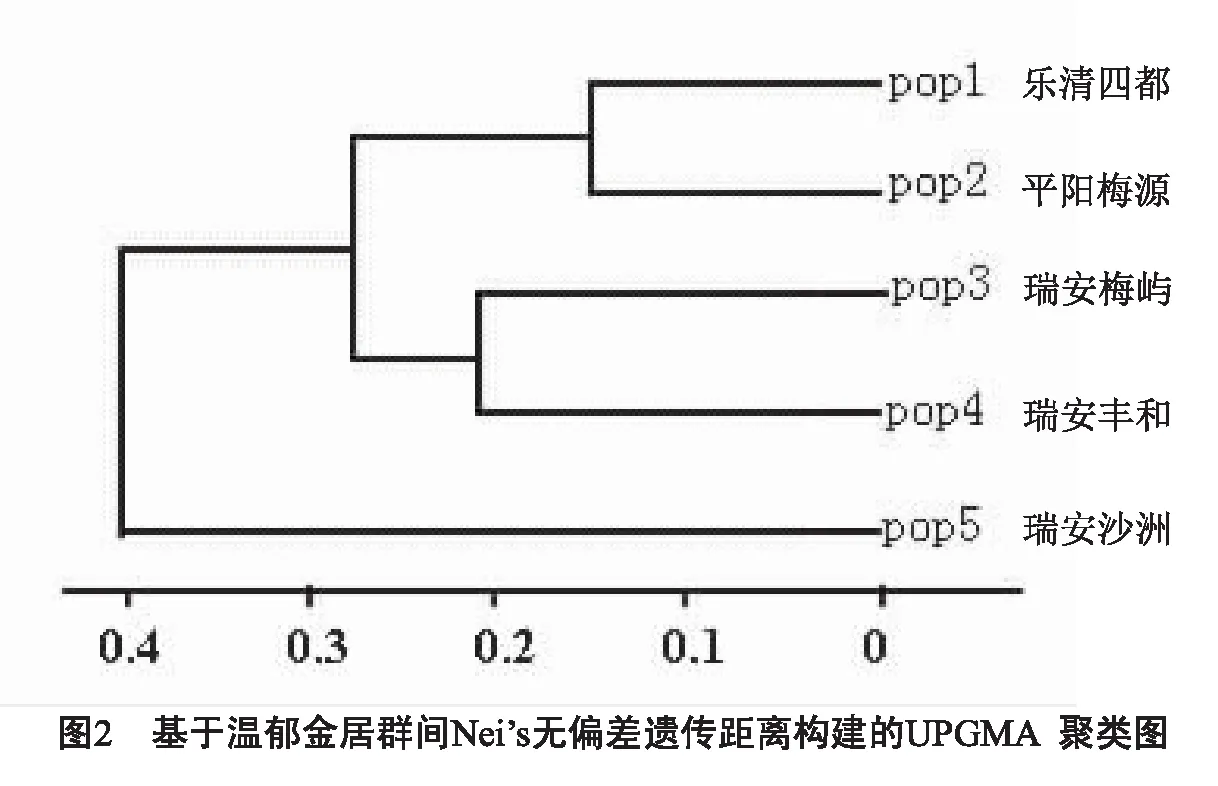
分析乐清四都和平阳梅源聚在一起的原因可能是这两个居群的种子来源于一地,据瑞安种植地农民介绍,乐清四都和平阳梅源的温郁金的种植都是从他们这里引种的,种植的时间也仅仅几年的时间,受其环境的影响不大,而且居群间的基因交流非常狭小.而瑞安沙洲居群与其他居群之间的遗传距离最远,笔者在温郁金还未到成熟时去采样发现,瑞安沙洲的温郁金已经枯萎,与次日观察到的瑞安梅屿和瑞安丰和的温郁金相差很大.据种植户介绍,其原因可能是生长环境受到周边很多砖厂的污染,使得种质发生了退化,基因组DNA发生一些变异,导致与其它居群遗传距离最远.
遗传多样性是生物多样性研究的核心,反映了物种的遗传背景、育种潜力和利用价值,对优良种质的保护和发掘利用具有重要意义.本文对温郁金居群的遗传多样性进行研究,了解各居群之间的亲缘关系,但由于采用的标记方法、样本数等不同,得到的结果与他人[24-25]有所不同,还需进一步深入探讨.建立温州温郁金品种的标准指纹图谱,整理其种质资源,为温郁金的栽培育种工作及资源的合理利用是十分有意义的.
参考文献:
[1]金建忠.超临界CO2萃取温郁金挥发油及其成分分析研究[J].中国中药杂志,2006,31(3):255-257.
[2]秦坤良,汤淙淙,黄可新.温郁金茎叶与块根中挥发油成分的比较研究[J].温州医学院学报,2006,36(2):95-97.
[3]何风华.DNA分子标记及其在植物遗传育种上的应用[J].生物学教学,2004,29(1):8-9.
[4]申响保,徐刚标,陈建华,等.RAPD技术在植物遗传资源研究中的应用[J].湖南林业科技,2005,32(1):25-28.
[5]李海生.ISSR分子标记技术及其在植物遗多样性分析中的应用[J].生物学通报,2004,39(2):19-20.
[6]Williams J G,Kubelik A R,Livak K J, et al.DNA polymorphisms amplified by arbitrary primers are useful as genetic markers[J].Nucleic Acids Research,1990,18(22):6531-6535.
[7]Welsh J,McClelland M.Fingerprinting genomes using PCR with arbitrary primers[J].Nucleic Acids Research,1990,18(24):7213-7218.
[8]赵瑞琳.RAPD分子标记在真菌研究中的应用[J].热带农业科技,2004,27(3):23-26,37.
[9]Iqbal M J,Aziz N,Saeed N A,et al.Genetic diversity evaluation of some elite cotton varieties by RAPD analysis[J].Theoretical and Applied Genetics,1997,94(1):139-144.
[10]Ronning C M,Schnell R J.Using randomly amplified polymorphic DNA(RAPD)markers to identify Annona cultivars[J].Journal of American Society for Horticultural Science,1995,120(5):726-729.
[11]孟祥栋,马红,张卫华.利用RAPD技术对葱属品种遗传关系的分析[J].生物多样性,1998,6(1):37-41.
[12]苏乔,刘文哲,吴军,等.东北地区大豆种质资源的RAPD聚类分析[J].植物研究,1998,18(2):184-188.
[13]汪小全,邹喻萃,张大明,等.RAPD应用于遗传多样性和系统学研究中的问题[J].植物学报,1996,38(12):954-962.
[14]Doyle J J,Doyle J L.A rapid DNA isolation procedure for small quantities of fresh leaf tissue[J].Phytochemical Bulletin,1987,19:11-15.
[15]刁杰,刘景文,吴海英.同核异质小麦材料RAPD分子标记研究[J].山东农业科学,2005,6:13-15.
[16]钱迎倩,马克平.生物多样性研究的原理与方法[M].北京:中国科学技术出版社,1994,13-36.
[17]宾晓芸.金花茶遗传多样性和居群遗传结构的ISSR,RAPD和AFLP分析[D].南宁:广西师范大学硕士研究生学位论文,2005.
[18]金彬明,李佩珍,应俊.5种帘蛤科贝类随机扩增多态性DNA比较分析[J].水利渔业,2006,26(3):14-15,23.
[19]张文标,金则新,李钧敏.濒危植物香果树自然居群遗传多样性的RAPD分析[J].浙江大学学报(农业与生命科学版),2007,33(1):61-67.
[20]宛涛,蔡萍,伊卫东,等.内蒙古白刺属植物遗传多样性的RAPD分析[J].干旱地区农业研究,2007,25(1):225-229.
[21]姜静,杨传平,刘桂丰.应用RAPD技术对东北地区白桦种源遗传变异研究[J].东北林业大学学报,2001,29(2):30-34.
[22]高德民,刘振伟,樊守金.姜品种遗传多样性的RAPD分析[J].农业生物技术学报,2006,14(2):245-249.
[23]Volis S,Yakubov B,Shulgina I,et al.Tests for adaptive RAPD variation in population genetic structure of wild barley,HordeumspontaneumKoch[J].Biological Journal of Linnean Society,2001,74:289-303.
[24]王晓慧,汤晓闯,杨恩秀,等.莪术不同种和居群的ISSR-PCR分析[J].中国中药杂志,2008,33(18):2037-2040.
[25]陶正明,冷春鸿,吴志刚,等.温郁金遗传多样性的ISSR分析[J].浙江农业学报,2009,21(3):207-210.

