从氰化尾渣衍生物制备标准铅、锌精矿的新工艺
汪 洋,李仕雄, 诸向东,於智泉
(1.中南大学 地球科学与信息物理学院,长沙 410083;2.中南大学 有色金属成矿预测教育部重点实验室,长沙 410083;3.中南大学 冶金科学与工程学院,长沙 410083)
在金氰化冶金过程产生的尾渣,经过浮选可产生一种含铅11%~15%、含锌17%~19%的衍生物[1−3]。这种衍生物与最低档的铅精矿和锌精矿相比,其铅含量和锌含量分别要低67.5%和55%,其铅锌总量比铅锌混合矿的还低35%。由于铅锌品位低、含硫等杂质高,迄今为止该类衍生物尚无一种适宜的处理方法[4−5]。由于其在常压下极难溶解,而且冶金性能极差,目前只能以标准铅、锌精矿七分之一的价格廉价销售,故如何从这种氰化尾渣衍生物制备标准铅、锌精矿已成为一个亟待解决的难题。
本文作者对氰化尾渣衍生物进行了细致的理论分析[6−8]和大量的试验研究,获得了氰化尾渣衍生物浸出最佳条件,进而采用X体系氧化浸出工艺对其进行处理。其创新之处有:1)从含铅低至 11%~15%的物料制备品味高达 75.49%的标准铅精矿;2)从含锌低至17%~19%的物料制备品味达 45%标准锌精矿;3)从高硫低铅锌物料高效分离铅、锌和硫;4)发明了较硝酸氧化效果更高、环境条件更好的高效气液固反应器。
1 实验
1.1 实验原料
实验所用的原料取自于某金矿企业从氰化尾渣浮选所得的氰化尾渣衍生物。经过破碎,筛分后,用X射线荧光光谱测得其原料的主要化学成分(见表1)。

表1 氰化尾渣衍生物的主要化学成分Table 1 Main chemical composition of cyanide tailings derivatives (mass fraction,%)
1.2 实验设备与试剂
实验设备:PHS−25型数显酸度计;501针型ORP复合电极;JHS−1型电子恒速搅拌机;YC7124型真空泵;TG328A型光学分析天平(精度0.1 mg)。
实验试剂:试剂A,试剂B,SAA,NHO3,NaOH,Na2CO3,成套缓冲剂。所有试剂均为化学纯。
1.3 实验原理
在酸性介质中存在氧化剂(A)的情况下,金属硫化物容易被氧化分解成金属离子和元素硫:
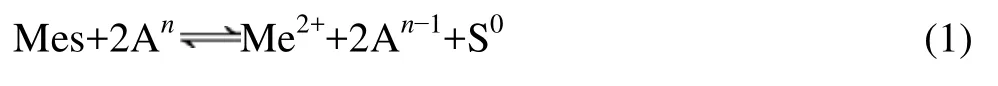
该反应属于多相氧化还原反应,适用于湿法冶金浸出的电化学反应机理[9],其反应自由焓ΔG和溶液电位ε存在ΔG=−nFε 的关系,因此,可以将溶液电位ε作为水溶液中硫化物氧化还原反应趋势的量度。
根据 Nernst公式 ε=ε0−[RT/(nF)]lnK 可以看出,在金属硫化物的氧化分解浸出的过程中,当浸出矿浆氧化电位低于其金属硫化物在溶液中的平衡电位ε0时,反应(1)将会逆向进行,也就是说,该硫化物不能被氧化分解;只有在浸出矿浆的氧化电位高于硫化物的溶液平衡电位ε0时,该金属硫化物的氧化分解才具有可能性[10]。
根据冶金原理,从MeS-H2O系电位—pH图(见图1)[11−12]不难看出,铜、铅、锌和银等金属硫化物在溶液中的氧化分解的平衡电位不同。根据这些硫化物间的氧化分解的平衡电位的差异,控制适当的浸出电位,可以有选择地将金属铅的硫化物氧化分解浸出,并抑制其他金属(如铁、铜)化合物的氧化分解,实现有价金属的浸出分离。
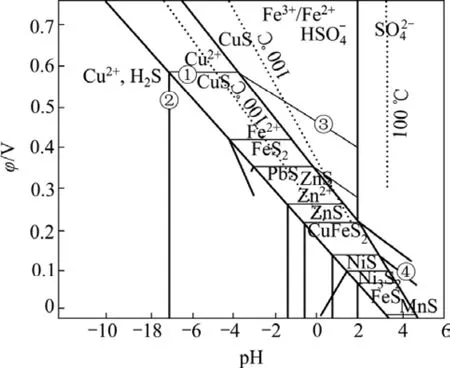
图1 MeS-H2O系电位—pH图Fig.1 Potential— pH diagram of MeS-H2O [HSO4−]+[SO42−]=1.0mol/L; [Men+]=1.0 mol/L; [H2S]=0.1mol/L; (The solid line represents temperature of 25 ℃, the dotted line represents temperature of 100 ℃.)
从图1还可以看出,对于ZnS、PbS和CuFeS2等硫化物而言,在适当的电位和 pH值下,硫化物氧化得Me2+的溶液和元素硫。如:
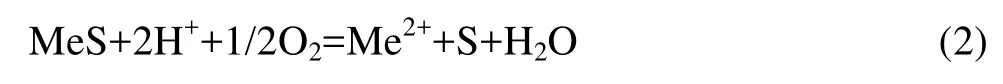
在氧化气氛下,控制 pH值使溶液偏中性,硫化物也可以氧化成 Me2+和 SO42−而进入溶液[13]。由于PbSO4的溶解度很低,故不利于PbS的溶解分解,故在氧化过程应控制pH值以减少PbSO4的生成。
从图1还可知,ZnS较PbS更易于氧化,最初考虑用酸优先浸锌,但由于大量铅化合物的包裹,即使酸浓度在 0.4%~40%的范围,锌的浸出率也只有16.8%~50%,而且铁的浸出率比锌高,在高酸溶液分离锌铁,又将使溶出的锌大部分进入铁渣。因此,选择PbS溶解而ZnS不溶或少溶,以便铅入液而锌入渣形成锌精矿,浸出体系可以选择酸性的X体系[14−15]。
1.4 实验方法
在2 L 烧杯中放入800 mL自来水,加入试剂A,然后加热升温,当温度升至 50 ℃搅拌加入 22.6 mg SAA,继续升温,在适宜温度时加入试剂B,并搅拌加入 100 g 氰化尾渣衍生物,搅拌速度控制在 350 r/min,控温并加入氧化剂保持电位,反应快到终点时加入少量的絮凝剂(3#)搅匀,趁热过滤,然后浸铅渣经100~120 ℃的煤油脱硫转化为锌精矿,溶硫液冷却得到硫磺,浸铅液经结晶转化得铅精矿。氰化尾渣衍生物中的铁大部分进入锌精矿,少量入浸铅液 在结晶转化时与铅分离。
2 结果与分析
2.1 浸出电位控制值测定
取氰化尾渣衍生物 50g,在酸性体系下,通入流量为 0.5 L/min的O2,温度控制在70 ℃,滴加65%(质量分数)的HNO3,滴定速度为每分钟5滴,数显酸度计测定反应过程电位,间隔取样分析Pb2+、Cu2+、Zn2+、Fe2+、As2+和Sb2+浓度,以浸出液中金属离子质量除以浸出原料中金属质量分数为金属的浸出率。通过数据处理获得电位与金属浸出率的关系如图2所示。由图2可以看出:
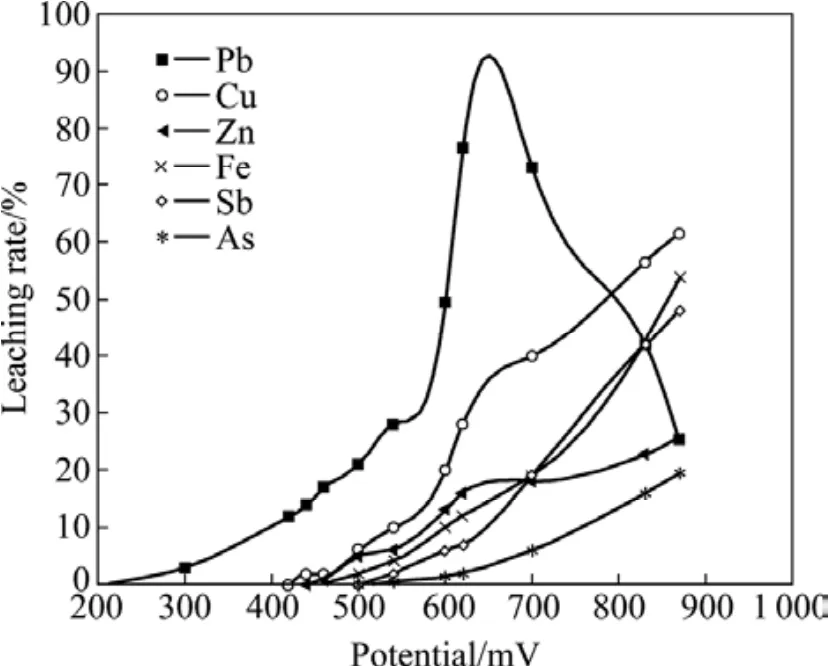
图2 70℃时电位与金属浸出率的关系Fig.2 Relationship between potential and metal leaching rate at 70℃
1)当体系电位为200~600 mV时,铅的浸出率随电位升高而显著增加;电位为600~650 mV 时,铅浸出率达到最大值,此时,其他金属浸出率较低,浸出量较少;电位超过700 mV时,铅浸出率显著下降,这主要是体系中的硫被氧化,产生大量的 SO4−,而PbSO4在酸溶液中的溶解度很小所致,在此时其他杂质金属的浸出率则显著增加[16]。
2)当体系电位为600~650 mV时,铅有较高的浸出率,杂质浸出较少能进行选择性浸出。因此,在浸出过程中,选择浸出铅的电位为 600~650 mV,相当于ORP复合电极电位为346~396 mV。
2.2 氧化剂的选择
为了寻找氰化尾渣衍生物直接酸浸的氧化剂(A),测定了氧化剂对溶液电位的影响,如表2所列。其中,ε1指取300 mL H2O作底液时测的电位,ε0指往底液加10 mL液体氧化剂或加10 g固体氧化剂(NaClO3溶解后加入)后引起溶液电位升高的值。
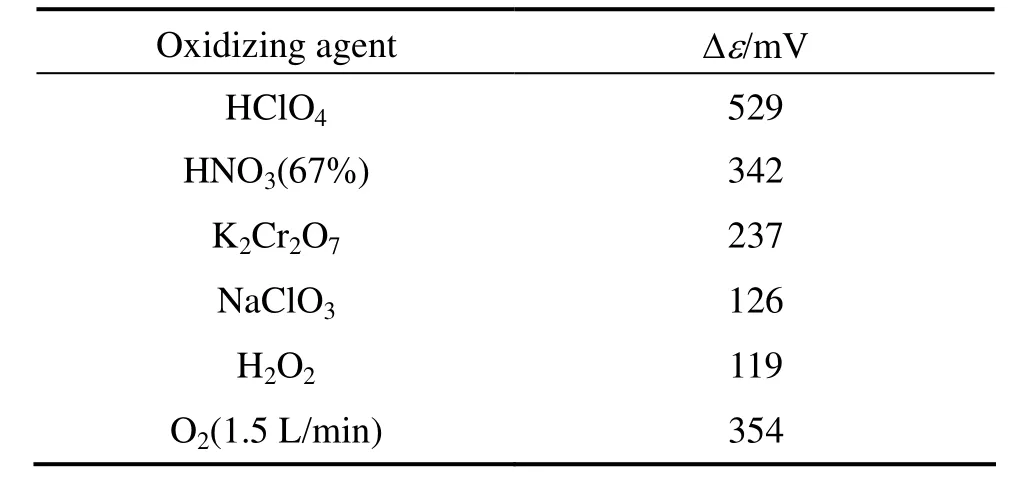
表2 常用氧化剂对溶液电位的影响Table 2 Influences of oxidizing agent on solution potential
由表2 可知,质量分数为67%的HNO3和鼓氧量为1.5 L/min的O2所引起的溶液电位升高量恰好与2.1节分析得到的电位(346~396mV)相近。因此,考虑用HNO3和 O2这两种物质作为本实验浸出 PbS的氧化剂。但HNO3体系存在不利于溶液中铅的回收及环境污染的问题,为此,本研究采用高效气液固反应器强化氧的作用,使Δε高达 400 mV,即有利于溶液中铅的回收,又没有环境污染的问题。
2.3 工艺参数对锌回收率与锌品位的影响
2.3.1 总酸量对锌回收率、锌精矿品位以及铅浸出率的影响
浸出条件:氰化尾渣衍生物100 g,试剂B 90 g/L,反应时间3 h,浸出温度70 ℃,液固比L/S=10:1,鼓氧量1.5 L/min。总酸量对锌回收率、锌精矿品位的影响见图3。
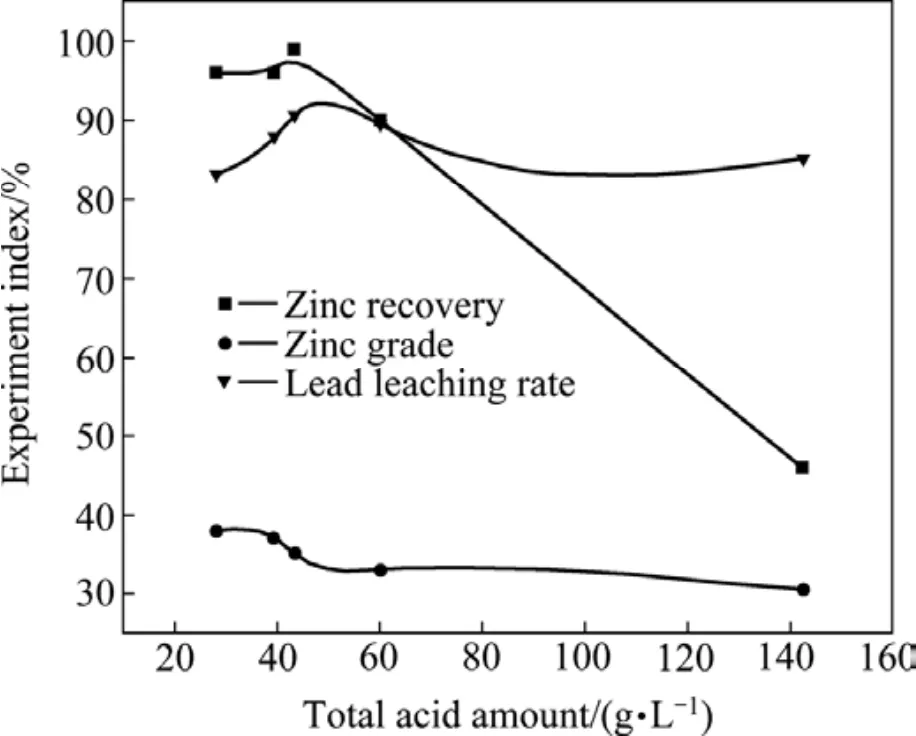
图3 总酸量对锌回收率、锌精矿品位以及铅浸出率的影响Fig.3 Effect of total acid amount on zinc recovery, zinc concentrate grade and lead leaching rate
总酸量主要是指试剂 A和 HNO3的浓度,其中HNO3的主要是用来控制浸出体系电位)。由图3可知:
1)在总酸量小于43.4 g/L时,锌的回收率保持在96%左右,这主要是在此总酸量之下,锌基本不浸出。而在总酸量大于 43.4 g/L时,锌回收率曲线急剧下降,这表明体系中的硫化锌大量溶解,精矿中的锌减少[17]。反应式如下:

2)从铅的浸出率曲线可知,在总酸量小于 43.4 g/L时,铅的浸出率随着总酸量的增加而增大。在总酸量为43.4 g/L时,铅的浸出率达到最大值90.68%。而当总酸量继续增加时,铅的浸出率有小幅降低。主要原因是总酸度较小时,存在如下的水解平衡:
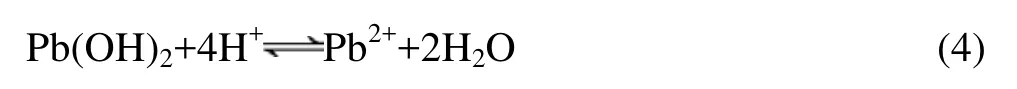
随着反应的进行,溶液中Pb2+的浓度越来越高,使得水解反应(4)向生成Pb(OH)2沉淀的方向进行,直到反应达到平衡。此时即使增加浸出时间,铅的浸出率也不能升高。如果向溶液中加入试剂A,增加了溶液中H+的浓度,打破了体系原有的平衡,水解反应会向Pb(OH)2沉淀溶解的方向进行。因此,增加溶液中试剂A的浓度可以提高铅的浸出率。但是在氧化性气氛下,如果总酸量过高,浸出体系中的硫化物可以氧化成 Me2+和 SO42−,Pb2+和 SO42−结合会形成 PbSO4。由于PbSO4的溶解度很低,故不利于PbS的溶解分离,使得铅的浸出率降低。
从图3还可以看出,锌精矿的品位随着总酸量增加有降低的趋势。综合考虑后,本实验采用总酸量在较低的43.4 g/L为宜,其中,试剂A的浓度为15.6g/L,HNO3的浓度为27.8 g/L。
2.3.2 试剂B的浓度对锌回收率、锌精矿品位以及铅浸出率的影响
试剂B是某些金属离子的配合剂。由于试剂B与Pb2+形成配合物的稳定常数比锌离子配合物的稳定常数高,故在某种浓度下,铅配合物稳定,锌配合物不稳定,从而起到了浸铅抑锌的效果。
浸出条件:氰化尾渣衍生物100 g,试剂A 的浓度15.6 g/L,HNO3的浓度27.8 g/L,反应时间3 h,浸出温度70 ℃,鼓氧量1.5 L/min,液固比L/S=10:1。试剂B浓度对锌回收率、锌精矿品位的影响见图4。
由图4可知:当试剂B的浓度小于90 g/L时,锌的回收率大致保持不变,而当试剂 B的浓度大于 90 g/L 时,锌的回收率急剧下降。这表明此时氰化尾渣衍生物中的ZnS大量浸出进入溶液。而铅的回收率随着试剂B的浓度增加而升高,在试剂B的浓度为90 g/L时达到最大值。当试剂B的浓度大于90 g/L时,铅的浸出率随着试剂B的浓度增加基本保持不变。这是因为PbSO4虽然在水中的溶解度比较小,但是在试剂B中的溶解度很大,而且还可以以不同配位数的配合物形式浸出[18]。因此,增加试剂 B有利于铅的浸出,在试剂B达到饱和时,溶液中的B物质不再增加,铅也不再浸出。而且在试剂B的浓度为90 g/L时,锌精矿的品位也较高。综合考虑后,选择试剂B的最佳浓度为90 g/L。
2.3.3 浸出时间对锌回收率、锌精矿品位以及铅浸出率的影响
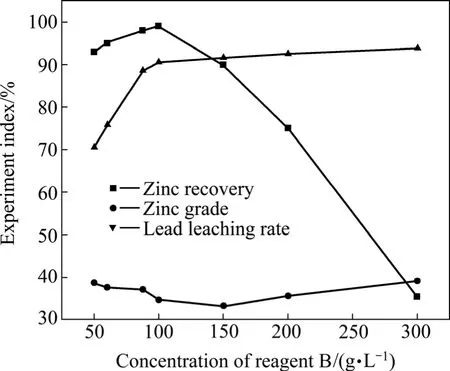
图4 试剂B浓度对锌回收率、锌精矿品位以及铅浸出率的影响Fig.4 Effect of concentration of reagent B on zinc recovery,zinc concentrate grade and lead leaching rate
浸出条件:氰化尾渣衍生物100 g,试剂A 的浓度15.6 g/L,HNO3的浓度27.8 g/L,试剂B的浓度 90 g/L,浸出温度 70 ℃,鼓氧量 1.5 L/min,液固比L/S=10:1。浸出时间对锌回收率、锌精矿品位以及铅浸出率的影响见图5。
由图5可知:铅的浸出率随浸出时的延长间变化不大,表明体系中反应基本达到平衡,在反应时间3 h时,铅精矿浸出率略有下降,这可能是体系中有少量硫被氧化成SO42−与Pb2+形成溶解度比较低的 PbS的缘故。
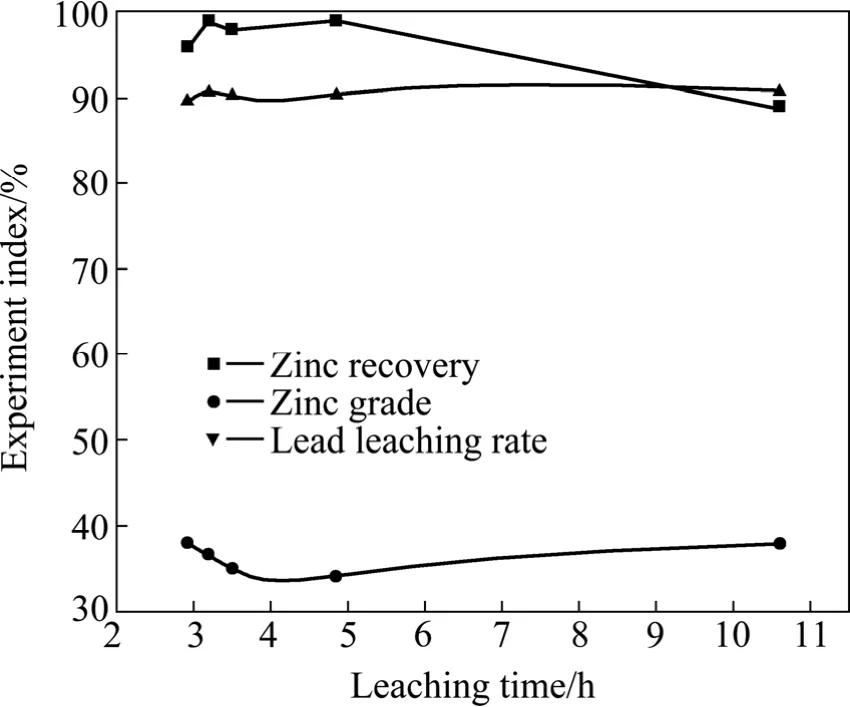
图5 浸出时间对锌回收率、锌精矿品位以及铅浸出率的影响Fig.5 Effect of leaching time on zinc recovery, zinc concentrate grade and lead leaching rate
在浸出时间小于5 h时,浸出时间对锌的回收率的影响不大,锌的回收率基本保持在96%以上。而当浸出时间大于5 h,锌的回收率开始下降,ZnS被氧化浸出,这表明浸出时间过长不利于锌的回收。
综合考虑后,本实验的最佳浸出时间选为5~6 h,此时,锌精矿的品位也较高。
2.3.4 浸出温度对锌回收率、锌精矿品位以及铅浸出率的影响
浸出条件:氰化尾渣衍生物100 g,试剂A的浓度 15.6g/L,HNO3的浓度 27.8 g/L,试剂 B的浓度90g/L,浸出时间 3 h,鼓氧量 1.5 L/min,液固比L/S=10:1。浸出温度对锌回收率、锌精矿品位以及铅浸出率的影响见图6。
由图6可知:当浸出温度低于70 ℃时,浸出温度对锌的回收率影响不大,而对铅的浸出率影响很大,这表明当浸出温度低于70 ℃时,ZnS基本不浸出,而PbS的浸出率随着温度的升高而增大。当浸出温度高于 70 ℃时,温度对铅的浸出率影响很小,而此时锌的回收率急剧下降,表明 ZnS被大量浸出,影响锌精矿品位。综合考虑后,本实验最佳浸出温度选为70 ℃。
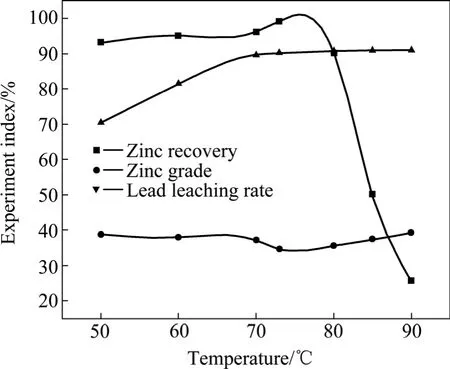
图6 浸出温度对锌回收率、锌精矿品位以及铅浸出率的影响Fig.6 Effect of leaching temperature on zinc recovery, zinc concentrate grade and lead leaching rate
2.4 二段浸铅和气液固强化浸出法对锌精矿品位的影响
在上述实验中,采用一段浸铅法进行浸出。实验得出的数据表明,采用一段浸铅法所得锌精矿品位仅有 30%~37%,其主要原因是铅在锌精矿中的含量太高。为了将锌精矿中的铅脱去,采用二段浸铅法与气液固强化浸出法结合进行3组对照组试验,得出了3组不同的数据如表3所列。
其中A1试验采用一段浸铅法,用HNO3和O2作氧化剂,在常规反应器浸出3 h后所得锌精矿的品位只有34.65%。A2试验在A1试验的基础上采用二段浸铅,每段浸出时间为3 h,并用HNO3和O2作氧化剂,所得锌精矿的品位明显提高,达到了 39.71%。A3试验没有加HNO3,将反应器改为气液固高效反应器,仅通过鼓入1.5 L/min的O2来进行氧化浸出,二段浸出后所得锌精矿的品位可达 45%。A3试验的电位为400 mV,比A1和A2试验的电位要高50 mV,因而A3试验中反应脱硫更完全,锌精矿的品位最高,其原因与气液固高效反应器有关。
结果表明,二段浸铅法与气液固强化浸出法相结合能明显提高锌精矿的品位,并且这种方法中铅的总回收率高达90.68%,锌的总回收率高达99%。A3试验所得的铅精矿和锌精矿的化学成分如表4所列。
由表4可知,实验所得的铅精矿质量符合 YB 113—82,锌精矿质量符合YB114—82标准。而且浸铅渣在脱硫工序中得到了纯度高达99%以上的硫磺,单质硫的回收率可达99.1%。
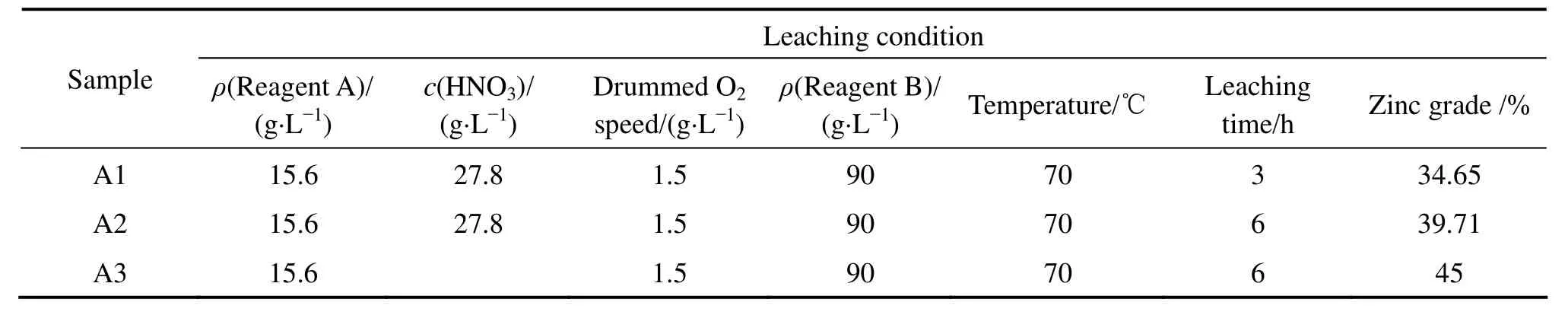
表3 浸出条件与锌精矿品位的关系Table 3 Relationship between leaching condition and zinc concentrate grade
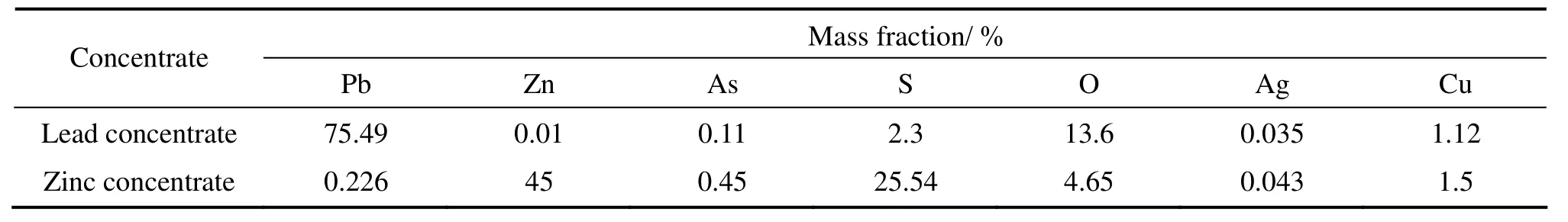
表4 A3实验所得铅锌精矿的化学成分Table 4 Chemical composition of lead and zinc concentrate in A3
3 结论
1)氰化尾渣衍生物氧化浸出的最佳工艺条件如下:试剂A 15.6 g/L,试剂B 90 g/L,液固比L/S=10:1,鼓氧量1.5 L/min,温度70 ℃,采用二段浸铅法,每段浸出时间为3 h 。
2)采用二段浸铅法与气液固强化浸出法相结合进行浸出,浸铅渣通过脱硫可得锌精矿,浸铅液经结晶转化为铅精矿。在最佳工艺条件下铅的总回收率高达 90.68%,铅精矿的品位为 75.49%。锌的总回收率高达99%,锌精矿品位为45%。铅锌精矿杂质含量都符合我国铅锌精矿质量标准。
3)浸硫液冷却过滤可得到硫品位为99%的硫磺,单质硫的回收率高达99.1%。
[1]李学强, 庄宇凯, 冯金敏, 徐忠敏.氰化尾渣综合回收试验研究[J].黄金, 2010, 31(9): 43−45.LI Xue-qiang, ZHUANG Yu-kai, FENG Jin-min, XU Zhong-min.Experimental study on integrative recovery technique of cyanidation tailings[J].Gold, 2010, 31(9): 43−45.
[2]蒋继穆.我国铅锌冶炼现状与持续发展[J].中国有色金属学报, 2004, 14(S1): 52−62.JIANG Ji-mu.Status and sustainable development of lead and zinc smelting industry in China[J].The Chinese Journal of Nonferrous Metals, 2004, 14(S1): 52−62.
[3]路明福, 温建波.氰化尾渣综合回收工艺及实践[J].黄金,2010, 31(10): 52−54.LU Ming-fu, WEN Jian-bo.Comprehensive recovery and production practice of cyanidation tailing[J].Gold, 2010, 31(10):52−54.
[4]刘 丽, 丰章发, 刘 林.某银锌铅矿石可选择性试验研究[J].矿业工程, 2009, 7(3): 32−33.LIU Li, FENG Zhang-fa, LIU Lin.Research test of beneficiation practicability of silver-lead-zinc ore[J].Mining Engineering,2009, 7(3): 32−33.
[5]TURAN M D, ALTUNDOĞANB H S, TÜMEN F.Recover of zinc and lead from zinc plant residue[J].Hydrometallurgy, 2004,75(1/4): 169−176
[6]彭容秋.铅锌冶金学[M].北京: 科学出版社, 2003: 114−118.PENG Rong-qiu.Metallurgy of lead-zinc[M].Beijing: Science Press, 2003: 114−118.
[7]RUSEN A, SUNKAR A S, TOPKAYA Y A.Zinc and lead extraction from Çinkur leach residues by using hydrometallurgical method[J].Hydrometallurgy, 2008, 93(1/2): 45−50.
[8]张亚莉, 于先进, 李小斌.氧化锌贫矿提锌渣中铅和银的氯盐一步浸出[J].中国有色金属学报, 2012, 22(1): 296−303.ZHANG Ya-li, YU Xian-jin, LI Xiao-bin.Leaching of silver and lead by chloride simultaneously from residue after zinc extraction of low-grade zinc oxide ores[J].The Chinese Journal of Nonferrous Metals, 2012, 22(1): 296−303.
[9]马荣骏.湿法冶金原理[M].北京: 冶金工业出版社, 2007:340−341.MA Rong-jun.Principle on hydrometallurgy[M].Beijing:Metallurgical Industry Press, 2007: 340−341.
[10]李洪桂.湿法冶金学[M].长沙: 中南大学出版社, 2002:15−168.LI Hong-gui.Hydrometallurgy[M].Changsha: Central South University Press, 2002: 15−168.
[11]李洪桂.冶金原理 [M].北京: 科学出版社, 2007: 151−186.LI Hong-gui.Metallurgical principle[M].Beijing: Science Press,2007: 151−186.
[12]牟望重, 张廷安, 吕国志, 古 岩, 豆志河.硫化锌氧化浸出过程的 φ-pH 图[J].中国有色金属学报, 2010, 20(8): 1636−1644.MU Wang-zhong, ZHANG Ting-an, LÜ Guo-zhi, GU Yan, DOU Zhi-he.φ-pH figure during oxidative pressure leaching of zinc sulfide[J].The Chinese Journal of Nonferrous Metals, 2010,20(8): 1636−1644.
[13]杨俊奎, 徐 斌, 杨大锦, 钟 宏, 姜 涛.复杂铜铅混合精矿氧压浸出综合回收工艺[J].昆明理工大学学报: 自然科学版, 2011, 36(2): 10−15.YANG Jun-kui, XU Bin, YANG Da-jin, ZHONG Hong, JIANG Tao.Oxygen pressure acid leaching synthetic reclaiming of complex Cu-Pb bulk concentrate[J].Journal of Kunming University of Science and Technology: Natural Science Edition,2011, 36(2): 10−15.
[14]LIU Wei-feng, YANG Tian-zu, XIA Xing.Behavior of silver and lead in selective chlorination leaching process of gold-antimony alloy[J].Transactions of Nonferrous Metals Society of China,2010, 20(2): 322−329.
[15]VIÑALS J, NUÑEZ C, CARRASCO J.Leaching of sold, silver and lead from plumbojarosite-containing hematite tailing in HCl-CaCl2 media [J].Hydrometallurgy.1991, 26 (2): 179−199.
[16]SAHU S K, SAHU K K, PANDEY B D.Leaching of zinc sulfide concentrate from the Ganesh-Himal deposit of Nepa[J].Metallurgical and Materials Transactions B, 2006(8): 541−549.
[17]LECLERC N, MEUX E, LECUIRE J-M.Hydrometallurgical extraction of zinc from zinc ferrites[J].Hydrometallurgy, 2003,70(1/3): 175−183.
[18]刘俊峰, 易平贵, 黄可龙.常压酸浸闪锌矿的条件对锌浸出率的影响[J].中国有色金属报, 2000, 10(5): 728−731.LIU Jun-feng, YI Ping-gui, HUANG Ke-long.Effects of conditions of soaking blend with sulfuric acid on rate of leaching zinc in oxygen at normal pressure[J].The Chinese Journal of Nonferrous Metals, 2000, 10(5): 728−731.

