有机添加剂对碱性条件下电镀铋的影响
欧青海,戴亚堂,张欢,马 丽,马 欢,申 振
(西南科技大学 四川省非金属复合与功能材料重点实验室−省部共建国家重点实验室培育基地,绵阳 621010)
近年来, 由于半导体铋拥有一系列的物理和化学性能引起了物理学家和化学家的兴趣。铋薄膜显示出高效载流、高效载体迁移能力[1]、高磁阻以及量子力学效应[2]和热电效应[3−7],可以用于量子阱、电流传感、应用软件程序材料以及电致变色材料[8−10]。由于其良好的分析性能和“环境友好”的特性,使用薄铋膜微电极替代水银−铅分析,在电化学分析领域很有吸引力的[11−19]。在不久的将来,铋纳米变形特性可以应用于焊接无铅纳米电子器件[20]。
在铋沉积的研究中,大部分研究者主要集中在超电势沉积铋或者铋成核和生长到非金属基体上,如碳[15,21]、碲、金、半导体[10,22−23]。同时,电沉积的研究与其他金属如铜、碲、银的酸性电解液研究相比,缺少有关有机添加剂的碱性水溶液电沉积铋的成核行为和生长机制的研究,特别是电沉积铋早期的电化学行为研究。
本文作者要探究有机添加剂在柠檬酸−乙二胺四乙酸盐的碱性水溶液对沉积铋到玻碳电极上的成核和生长机理的影响。电化学技术,如循环伏安法(CV)、计时电流法(CA)可以清晰地了解铋的成核和生长机理,有助于获得理想的铋膜[24];计时电流法(CA)测量的数据广泛用于Scharifker-Hills方程[25]提取动力学参数。同时, 电镀铋到铜基体上可通过扫描电镜观察镀层表面的微观形貌。
2 实验
2.1 电沉积试验
采用有机添加剂的碱性柠檬酸−乙二胺四乙酸的钠盐镀液体系,具体配方为:硝酸铋80 g/L,乙二胺四乙酸二钠100 g/L,柠檬酸80 g/L,氨基三亚甲基磷酸2 g/L。当乙二胺四乙酸二钠浓度过低时,Bi3+在碱性环境中会水解,因此,选择c(Bi(Ⅲ)):c(EDTA)=1:2,此时,Bi3+可以和乙二胺四乙酸二钠形成稳定的氨羧酸络合物[26]。采用不锈钢片作阳极,经热处理的光亮紫铜片为阴极。使用SMD−30P(河北大舜)型智能多组换向脉冲电镀电源进行电镀,电流密度为 2 A/dm2。电镀工艺流程为乙醇除油→蒸馏水洗涤→10%稀硫酸除氧化膜→蒸馏水洗涤→磷酸擦拭活化表面→电镀铋膜→蒸馏水洗涤→干燥。利用 S4440型(Leica Cambridge LTD)扫描电镜观察镀层的微观表面形貌。
2.2 电化学测试
本研究采用 AFCP1型电化学工作站(Pine Instrument Company)分别对镀液体系进行循环伏安及计时安培电流测试,研究铋沉积机理,探讨添加剂对铋沉积的影响。所有电化学测试都采用三电极体系,以玻碳电极为工作电极,以大面积光亮铂片为辅助电极,以232型饱和甘汞电极为参比电极,溶液温度控制在(25±1)℃。
3 结果与讨论
3.1 循环伏安
通过循环伏安法试验可以获得沉积铋的电势区域和沉积特征。图1(a)所示为有无有机添加剂时电沉积铋的循环伏安图。从图1(a)可以看出,存在有机添加剂时,沉积电位和电流密度明显增加,可能是有机添加剂的加入使Bi3+形成了更稳定的络合物,从而对Bi原子沉积的结构、粒度、孔隙度产生影响。图1(b)所示为存在有机添加剂时不同扫描速度下的循环伏安曲线。从图1(b)中可以看出,阴极只出现一个波峰,说明 Bi3+沉积是一步三电子还原的过程;同时,还可以看到随着扫描速度(v)的增加,还原峰的电流密度逐渐增大,还原电流峰的起峰电势向更负的方向移动,这可能是 Bi3+不能够满足快速的动力学成核需求造成的。对于可逆的电极反应过程,还原峰电势与扫描速度无关[27−28]。因此,图1的结果表明,电沉积铋的过程是不可逆的。
对于一个不可逆电化学反应体系,峰电位(Ep)和峰电流密度(jp)满足下列关系式[29]:

图1 有无添加剂及有添加剂时不同扫描速率下的循环伏安图Fig.1 Cyclic voltammograms for bismuth electrodeposition on glassy carbon electrode: (a)v=100 mV/s; (b)Bismuth electrodeposition with organic agent at various scan rates
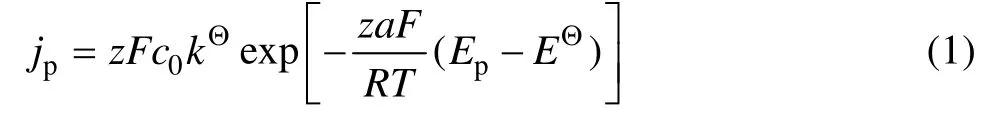
对式(1)取自然对数,变形可得:
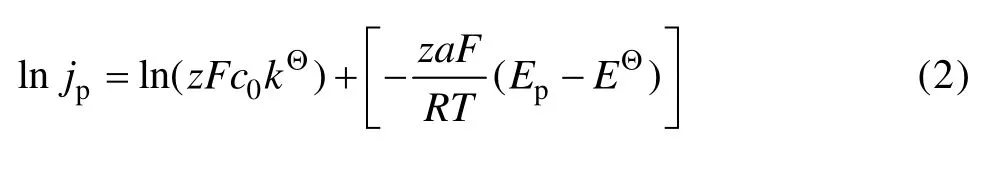
式中:z为为电子转移数;F为法拉第常数;c0为溶液的本体浓度;kΘ为反应速率常数;α为传递系数; R为摩尔气体常数;EΘ为标准电极电势;T为热力学温度。其中EΘ不随扫描速率变化而变化,因此,在不同扫描速率下,利用式(2)对ln| jp|—|Ep|作图(见图2中的插图),可以求出传递系数α的值约为0.027。
当电极反应的控制步骤为扩散控制时,不同扫描速度下循环伏安曲线的峰值电流密度 (jp)与扫描速度(v)存在以下关系[28]:
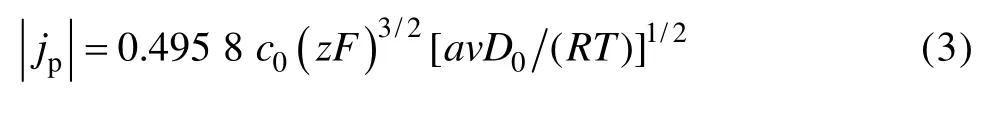
式中:D0为扩散系数。
运用式(3)可以对不同峰值电流密度和扫描速率的平方根(图1中的C点)作图,这个峰的峰值电流与相应的扫描速度的平方根的关系如图2所示。|jp|与v1/2呈良好的线性关系,其相关系数为0.991 4,拟合后成一条直线,可以求出扩散系数为 1.17×10−5cm2/s。因此,可以推断铋的电沉积是一个扩散控制的非可逆过程。
3.2 计时电流法
3.2.1 恒电位跃阶理论模型
新相形成的一般经历成核和成长两个过程,相应的瞬时电流变化可以为电沉积提供有用的动力学信息。在这个过程中,初期阶段的成核经历诱导吸附、原子吸附聚集成簇而形成临界晶核。电沉积过程成核主要利用Scharifker-Hill(SH)模型进行描述。在电沉积初始阶段,当吸附原子进入晶核的过程为速度控制时,Scharifker和 Hill假定在电极上随机分布的晶核为半球形,且在每个晶核周围逐渐扩展的扩展区内不能形成新晶核,并考虑到扩展区的重叠、晶核在扩散控制下长大,因此,可以推导出恒电位暂态三维立体成核的公式如下[25,29]:
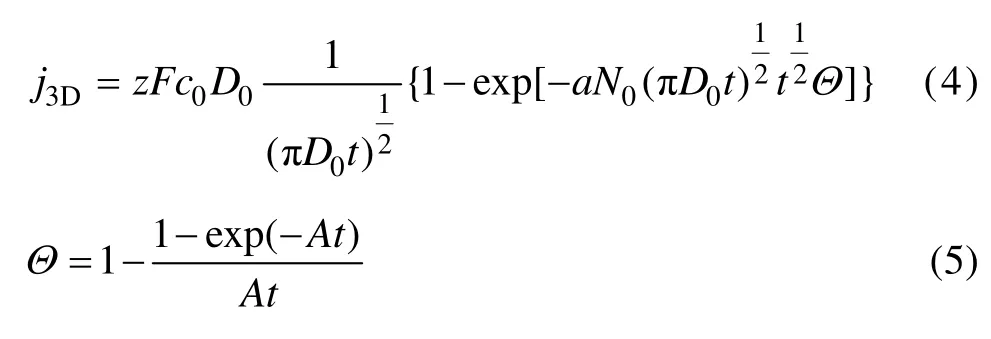

图2 jp与v1/2的关系图以及插图中的ln| jp|—|Ep|曲线Fig.2 Relationship between jp and v1/2 from reductive current peak (a)and ln| jp|—|Ep| curve (b)
式中:j3D为电流密度;N0为最大晶核数密度或表面活性位点数;A为成核速率常数;t为时间。
对于半球形扩散控制条件下的三维多核生长,由式(4)和(5)可以获得三维连续成核和瞬时成核理论模型来描述暂态下的电流密度增加和减小,为了便于描述这两种成核方式,将采用极端状态下的动力学成核,虽然溶液中一些金属离子的电结晶行为并不能完全适用于这两种极端情况[5],但在很多情况下该模型具有一定的适用性,如将这两种方式转化成无因次函数即(j/jm)2~ t/tm理论成核关系式:

式中:j为电流密度;jm为最大电流密度;tm为最大电流密度所对应的时间。式(7)描述连续成核,式(8)描述瞬时成核。
在恒电位阶跃分析中,电位从开路电位开始阶跃到金属的沉积电位,在这样的条件下,游离金属离子到电极表面为传质速度控制,体系从没有反应到形成稳态,可以利用Cottrell方程描述如下:

在电位阶跃的极短时间内,由于双电层充电导致电流密度先迅速增加随后减小,而后由于晶核的形成和新相的生长,电流再次逐渐增加并达到最大值,随后又出现衰减, 此时整个电极表面表现为扩散控制[30−32]。
3.2.2 电沉积铋的初期行为
不同阶跃电位下,碱性有机添加剂镀液中的铋电沉积成核和生长的恒电位曲线如图3所示。由图3可以看到,当电位低于−500 mV时,由于电极双电层充电导致与时间暂态曲线中电流密度有所增加;当电位高于−500 mV时,由于晶核的形成和新相的生长,才观察到电结晶形核/生长引起的电流密度逐渐增加;当电位高于−600 mV时,电流密度先呈指数式增加并达到最大值,然后出现对数式减小,最后达到平衡。随着阶跃电位的负移,即过电位增大,峰电流密度相应的增大,其对应的tm值(出现峰电流所需时间)呈规律性的缩短,说明过电位升高导致成核速率加快,成核诱导时间缩短。
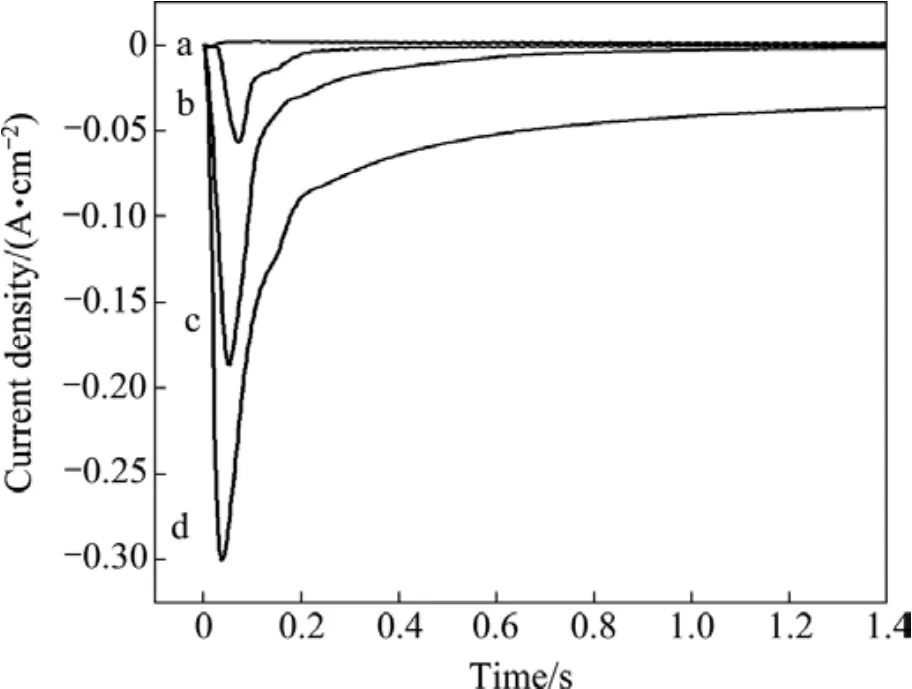
图3 不同电势下计时电流图Fig.3 Current transients for bismuth electrodeposition on glassy carbon electrode stepped from 0 mV to different potentials:(a)−500 mV; (b)−600 mV; (c)−700 mV; (d)−800 mV
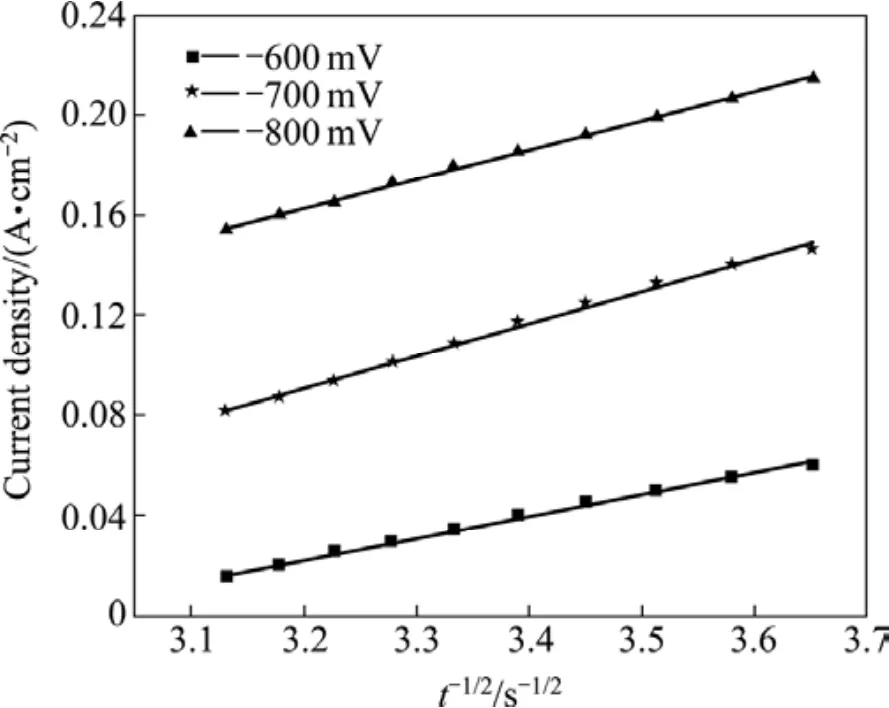
图4 Cottrell方程相对应的j—t−1/2关系图Fig.4 Relationship between j and t−1/2 from Cottrell equation
图4是由图3暂态曲线的上升部分所对应的j—t−1/2关系图。由图4可知,在较高的过电位下,j与 t−1/2呈线性关系,此时整个电极表面反应表现为扩散控制。由等式(9)的 Cottrell方程,可以求得在−600 ~ −800 mV的扩散系数分别为1.46×10−5、 1.52×10−5和1.67×10−5cm2/s。从所得结果来看,不同电势对扩散系数的影响较小,本研究得到扩散系数的平均值为1.55×10−5cm2/s。这与用式(3)求得的值(1.17×10−5cm2/s)比较接近。因此,循环伏安法和计时电流法都是适用于有机添加剂沉铋的动力学研究。
循环伏安曲线可以为计时电流的超电势沉积作指导,而Scharifker-Hill(SH)模型可以从定性上分析实验中暂态成核方式。图5所示为在超电势下的成核,实线和虚线分别表示理论上的三维连续成核和瞬时成核。图5(a)所示为在−800 mV超电压下有机添加剂对成核的影响。由图5(a)可以看出,镀液中不论是否存在有机添加剂,铋的电沉积机理都接近三维连续成核机理。结合循环伏安图可知,有机添加剂只改变了铋的沉积电势,不影响其电沉积机理。图5(b)所示为在不同超电势下铋的成核实验。从图5(b)可以看出,随着电势的升高,铋的电沉积机理更加接近三维连续成核,可能是随着阶跃电位的增大,电极表面由于铋的沉积而产生大量的活性点。这些活性点形成新的晶核,晶核在扩散控制下长大。另外,从图5(b)还可以看出,当t/tm小于1.2时,实验曲线与三维理论连续成核重合比较好,超过这段时间,实验曲线低于理论曲线,可能是体系自身存在轻微扰动[32]。
4 添加剂对铋镀层形貌的影响
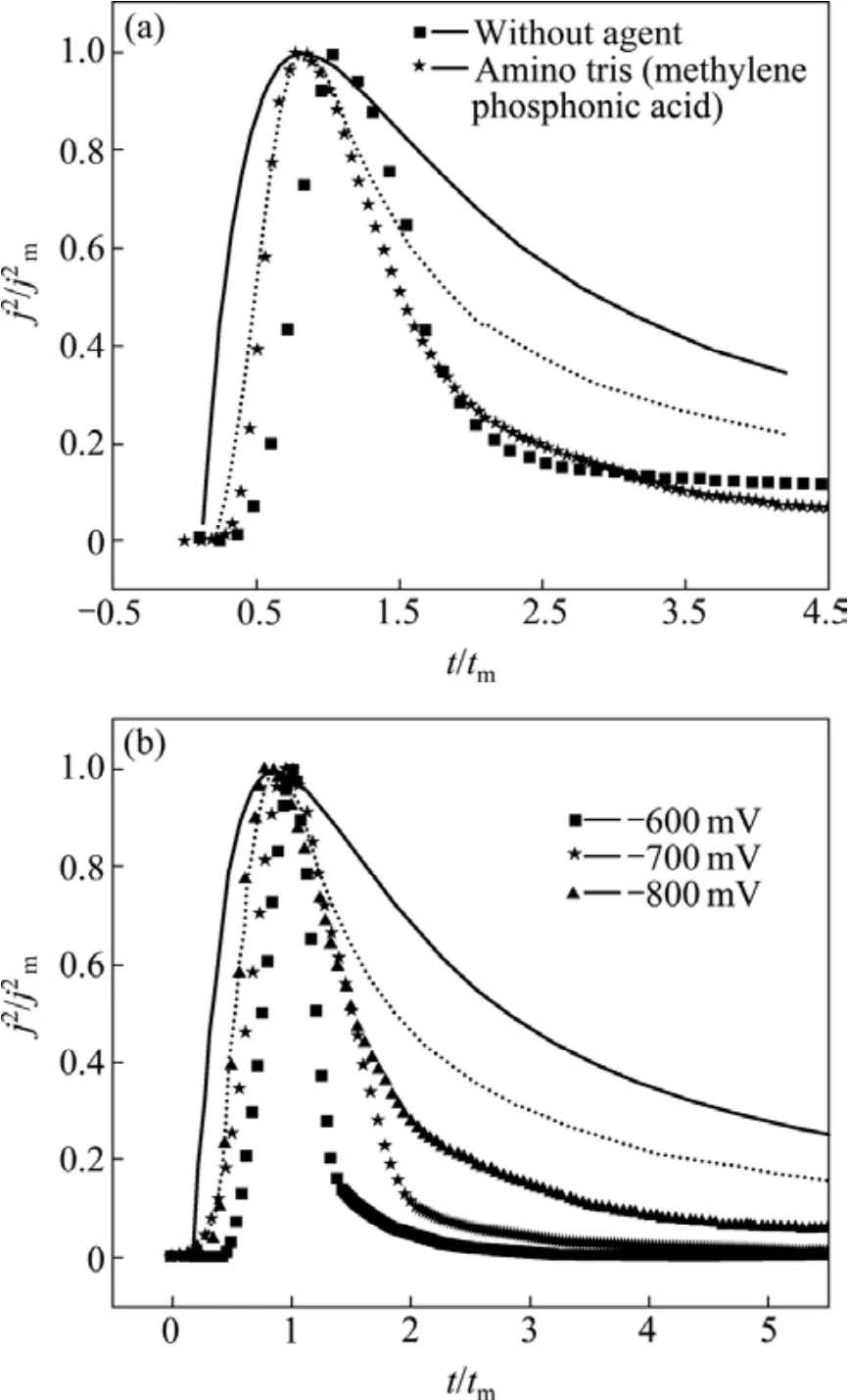
图5 电沉积铋过程的无因次j2/j2m—t/tm 曲线Fig.5 Non-dimensional j2/j2m—t/tm curves of data for bismuth electrodeposition on glassy carbon electrode: (a)With potential of −800mV (vs SCE); (b)Potential range from −600 mV to −800 mV (vs SCE).(Theoretical transients for instantaneous (solid line)and progressive (dotted line)nucleation were calculated according to Scharifker–Hills model.)
图6所示为镀液中加入有机添加剂前后制备的铋镀层的SEM像。如图6(a)所示,镀液中加入有机添加剂之前,所制备的铋镀层表面凹凸不平,较粗糙,晶粒大小约为10 μm,呈贝壳状,晶粒间有直径约5 μm左右的深沟,同时可以看出贝壳状晶核顶端生长有大量的小晶粒。因此,可认为此体系为连续成核机理,在铋的电沉积过程中,主要是不断长出新的晶粒覆盖在晶核顶端,而在晶粒的生长底部,三维扩散场所覆盖的电极表面因溶液的贫化和电场屏蔽很难形成新的晶核以至于镀层凹凸不平。如图6(b)所示,镀液中加入有机添加剂之后,由于有机添加剂具有良好的微观平整效应,所制备的铋镀层表面形貌明显改善,非常平滑,可能是由于氨基三亚甲基膦酸对Bi3+的螯合作用,限制了镀液中自由金属离子的浓度,减慢了金属离子的还原速度,从而细化镀层晶粒,提高了镀层表面致密度和光滑度。此时的铋镀层在放大5 000倍条件下已基本看不出单个晶粒。可见有机添加剂的加入对铋镀层表面形貌的改善十分显著。

图6 铋镀层的SEM像Fig.6 SEM images of Bi films: (a)Without organic agent; (b)With amino tris(methylene phosphonic acid)
5 结论
1)循环伏安法测试表明,铋沉积过程主要是受扩散控制的非可逆过程的影响。根据不同扫描速率可以求得Bi3+的扩散系数为1.17×10−5cm2/s。
2)电沉积初期行为分析表明,铋电结晶遵从扩散控制下的三维 Scharifker-Hill连续成核模型;随着过电位的增大,成核活性点增多,形核弛豫时间缩短;当电沉积趋于稳定,即阶跃电位大于−600 mV时,Bi3+的平均扩散系数约为1.55×10−5cm2/s,与循环伏安法测试出的扩散系数接近,说明这两种方法可用于有机添加剂沉积铋的动力学研究。
3)通过电沉积的方法,从碱性有机添加剂的柠檬酸—乙二胺四乙酸盐镀液体系中获得铋镀层。SEM观察表明,氨基三亚甲基膦酸的加入降低了镀液中自由金属离子的浓度,对铋的沉积具有一定的阻碍作用,使沉积电位增加,从而细化了镀层晶粒,使镀层表面更加的平整、致密。
[1]JIANG Shan, HUANG Yun-hui, LUO Feng, DU Nan, YAN Chun-hua.Synthesis of bismuth with various morphologies by electrodeposition[J].Inorganic Chemistry Communications,2003, 6(6): 781−785.
[2]CHO S, KIM Y, OLAFSENC L J, VURGAFTMANC I,FREEMAN A J, WONG G K L,.MEYER J R, HOFFMAN C A,KETTERSON J B.Large magnetoresistance in post-annealed polycrystalline and epitaxial Bi thin films[J].Journal of Magnetism and Magnetic Materials, 2002, 239(1/3): 201−203.
[3]ZIEGLER J P.Status of reversible electrodeposition electrochromic devices[J].Solar Energy Materials & Solar Cells,1999, 56(3/4): 477−493.
[4]CÓRDOBA DE TORRESI S I, CARLOS I A.Optical characterization of bismuth reversible electrodeposition[J].Journal of Electroanalytical Chemistry, 1996, 414(1): 11−16.
[5]RICHOUX V, DILIBERTO S, BOULANGER C, LECUIRE J M.Pulsed electrodeposition of bismuth telluride films: Influence of pulse parameters over nucleation and morphology[J].Electrochimica Acta, 2007, 52(9): 3053−3060.
[6]LI Liang, ZHANG Yong, LI Guang-hai, ZHANG Li-de.A route to fabricate single crystalline bismuth nanowire arrays with different diameters[J].Chemical Physics Letters, 2003, 378(3/4):244−249.
[7]LI Liang, YANG You-wen, FANG Xiao-sheng, KONG Ming-guang, LI Guang-hai, ZHANG Li-de.Diameter-dependent electrical transport properties of bismuth nanowire arrays[J].Solid State Communications, 2007, 141(9): 492−496.
[8]GOLIA S, ARORA M, SHARMA R K, RASTOGI A C.Electrochemically deposited bismuth telluride thin films[J].Current Applied Physics, 2003, 3(2/3): 195−197.
[9]XIAO Feng, HANGGARTERA C, YOOB B, RHEEMA Y,LEECK K-H, MYUNG N V.Recent progress in electrodeposition of thermoelectric thin films and nanostructures[J]. Electrochimica Acta, 2008, 53(28):8103−8117.
[10]SANDNES E, WILLIAMS M E, BERTOCCI U, VANUDIN M D, STAFFORD G R.Electrodeposition of bismuth from nitric acid electrolyte[J].Electrochimica Acta, 2007, 52 (21): 6221−6228.
[11]ARDUINI F, CALYO J Q, AMINE A, PALLESCHI G,MOSCONE D.Bismuth-modified electrodes for lead detection[J].Trends in Analytical Chemistry, 2010, 29(11):1259−1304.
[12]REHACEK V, HOTOVY I, VOJS M.Bismuth-coated diamond-like carbon microelectrodes for heavy metals determination[J].Sensors and Actuators B, 2007, 127(1):193−197.
[13]HUTTON E A, OGOREVC B, HOCEVAR S B, WELDON F,SMYTH M R, WANG J. An introduction to bismuth electrode for use in cathodic electrochemical detection[J].Electrochimistry Communication, 2001, 3 (12): 707−711.
[14]WANG Joseph, LU Jian-min.Bismuth film electrodes for adsorptive stripping voltammetry of trace nickel [J].Electrochimistry Communication, 2000, 2 (6): 390−393.
[15]KRÓLICKA A, R.PAULIUKAITË, ŠVANCANCARAC I,METELKA R, BOBROWSKI A, NORKUS E, KALCHER K,VYTRAS K.Bismuth-film-plated carbon paste electrodes[J].Electrochimistry Communication, 2002, 4(2): 193−196.
[16]HUTTON E A, HOCEVAR S B, OGOREVC B, SMYTH M R.Bismuth film electrode for simultaneous adsorptive stripping analysis of trace cobalt and nickel using constant current chronopotentiometric and voltammetric protocol[J].Electrochimistry Communication, 2003, 5(9): 765−769.
[17]KEFALA G, ECONOMOU A, VOULGAROPOULOS A,SOFONIOU M.A study of bismuth-film electrodes for the detection of trace metals by anodic stripping voltammetry and their application to the determination of Pb and Zn in tapwater and human hair[J].Talanta, 2003, 61(4): 603−610.
[18]KRRÓLICKA A, BOBROWSKI A.Bismuth film electrode for adsorptive stripping voltammetry–electrochemical and microscopic study[J].Electrochimistry Communication, 2004,6(2): 99−104.
[19]HUTTON E A, VAN ELTEREN J T, OGOREV B, SMYTH M R.Validation of bismuth film electrode for determination of cobalt and cadmium in soil extracts using ICP-MS[J].Talanta, 2004,63(4): 849−855.
[20]BUREK M J, JIN S, LEUNG M C, JAHED Z, WU J,BUDIMAN A S, TAMURA N, KUNZ M, TSUI T Y.Grain boundary effects on the mechanical properties of bismuth nanostructures[J].Acta Materialia, 2011, 59(11): 4709−4718.
[21]YANG Min-li, HU Zhong-bo.Electrodeposition of bismuth onto glassy carbon electrodes from nitrate solutions[J].Journal of Electroanalytical Chemistry, 2005, 583(1): 46−55.
[22]OSIOVICH N P, STRELTSOY E A, SUSHA A S.Bismuth underpotential deposition on tellurium[J].Electrochimistry Communication, 2000, 2: 822−826.
[23]JEFFREY C A, HARRINGTON D A, MORIN S.In situ scanning tunneling microscopy of bismuth electrodeposition on Au(111)surfaces[J].Surface Science, 2002, 512(1/2):L367−L372.
[24]SADALE S B, PATIL P S.Nucleation and growth of bismuth thin films onto fluorine-doped tin oxide-coated conducting glass substrates from nitrate solutions[J].Solid State Ionics, 2004, 167(3/4): 273−283.
[25]SCHARIFKER B R, HILLS G.Theoretical and experimental studied of multiple fucleation[J].Electrochimica Acta, 1983, 28(7): 879−889.
[26]SOTO A B, ARCE E M, PALOMAR-PARDAVÉ M,GONZÁLEZ I.Electrochemical nucleation of cobalt onto glassy carbon electrode[J].Electrochimica Acta, 1996, 41(16):2647−2655.
[27]DOLATI A, AFSHAR A, GHASEMI H.A kinetic study on the electrodeposition of cadmium with the presence of organic agents in sulfate solutions[J].Materials Chemistry and Physics,2005, 94(1): 23−28.
[28]CHEN Zeng, ZHANG Mi-lin, HAN Wei, HOU Zhi-yao, YAN Yong-de.Electrodeposition of Li and electrochemical formation of Mg-Li alloys from the eutectic LiCl–KCl[J].Journal of Alloys and Compounds, 2008, 464(1/2): 174−178
[29]EMERY S B, HUBBLEY J L, ROY D.Voltammetric and amperometric analyses of electrochemical nucleation:electrodeposition of copper on nickel and tantalum [J].Journal of Electroanalytical Chemistry, 2004, 568: 121−133.
[30]赵旭山, 谭澄宇, 陈文敬, 刘 宇, 李劲风, 郑子樵.Ni-SiC复合镀层电结晶初期动力学分析[J].中国有色金属学报,2008, 18(5): 823−828.ZHAO Xu-shan, TAN Cheng-yu, CHEN Wen-jing, LIU Yu, LI Jin-feng, ZHENG Zi-qiao.Nucleation kinetics analysis of Ni-SiC composite film during early electrocrystallization processes[J].The Chinese Journal of Nonferrous Metals, 2008,18(5): 823−828.
[31]胡 炜, 谭澄宇, 崔 航, 郑子樵.Sn-Cu合金的电沉积行为及添加剂的影响[J].中国有色金属学报, 2010, 20(5):1006−1011.HU Wei, TAN Cheng-yu, CUI Hang, ZHENG Zi-qiao,Electrodeposition behavior of Sn-Cu alloy and effect of additives on deposition process[J].The Chinese Journal of Nonferrous Metals, 2010, 20(5): 1006−1011.
[32]GRUBAČ Z, METILOŠ-HUKOVIĆ M.Electrodeposition of thin sulfide films: nucleation and growth observed for Bi2S3[J].Thin Solid Films, 2002, 413(1/2): 248−256.

