响应曲面法优化酸奶中嗜热链球菌H1的生长条件
王玉芹, 周 晶, 沙未来
(曲阜师范大学 生命科学学院, 山东 曲阜 273165)
乳酸菌是一类能利用可发酵的糖产生大量乳酸的细菌,广泛分布于土壤、植物根茎、湖泊及以动物体内.从形态上可分为球菌和杆菌,为兼性厌氧性细菌,革兰氏染色为阳性[1].
早在20世纪20年代初国外就开始益生菌的研究,目前对于嗜热链球菌的研究主要集中于保健作用,抗菌作用,与保加利亚杆菌的共生作用,以及其对酸奶风味、感官品质、凝乳时间的影响等领域[2].
现阶段我国酸奶发酵剂的制备技术大都停留在传统的人工型发酵剂水平,包括菌种活化、母发酵剂、中间发酵剂、生产发酵剂等工艺过程,存在活菌含量低、接种量大、生产工序多、劳动强度大、无菌技术要求高、菌种极易污染和退化等弊端[3-5].本研究者采用单因素试验和响应曲面法对酸奶中嗜热链球菌H1在不同温度、pH、接种量及盐浓度条件下嗜热乳酸链球菌的生长情况进行了研究,获得了该菌的最佳培养条件,以期为实际应用中嗜热乳酸链球菌的保存和继代提供参考.
1 材料与方法
1.1 材料
1.1.1 菌种
嗜热链球菌H1,曲阜师范大学微生物实验室保存.
1.1.2 培养基
M17改良培养基[6]:蛋白胨质量分数1%,牛肉膏0.5%,酵母浸膏0.25%,硫酸镁0.025%,甘油1%,磷酸二氢钾0.5%,乳糖0.3%.蛋白胨购自广州威佳科技有限公司,其它均为国产分析纯试剂.
1.2 实验方法
1.2.1 单因素实验
在50mL 的M17液体培养基中接种嗜热链球菌H1,分别放入25℃,33℃,37℃,42℃,45℃的恒温摇床中培养24 h确定最佳培养温度.在pH为5.5,6.5,7.0,7.5,8.5条件下,放置到恒温摇床中培养24h确定佳的培养pH.在50mL的M17液体培养基中,分别接种菌液0.1 ml,0.2 ml,0.3 ml,0.4 ml,0.5 ml,培养24 h确定其最佳培养接种量.将菌株H1的24h的培养物于2000r/min离心10min,培养基盐浓度(质量浓度,单位g/L)为0.2%、0.3%、0.4%、0.5%、0.6%,培养24 h确定其最佳盐浓度.每组均设置3个平行样,最后结果取三者平均值,以确定最佳培养条件.
1.2.2 响应曲面实验设计[7-11]
基于单因素试验,考察M17液体培养基的温度、pH、接种量、盐浓度对嗜热链球菌H1的影响.将这4个因素作为响应变量,利用Design-Expert 7.1.6软件的中心旋转实验设计(Central Composite Design)原理,以嗜热链球菌H1在600nm下的吸光度为响应值(OD),通过响应面曲面分析得到最优生长条件,并进行实验验证.
2 结果与分析
2.1 单因素实验结果
2.1.1 嗜热链球菌H1在不同培养温度下的生长状况
温度对嗜热乳酸链球菌H1生长的影响见图1.结果表明,嗜热乳酸链球菌H1在25~45℃范围内均能生长,温度对H1的影响相对较小,无明显的上升下降趋势,总的生长活性在42℃时嗜热链球菌H1达最高.

图1 温度对嗜热乳酸链球菌的影响
2.1.2 嗜热链球菌H1在不同酸碱度条件下的生长状况
pH对嗜热乳酸链球菌H1生长的影响见图2.结果表明,嗜热乳酸链球菌H1的pH值适宜生长范围较广,受pH值的影响较小,弱酸和弱碱均能有利于H1的生长,在pH为6.5~7.5时有较高活性.

图2 pH值对嗜热乳酸链球菌的影响
2.1.3 嗜热链球菌H1在不同接种量条件下的生长状况
接种量对嗜热乳酸链球菌H1生长的影响见图3,结果表明,该菌在接种量为0.1 mL~0.5 mL的条件下均能生长,上升下降的幅度不是很大,接种量为0.3mL时嗜热乳酸链球菌H1的生长状况最好.

图3 接种量对嗜热乳酸链球菌H1的影响
2.1.4 盐浓度对嗜热链球菌H1的影响
盐浓度对嗜热乳酸链球菌H1生长的影响见图4,结果表明,盐浓度在0.2%时,菌株生长较好,随着盐浓度的升高,菌株的生长受到抑制.

图4 盐浓度对嗜热链球菌H1的影响
2.2 生长条件优化
2.2.1 响应曲面实验设计
基于单因素实验结果, 该阶段的实验采用中心旋转实验设计(Central Composite Design)来对嗜热链球菌H1培养条件的主要影响因子进行研究,确定其最佳培养条件.各实验组的编码与取值见表1.共30个实验点,其中24个为析因点,6个为零点.零点实验进行6 次,做误差估计.
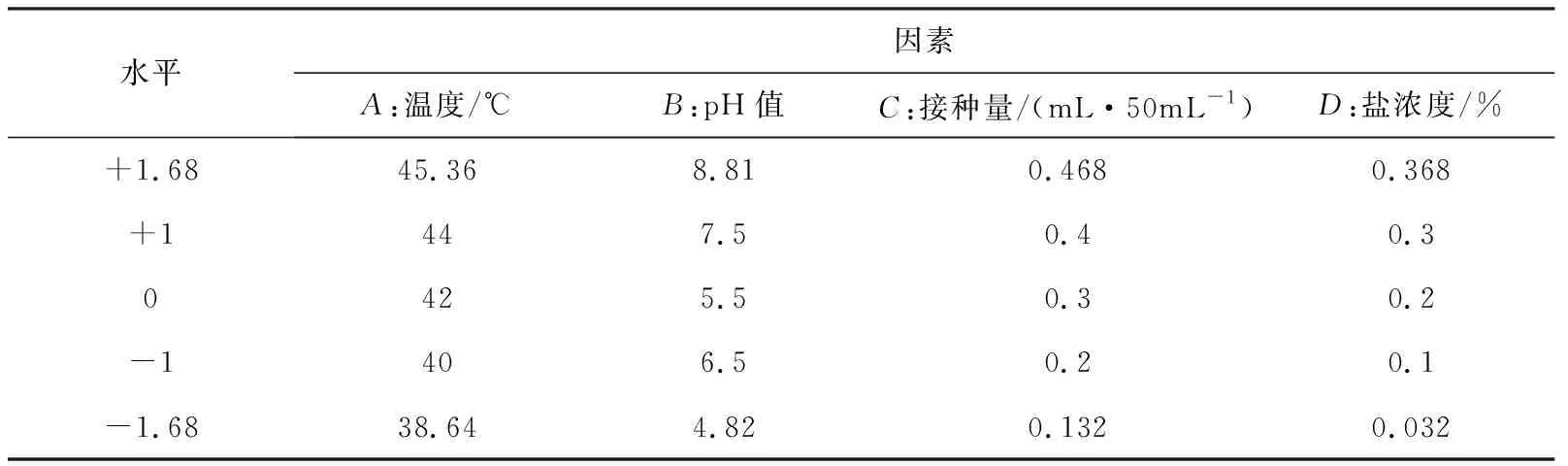
表1 响应面分析因素与水平表
运用Design-Expert 数据统计分析软件,得到实验方案与结果,见表2.通过对表2 数据进行二次多项式拟合得到响应值与各因子的多元回归方程为:OD=-24.88+1.32A-0.76B+2.66C+11.98D+0.03AB+0.04AC-0.25AD-0.14BC+0.25BD+1.26CD-0.02A2-0.005B2-5.79C2-6.05D2
该模型进行回归分析,方差分析结果见表3.

表2 旋转中心组合实验设计方案和结果
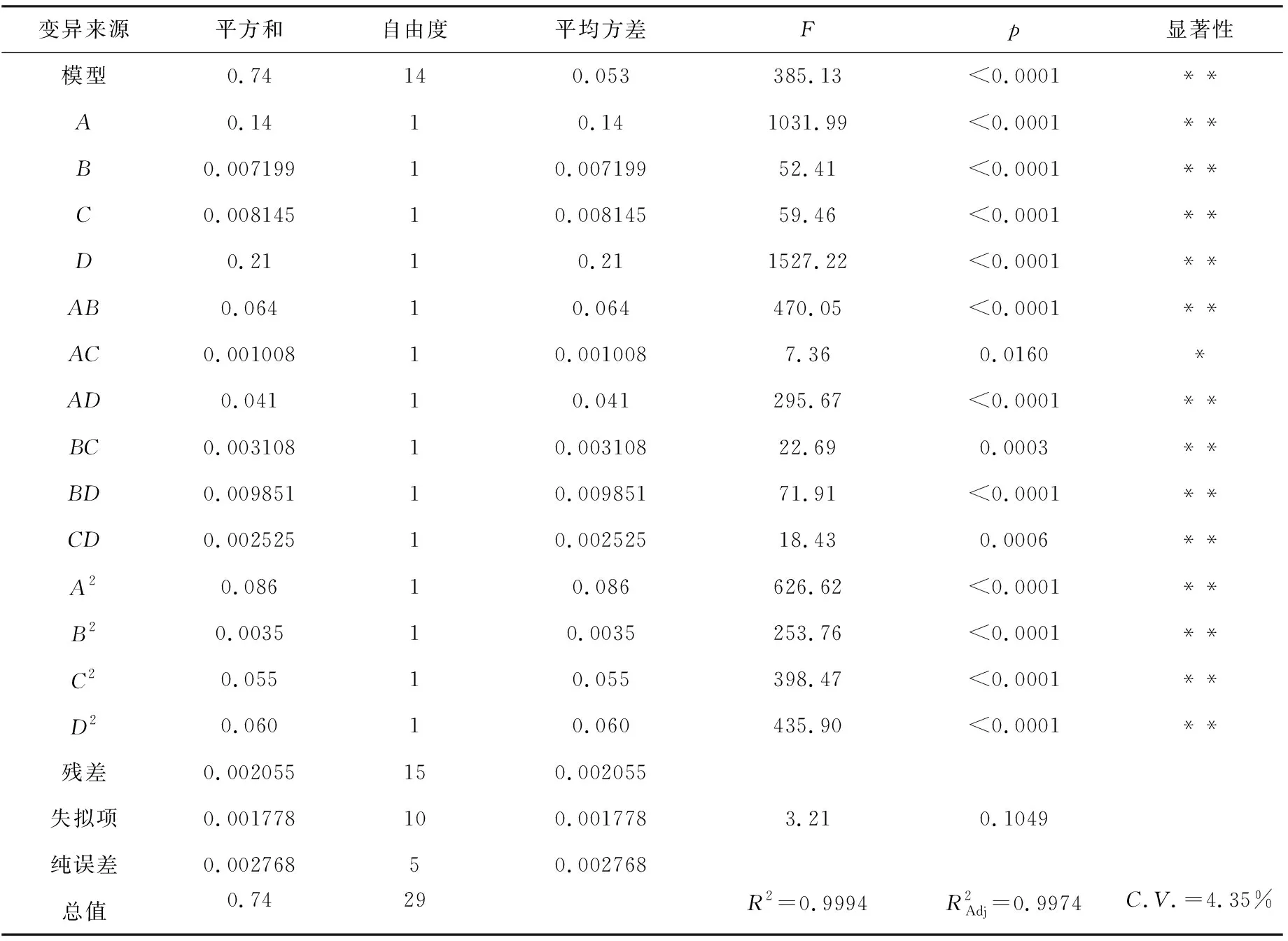
表3 响应面回归模型方差分析表
2.2.2 响应面分析
根据回归方程,采用Design Expert 软件对该模型绘制响应曲面图,得到响应曲面图及其等高线.见图5~10.
由图5可知,当温度不变,随着pH的升高,OD值先升高后降低,当pH不变,随着温度的升高,OD值先升高后降低,该图中OD可取到最大值.等高线为椭圆形,说明温度和pH的交互作用显著.这与模型的方差分析结果一致.
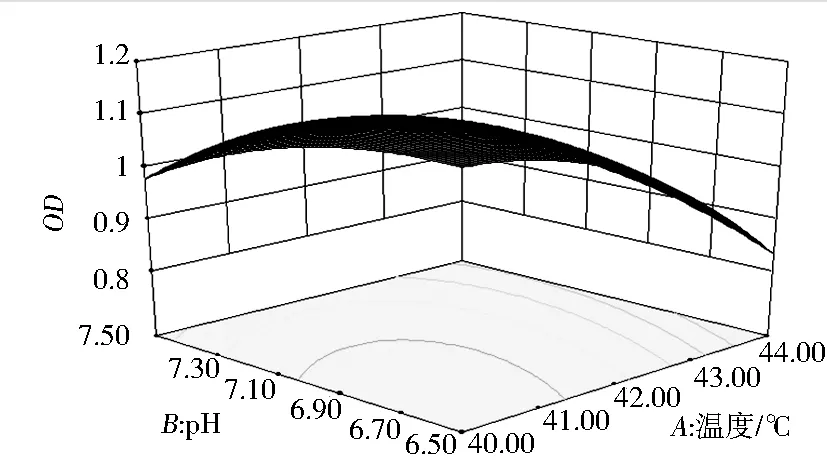
图5 温度和pH交互影响嗜热链球菌H1生长的响应曲面图及其等高线
由图6可知,当温度不变,随着接种量的升高,OD值先升高后降低,当接种量不变,随着温度的升高,OD值先升高后降低,该图中OD可取到最大值.等高线为椭圆形,说明温度
和接种量的交互作用显著.这与模型的方差分析结果一致.

图6 温度和接种量交互影响嗜热链球菌H1生长的响应曲面图及其等高线
由图7可知,当温度不变,随着盐浓度的升高,OD值呈增加趋势,当盐浓度不变,随着温度的升高,OD值呈下降趋势.说明该图体现不出温度与盐浓度交互影响嗜热链球菌H1生长最佳条件.但等高线为椭圆形,说明温度和盐浓度的交互作用显著,但不如其他因子之间的交互作用明显,这与模型的方差分析结果一致.
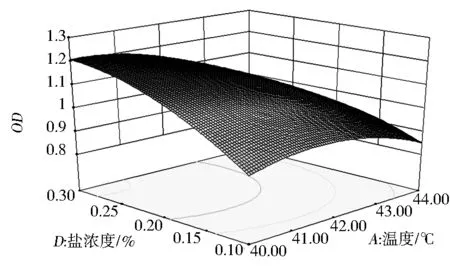
图7 温度和盐浓度交互影响嗜热链球菌H1生长的响应曲面图及其等高线
由图8可知,当pH不变,随着接种量的升高,OD值先升高后降低,当接种量不变,随着pH的升高,OD值先升高后降低,该图中OD可取到最大值.等高线为椭圆形,说明温度和接种量的交互作用显著.这与模型的方差分析结果一致.

图8 pH和接种量交互影响嗜热链球菌H1生长的响应曲面图及其等高线
由图9可知,当pH不变,随着盐浓度的升高,OD值先升高后降低,当盐浓度不变,随着PH的升高,OD值先升高后降低,该图中OD可取到最大值.等高线为椭圆形,说明温度和接种量的交互作用显著.这与模型的方差分析结果一致.

图9 pH和盐浓度交互影响嗜热链球菌H1生长的响应曲面图及其等高线
由图10可知,当接种量不变,随着盐浓度的升高,OD值先升高后降低,当盐浓度不变,随着接种量的升高,OD值先升高后降低,该图中OD可取到最大值.等高线为椭圆形,说明接种量和盐浓度的交互作用显著.这与模型的方差分析结果一致.

图10 接种量和盐浓度交互影响嗜热链球菌H1生长的响应曲面图及其等高线
利用Design-Expert 软件进行实验结果优化,得到优化结果为:当温度41.02℃,pH5.74,接种量0.31mL/mL,盐浓度0.23%时,OD有最大值,为1.176.
2.2.3 实验结果验证
对上面得到的预测值进行重复验证实验,实验结果为1.162,其相对误差<2%,证明应用响应曲面优化嗜热链球菌H1生长条件是极其可靠的.
3 结果与讨论
从酸奶中分离得到的,通过单因素实验研究温度、pH、接种量和盐浓度对生长条件的影响.再利用Design -Expert 设计软件,采用旋转中心组合实验设计法建立优化嗜热链球菌H1最适生长条件的数学模型,根据回归分析得到最适生长条件是:温度41.02℃,pH5.74,接种量0.31mL/mL,盐浓度为0.23%,嗜热链球菌H1的光密度达最大为1.176.
从生长温度条件可知,该菌的最适生长温度41.02℃要比37℃偏高,但益生菌株在菌液浓缩或制作膨化、颗粒料时,都要进行加热处理,且在45℃可以检测到活菌,说明该菌可用于工业化生产.由于动物消化道中存在胃酸,能够抵抗较强的酸性环境益生菌能在肠道中存活和正常发挥作用的先决条件[12],该菌的最适pH为5.74,且在pH为2.5时仍可检测到活菌,为该菌的工业化生产提供了可靠的依据.
[1] 彭磊,司红丽.酸奶中嗜热链球菌初步分离与鉴定[J].现代农业科技,2011(15):359-360.
[2] 郜洪涛,吕嘉枥,闫肃,等.嗜热链球菌对酸奶发酵的影响及应用前景[J].中国酿造,2010,11(11):5-8.
[3] 佟潇.酸奶中嗜热链球菌的分离和鉴定[J].中国乳品工业,2004,32(3):25-27.
[4] 张和平.中国益生乳酸菌及益生发酵乳研究开发现状及发展对策[J].乳业科学与技术,2009,32(2):51-54.
[5] 赵红霞,詹勇,许梓荣. 乳酸菌的研究及其应用[J]. 江西饲料,2003(1):9-12.
[6] 白建,黄素珍.纯牛奶中抗菌药物残留的检测[J].乳业科学与技术,2006,28(1):15-17.
[7] 杨平,曹文涛,张建宇,等.响应曲面法优化红汁乳菇发酵条件[J].江西食品工业,2008,186(2):28-31.
[8]丁明亮,欧阳安然,王望斐,等.枯草芽孢杆菌产凝乳酶发酵条件的优化[J].食品科学,2011,32(3):156-160.
[9] 于艳琴,李璘佼,车振明.响应面法优化腐乳生产中的培菌条件[J].中国食品学报,2010,10(5):183-188.
[10] 郭端强,姬晓娜,管丽冰,等.响应面法优化好氧反硝化细菌N22′的发酵条件[J] .中国酿造,2013,32(1):53-56.
[11] Manohar B, Divakar S. Applications of surface plots and statistical designs to selected lipase catalysed esterification reactions[J].Process Biochemistry,2004,39(7):847-853.
[12] Gilliland S E.Health and nutritional benefits from lactic acid bacteria[J]. FEMS.Microbiology Reviews,1990,7(1/2):175-188.

