外源SNP对低温下马铃薯试管苗相关酶活性的影响
吴雁斌,王一航,胡新元,文国宏,李高峰,郑永伟,张 荣,李建武,阎耀廷
(1.甘肃省农业科学院马铃薯研究所,甘肃 兰州 730070;2.甘肃省庆阳市农业技术推广中心,甘肃庆阳 745000)
低温会诱导植物小分子抗性物质的积累和抗氧化酶类活化,最终缓解低温胁迫造成的机械和生理伤害,锻炼植物抗性[1]。氧化还原信号分子一氧化氮(NO)参与植物生理代谢过程,并对诸如植物的呼吸作用、光形态建成、种子萌发、根和叶片的生长发育、果实等植物组织的成熟和衰老、胁迫响应、逆境诱发的细胞程序性死亡等生理过程具有调节作用,是一种重要的第二信使[2~3]。适当浓度的一氧化氮可通过反馈调节植物体内的硝酸还原酶(NR)活性调节植物氮代谢产物,降低膜脂过氧化作用,和细胞中活性氧自由基,减缓衰老,提高植物对环境的适应能力[4~5]。低浓度的一氧化氮供体硝普钠(SNP)可以促进植物的生长,但高浓度的SNP却会产生毒害,严重时造成植株死亡[6]。基于以上原因,我们以甘肃省马铃薯主栽品种陇薯3号、陇薯6号脱毒试管苗为研究对象,测定了SNP对低温胁迫下马铃薯试管苗的相关生理指标的影响,以期为解决马铃薯生产中遇到的低温胁迫问题提供理论依据和方法。
1 材料与方法
1.1 试验材料
NO供体硝普钠(SNP)为Sigma公司生产。先用ddH2O配制成100mmol/L的母液,4℃下保存,用时按照需要进行稀释。陇薯3号、陇薯6号试管苗由甘肃省农业科学院马铃薯研究所提供。
1.2 试验方法
根据已有的方法建立供试马铃薯试管苗扩繁体系[7]。基础培养基为MS培养基,SNP浓度梯度为0(CK)、0.05、0.10mmol/L。在无菌条件下,分别将生长25 d的陇薯3号、陇薯6号脱毒试管苗接种于培养基中,各SNP浓度处理下每品种1瓶,3次重复。接种后置于光照培养箱内(温度4℃,光照2 500 Lx、24 h/d) 培养,株高4 cm后开始测定相关生理指标,每隔7 d测定1次,共测定5次。
1.3 测定方法
1.3.1 酶液的制备 取0.2 g新鲜马铃薯组培苗组织,加少许石英砂和5mL预冷酶提取液(用pH 7.8的磷酸缓冲液配制,含EDTA 5 mmol/L、AsA 2 mmol/L、PVP 2%)于冰浴研钵中,迅速匀浆后在4℃、4 000 r/min下离心15min,取上清液待用。
1.3.2 抗氧化酶活性的测定 POD活性采用0.3%愈创木酚法测定[8];SOD活性采用NBT光还原法测定,以抑制氮蓝四唑(NBT)在光照下被还原到50%的酶量为1个酶活性单位(U)[9];CAT活性采用240 nm比色法测定[9]。
1.4 数据分析
用DPS软件进行数据分析,以Excel软件绘制图表。
2 结果分析
2.1 外源SNP处理对低温下陇薯3号试管苗SOD、POD、CAT活性的影响
SOD是需氧生物细胞中普遍存在的一类金属酶,它能催化O2-发生歧化反应生成O2和H2O2;CAT与POD是清除H2O2过程的关键性酶,其中POD是植物体中的重要叶绿体保护酶,叶绿体POD作用于米勒反应中产生的H2O2,而CAT主要清除光呼吸产生的H2O2。低温可使植物体内活性氧逐步累积并超过伤害阀值,提高植物清除活性氧的能力可减轻低温伤害[10]。试验结果显示,在4℃低温条件下,在MS培养基中添加0.05、0.10mmol/LSNP处理的陇薯3号试管苗均未出现死亡现象。
由表1可见,在4℃低温条件下,在MS培养基中分别添加0.05、0.10mmol/LSNP后,陇薯3号试管苗的SOD活性除第5次测定值明显低于同期不添加SNP处理(CK)外,其余4次测定值均高于同期对照,且添加0.05mmol/LSNP处理的5次测定值均高于同期添加0.10mmol/LSNP处理。POD活性除添加0.10mmol/LSNP处理第2次的测定值稍低于同期对照外,其余测定值均高于同期对照,且添加0.05 mmol/LSNP处理的5次测定值均高于同期添加0.10 mmol/LSNP处理。CAT活性添加0.05mmol/LSNP处理、0.10mmol/LSNP处理的5次测定值均高于同期对照,其中添加0.05mmol/LSNP处理的第1次测定值高于添加0.10mmol/LSNP处理,其余4次测定值均低于同期添加0.10mmol/LSNP处理。
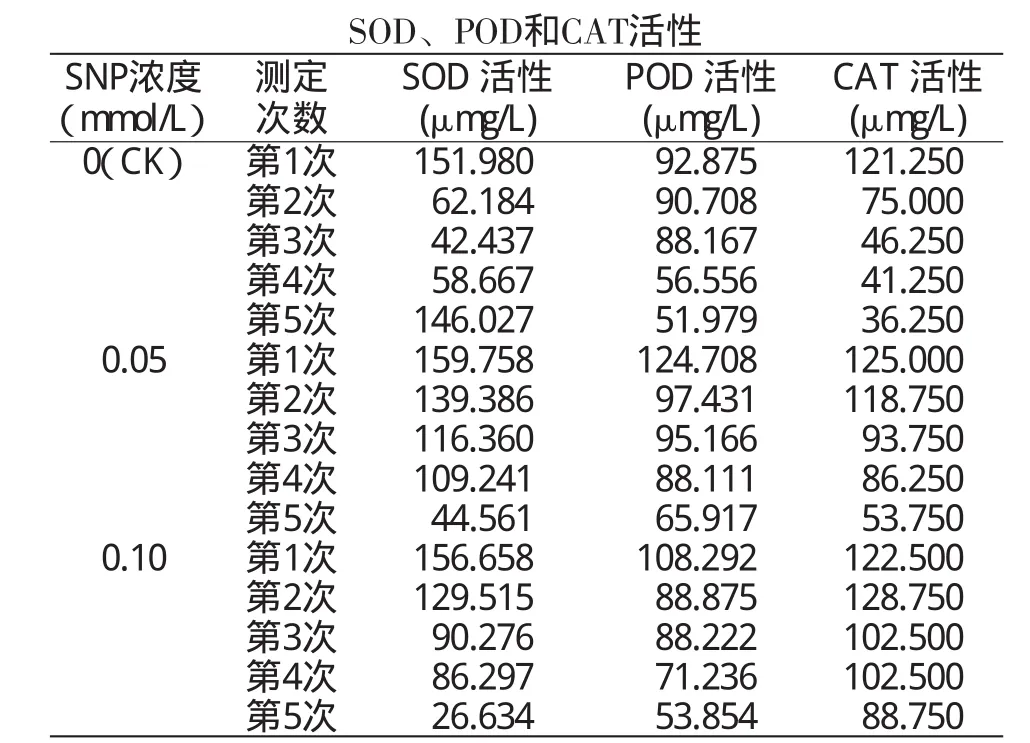
表1 低温下不同浓度SNP处理的陇薯3号试管苗
2.2 外源SNP处理对低温下陇薯6号试管苗SOD、POD、CAT活性的影响
试验结果(表2)显示,在4℃低温条件下,在MS培养基中添加0.05、0.10mmol/LSNP处理的陇薯6号试管苗均未出现死亡现象。由表2可见,在4℃低温条件下,在MS培养基中分别添加0.05、0.10 mmol/L SNP后,陇薯6号试管苗的SOD活性添加0.05mmol/LSNP处理的5次测定值均高于同期不添加SNP处理(CK),添加0.10mmol/LSNP处理的5次测定值均低于同期对照。POD活性除添加0.05 mmol/LSNP处理的第5次测定值低于同期对照外,其余测定值均高于同期对照,且添加0.05mmol/L SNP处理除第5次测定值低于同期添加0.10mmol/L SNP处理外,其余4次均高于同期添加0.10mmol/L SNP处理。CAT活性添加0.05 mmol/LSNP处理、0.10mmol/LSNP处理的5次测定值均高于同期对照,且添加0.05mmol/LSNP处理除第5次测定值与同期添加0.10mmol/LSNP处理相等外,其余4次均高于同期添加0.10mmol/LSNP处理。
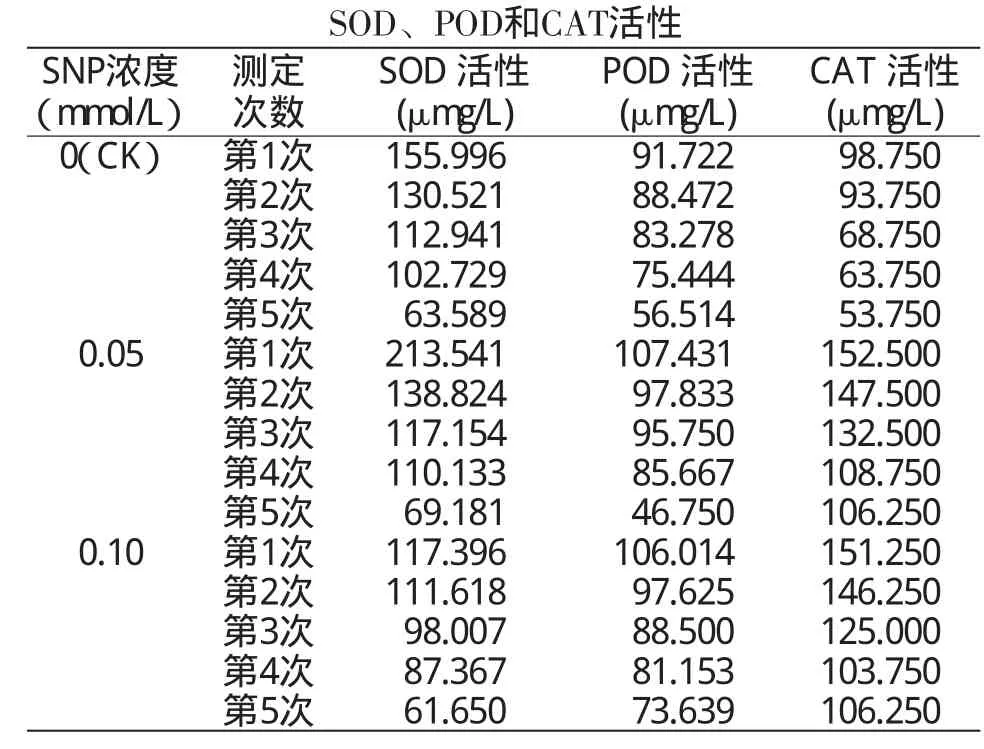
表2 低温下不同浓度SNP处理的陇薯6号试管苗
3 小结与讨论
1) 在4℃低温条件下,在MS培养基中分别添加0.05、0.10mmol/LSNP后,陇薯3号、陇薯6号试管苗的SOD、POD、CAT活性均有所提高,即低温胁迫对马铃薯试管苗细胞的氧化损伤度减轻,细胞修复速度加快。SNP浓度以0.05mmol/L最佳。
2)已有的试验表明,SNP处理可减轻低温胁迫对黑麦草(Lolium perenne)细胞的氧化损伤度,加快细胞修复[11],本试验结果与此相符。在本试验设计范围内,0.05mmol/LSNP对缓解马铃薯试管苗遭受低温胁迫的效果较佳,但此结论还需要进一步研究,以便深入了解SNP缓解低温胁迫的根本原因。
[1] 曾乃燕,何军贤,赵 文,等.低温胁迫期间水稻光合膜色素与蛋白水平的变化[J].西北植物学报,2000,20(l):8-14.
[2] BELIGNIM V,LAMATTINA L.Nitric oxide stimulates seed germination and de-etiolation,and inhibitshypocotyls elongation,three light-inducible responses in plants[J].Planta,2000,210(2):215-222.
[3] CHUNG H T,PAE H O,CHOIB M,et al.Nitric oxide as a bioregulator of apoptosis[J].Biochem Biophys Res.Commun,2001(282):1075-1079.
[4] YAMASAKIH,SHANIOHIS Y,TAKAHASHIS.An alternative pathway for nitric oxide production in plant:new feature of an old enzyme [J].Trends plant Sci.,1999,4(4):128-129.
[5] BELIGNIM V,LAMATTINA L.Nitric oxide counteracts cyto toxic processesmediated by Re-active oxygen species in plant tissues[J].Planta,1999,208(6):337-344.
[6] BELIGNIM V,LAMATTINA L.Is nitric oxide toxic or protective[J].Trends PlantSci.,1999,4(8):299-300.
[7] 裴怀弟,陈玉梁,王红梅,等.马铃薯试管苗耐盐性研究[J].甘肃农业科技,2011(6):10-14.
[8] 孙 群,胡景江.植物生理学研究技术[M].西安:西北农林科技大学出版社,2006.
[9] 邹 琦.植物生理学实验指导[M].北京:中国农业出版社,2000.
[10] 王建华,刘鸿先,徐 同.超氧物歧化酶(SOD)在植物逆境和衰老生理中的作用[J].植物生理学通讯,1989,82(1):1-7.
[11] 马向丽,魏小红,龙瑞军,等.外源一氧化氮提高一年生黑麦草抗冷性机制[J].生态学报,2005,25(6):1269-1274.

