铅锑合金中铅的测定
李 沁,赖 心,谢 辉
广东省工业技术研究院(广州有色金属研究院)分析测试中心,广东 广州 510650
含铅、锑的合金摩擦系数小,有良好的韧性、导热性和耐蚀性,是生产蓄电池极板、化工管道、电缆包皮的首选材料.与纯铅相比,铅锑合金的熔点低,熔融状态下流动性好,易于浇铸成型,凝固后硬度大.由于铅锑合金使用还原铅配制[1],合金的各项性能指标与其中铅的含量有很大关系,而相关的铅的测定方法,文献报道较少.本文讨论了用硫酸-硫酸钾体系溶解样品,以柠檬酸钠作为掩蔽剂,采用硫酸铅沉淀法分离去除锑、铁、锌、锡、铜、铝、钴、镍、锰等元素的干扰,在pH=5.5的条件下,采用EDTA滴定法测定合金中的铅含量.
1 实验部分
1.1 仪器与试剂
文中所用试剂均为分析纯,实验用水为二级水.
硫酸钾(AR);硫酸(ρ=1.84g/mL);硝酸(ρ=1.42g/mL);无水乙醇(AR);氨水(1+1);硫酸洗液(2+98);柠檬酸钠溶液:10g/L;金属铅:w(Pb)≥99.99%(表面未氧化).使用前将铅在硝酸(1+9)中浸泡1min后取出,用水洗净,再用丙酮洗净,在烘箱中于50℃烘干,备用;乙酸-乙酸铵缓冲溶液:称取90g乙酸铵,加入100mL冰乙酸,稀释至300 mL,pH=5.5;抗坏血酸(AR);甲基橙:0.5g/L(溶解0.05g甲基橙于100mL水中);二甲酚橙:1g/L(溶解0.1g二甲酚橙于100mL水中).
EDTA标准溶液:称取EDTA 8g,溶解于1L二级水中.
准确称取0.10000g金属铅于250mL锥形瓶中,加入20mL硝酸(1+3),盖上表面皿,加热至溶解完全,取下冷却.用水吹洗表面皿及杯壁,低温煮沸驱除氮的氧化物,冷却.加入1滴甲基橙,用氨水调至黄色,加入40mL乙酸-乙酸铵缓冲溶液,冷却.加入2滴二甲酚橙,用EDTA标准液滴至亮黄.按式(1)计算EDTA对铅的滴定度.

式(1)中,T 为EDTA对铅的滴定度,mg/mL;m 为金属铅的质量,g;V为标定时所用EDTA标准溶液的体积,mL.
1.2 样品处理
称取0.2g铅锑合金(精确至0.0001g)于250 mL烧杯中,加入2g硫酸钾固体[2],40mL 硫酸[3],盖上表皿于电炉板上急热至样品溶解完全,并冒浓硫酸烟2min(如残留有少许黑色漂浮物,在冒浓硫酸烟时沿烧杯壁缓慢滴加2滴硝酸,待黄色烟冒尽之后,再冒浓硫酸烟2min)[4-5].取下冷却至室温.用洗瓶沿烧杯壁少量多次吹水并不停摇匀,待试液不再剧烈放热后稀释至50mL,加入柠檬酸钠溶液10 mL[6-7],混匀,用无水乙醇稀释至200mL[8].静置4 h(或过夜).
1.3 实验方法
用慢速致密滤纸过滤硫酸铅沉淀,沉淀物用硫酸洗液洗涤10次.将沉淀物连同滤纸转入原烧杯中,加入50mL乙酸-乙酸铵缓冲溶液,盖上表面皿于电炉板上加热至微沸,并保持5min,取下.用二级水洗涤表面皿及杯壁,稀释至100mL,冷却至室温.加入0.2g抗坏血酸,搅拌溶解后,加入2滴二甲酚橙指示剂,用EDTA标准液滴定样液由酒红色变为亮黄色为终点.
按式(2)计算样品中铅的质量分数,

式(2)中,T 为EDTA对铅的滴定度,mg/mL;V 为滴定时所用EDTA标准溶液的体积,mL;m为试样的质量,g.
2 结果与讨论
2.1 沉淀酸度的选择
Pb能溶解于热的浓H2SO4中,PbSO4也能溶于热的 φ(H2SO4)>72%的浓 H2SO4中[3].Pb和PbSO4溶于热的浓H2SO4中均生成Pb(HSO4)2.
PbSO4在水中的溶解度较大,20℃时,100mL水中能溶解4.6mg的PbSO4[9].但在稀硫酸中,由于同离子效应,其溶解度大大降低.通过AAS法测定滤液中Pb2+的浓度,得出,当φ(H2SO4)为15%~30%时,滤液中Pb2+的浓度最低,此时PbSO4的沉淀率最高(≥99%),因此,本文选用的沉淀酸度为φ(H2SO4)=20%.
2.2 沉淀环境的选取
常温下,PbSO4不溶于乙醇,为了提高PbSO4的沉淀速度和沉淀率,采用了60%的乙醇环境.由于在纯乙醇的条件下,柠檬酸钠不能对Bi3+进行有效掩蔽,因此,在处理样品的烧杯中先加水至50 mL,再加入10mL柠檬酸钠溶液混匀,最后加无水乙醇至200mL.
2.3 硫酸铅溶剂的选取
硫酸铅易溶于多种有机铵盐的溶液中.浓的乙酸铵、酒石酸铵溶液都是硫酸铅的良好溶剂,溶解后可生成Pb(C2H3O2)2和[Pb2O(C4H4O6NH4)].由于本实验选取在pH=5.5的条件下进行滴定,故采用乙酸-乙酸铵缓冲溶液作为溶剂,生成微电离的Pb(C2H3O2)2.
2.4 沉淀时间的影响
分别在沉淀1h,2h,3h,4h及5h后过滤,采用AAS法测定滤液中Pb2+的浓度,结果表明,当沉淀时间达到4h后,滤液中Pb2+的浓度基本不变,且达到最低值,即此时的沉淀达到了稳定.
2.5 共存离子的影响及消除
铁、铝、铜、锌、钴、镍、锰、锑、锡、铋等元素在pH=5.5的条件下能被EDTA络合而干扰测定.本法利用硫酸铅沉淀将铅与铁、铝、铜、锌、钴、镍、锰、锑、锡等元素分离.由于在稀硫酸溶液中,Bi3+能部分水解生成碱式硫酸铋而与硫酸铅一起沉淀,而碱式硫酸铋可溶解于柠檬酸钠溶液中,故加入10mL柠檬酸钠可消除Bi3+的影响.另外,在硫酸铅沉淀中还有可能夹杂少量的Fe3+,由于Fe3+对二甲酚橙指示剂有很强的封闭作用,可在滴定前加入0.1g抗坏血酸还原Fe3+以消除其影响.
2.6 掩蔽剂的用量
为了减少硫酸铅沉淀中夹杂的Fe3+和共沉淀的碱式碳酸铋对测定的干扰,加入了柠檬酸钠.若柠檬酸钠的用量过多,会生成柠檬酸铅,使PbSO4沉淀量减少,造成铅的损失.实验证明,当柠檬酸钠用量超过1g时,就会造成PbSO4沉淀率的下降.由于此铅锑合金中Fe3+和Bi3+的含量均不高,故在溶液中只需加入10mL柠檬酸钠溶液即可对其进行掩蔽.
3 样品分析
3.1 精密度实验
准确称取0.2000g由客户提供的w(Pb)分别为28.02%(1号),33.78%(2号)和38.58%(3号)的铅锑合金样品,按实验方法独立进行7次铅含量的测定,结果列于表1.

表1 铅含量的测定结果Table 1 Results of Pb
由表1可见,当n=7时,采用本法测定的铅含量的标准偏差为0.09~0.13,相对标准偏差为0.23%~0.36%,能很好地满足日常分析检测的需要.
3.2 回收率实验
准确称取w(Pb)=33.78%的铅锑合金样品0.2000g,按实验方法采用标准加入法测定样品中Pb的含量,回收率试验结果列于表2.
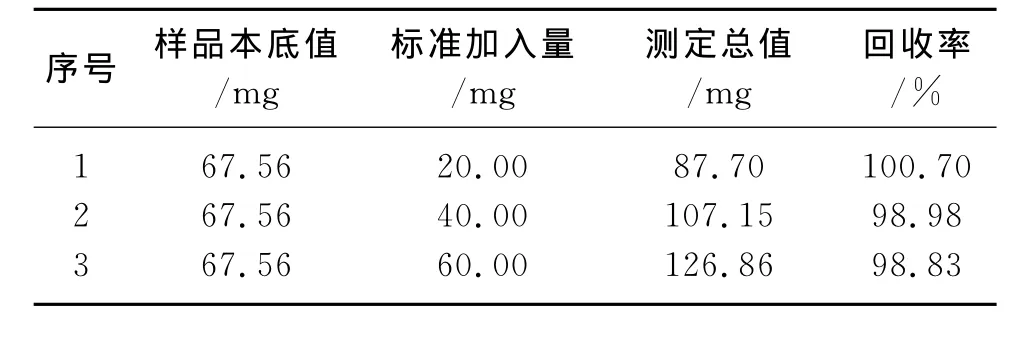
表2 回收率试验结果Table 2 Test results for recovery
对w(Pb)=33.78%的铅锑合金样品进行的回收率实验的结果表明,回收率在98.83%~100.70之间,该方法准确可靠,能很好地满足日常分析检测的需要.
4 结 论
采用硫酸-硫酸钾体系溶解铅锑合金样品,以柠檬酸钠作为掩蔽剂,硫酸铅沉淀法分离其它杂质元素,在pH=5.5的条件下,采用EDTA络合滴定法测定铅锑合金中铅的含量.本法相对标准偏差(RSD)为 0.23% ~0.38% (n=7),回 收 率 在98.83%~100.70%之间.在实际分析过程中该方法操作简便,分离完全,终点明显,能很好地满足日常分析检测的需要.
[1]佟永顺,张克,崔华.废铅蓄电池及废料回收铅的生产实践[J].蓄电池,2011,48(4):167.
[2]国家质量技术监督局.GB/T15925-1995锑矿石化学分析方法 硫酸铈容量法测定锑量[S].北京:中国标准出版社,1995.
[3]江西省冶金研究所.钨矿石中钨及其伴生元素的分析[M].北京:冶金工业出版社,1960:252,245.
[4]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T8152.1-2006铅精矿化学分析方法 铅量的测定 酸溶解-EDTA滴定法[S].北京:中国标准出版社,2006.
[5]北京矿冶研究总院分析室.矿石及有色金属分析手册[M].北京:冶金工业出版社,2007:216.
[6]罗佩珍.应用柠檬酸钠掩蔽铁离子测定矿石中的铅量[J].计量标准与质量,2002,24(1):39-41.
[7]罗佩珍.EDTA容量法测定矿石中铅量时铁的干扰及消除[J].有色金属分析通讯,2002,3:8-11.
[8]李援民.火焰原子吸收法测定高含量铅[J].河南化工,2009,27(9):44.
[9]李连仲.岩石矿物分析第一分册[M].3版.北京:地质出版社,1991:422.

