利用克雷伯氏菌B-36生产耐高温酸性脂肪酶发酵条件的优化
张开平 ,惠 明 ,田 青
(1.河南工业大学 生物工程学院,河南 郑州 450001;2.百色学院 化学与生命科学系,广西 百色 533000)
0 前言
脂肪酶(EC3.1.1.3)又称三酰基甘油水解酶,是一类能在油水界面或水不溶性系统中催化脂类物质水解、酯化、醇解、酯交换等化学反应的生物催化剂[1],具有化学选择性、立体选择性和底物专一性等特点,是当代酶工业最受瞩目的酶种之一[2-3].近年来,人们对脂肪酶耐热、耐酸等酶学特性提出了新的要求,且已成为国内外一个新的研究热点[4-5].酸性脂肪酶广泛地应用于食品风味改进、油脂水解与改性、皮革脱脂、药物修饰、生物柴油等工业领域,但许多工业用脂肪酶在生产中由于耐热或耐酸性较差而失活,或酶作用的最适温度和pH值不在生产工艺要求范围内而受限制[6-7].因此,寻找和分离能高效产耐高温酸性脂肪酶菌株具有一定的科研与生产应用价值,目前,在国内外有关克雷伯氏菌产耐高温酸性脂肪酶的报道较少,克雷伯氏菌B-36(Klebsiella sp.B-36)脂肪酶的发现丰富了脂肪酶的种类,为脂肪酶耐热、耐酸特性的研究提供了新的材料.作者从郑州炼油厂富含油污的土样中分离鉴定了一株产耐高温酸性脂肪酶菌株Klebsiella sp.B-36,探讨该菌株产酶条件和影响因素,为酸性脂肪酶的进一步开发利用奠定基础.
1 材料与方法
1.1 材料
Klebsiella sp.B-36由实验室保藏.
种子培养基(g/L):蛋白胨 5.0,MgSO4·7H2O 1.0,K2HPO41.0,(NH4)2SO45.0,葡萄糖 10.0,橄榄油 10.0 mL,pH 6.0;发酵培养基(g/L):蛋白胨 5.0,酵母膏 20.0,蔗糖 20.0,MgSO4·7H2O 1.0,(NH4)2SO42.0,K2HPO41.0,橄榄油 10.0 mL,pH 6.0.
1.2 培养方法
挑取一环菌种接到种子培养基中,在40℃,160 r/min摇瓶培养24 h后,接入二级种子液中,继续培养24 h,然后再转接到发酵培养基中培养60 h.
1.3 分析方法
1.3.1 酶活力测定
按 GB/T 23535—2009测定.将发酵液于 4℃,12 000 r/min离心20 min,收集上清液测酶活.酶活定义(U):1 mL液体酶,在40℃和pH 7.5条件下,反应15 min,每分钟水解底物产生1μmol可滴定的脂肪酸,即为1个酶活力单位(U),以U/mL表示.
1.3.2 试验设计
以酶活力为指标,研究产酶条件初始pH值、温度、装液量以及接种量对菌株产酶的影响,每个试验点重复3次,试验数据用SAS6.12软件进行方差分析,试验结果用平均值±标准偏差表示[8].在单因素试验的基础上,以pH值、温度、装液量以及接种量为变量,以菌株产酶活力为响应值,设计了4因素3水平共27个试验点的响应面分析试验[9].
2 结果与讨论
2.1 发酵培养基初始p H对菌体产脂肪酶活力的影响
菌体在生长和产酶过程中,培养基的pH是变动的,因此研究培养基的初始pH对菌株产酶的影响至关重要.将初始pH值分别调至3.0~9.0,间隔1个pH单位,40℃,160 r/min条件下培养 60 h后,发酵液离心取上清液测脂肪酶活力,结果见图1.由图1可知,在pH低于5.0时,酶活力随pH上升而逐渐升高,在pH大于5.0之后,随着pH上升,酶活力反而下降,因此,选择培养基初始pH值为5.0,此时发酵液酶活力相对较高.经SAS软件方差分析P<0.05,说明pH对酶活力影响显著.

图1 培养基初始pH值对Klebsiella sp.B-36产脂肪酶的影响
2.2 温度对产酶的影响
将菌体分别置于 30~60℃,间隔 5℃,pH 5.0,160 r/min条件下摇瓶培养60 h后测酶活,结果见图2.由图2可知,随着温度的上升,Klebsiella sp.B-36产脂肪酶活力逐渐升高,当温度升高至45℃时酶活力达到最大,为17.67 U/mL,之后随着温度升高,酶活开始下降,因此,选择培养温度为45℃.经SAS软件方差分析P<0.05,说明温度对酶活力影响显著.
2.3 不同接种量对产酶的影响
接种量对菌体的发酵周期以及产酶能力具有重要影响.接种量过大,菌体增长过快以及带入过多种子代谢物,进而使菌体老化,菌体活力降低,不利于稳定产酶.若接种量过小,菌体增长缓慢,发酵周期延长,菌体活力下降.因此,合适的接种量,既可以缩短发酵周期,又可以获得较高的产酶水平.接种量分别为 0.5%、1.0%、1.5%、2.0%、2.5%、3.0%,pH 5.0,装液量 60 mL,45 ℃,160 r/min条件下摇瓶培养60 h后测酶活,结果见图3.由图3可知,酶活力随着接种量的增加而逐渐升高,随后又逐渐下降,当接种量为2%时酶活力最高,为17.89 U/mL,因此,选择接种量为 2%.经SAS软件方差分析P<0.05,说明接种量对酶活力影响显著.
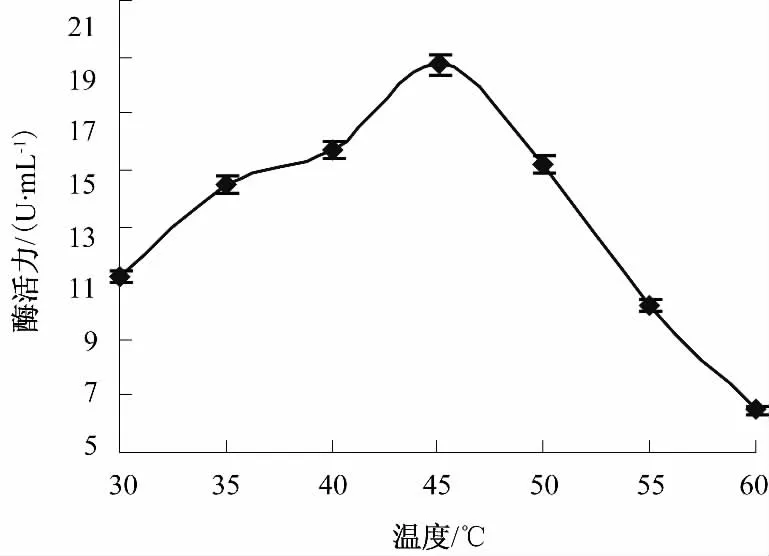
图2 温度对Klebsiella sp.B-36产脂肪酶的影响

图3 接种量对Klebsiella sp.B-36产脂肪酶的影响
2.4 不同装液量对Klebsiella sp.B-36产酶的影响
摇瓶和转速一定时,装液量是控制发酵液溶氧量的主要因素.在250 mL三角瓶中分别装20.0、30.0、40.0、50.0、60.0、70.0、80.0 mL 发酵培养基,pH 5.0,45℃,160 r/min培养60 h后测酶活,结果见图4.由图4可知,当装液量低于60 mL时酶活随着装液量的增大而升高;当装液量增加到60 mL时,酶活达到最高;之后随着装液量的增加,酶活逐渐降低.因此,选择60 mL的装液量进行摇瓶发酵.经SAS软件方差分析P<0.05,说明装液量对酶活力影响显著.

图4 装液量对Klebsiella sp.B-36产脂肪酶的影响
2.5 响应面法优化试验
根据单因素试验条件,以pH值(A)、温度(B)、装液量(C)以及接种量(D)为变量,菌株酶活力为响应值(Y),用Design-Expert 7.0 Trial软件通过中心组合法寻求最优发酵工艺参数[10-11],试验设计及结果见表1,方差分析见表2,根据回归方程作出不同因子的响应面分析见图5.
试验数据用Design-Expert 7.0 Trial软件进行二次回归拟合后,得到回归方程为:
Y=-199.455 83+23.030 83A+1.938 17B+2.087 25C+54.521 67D-0.004AB-0.111 75AC+0.065AD+0.000 35BC-0.015BD-0.005 5CD-1.677 92A2-0.020 517B2-0.012 917C2-12.706 67D2.
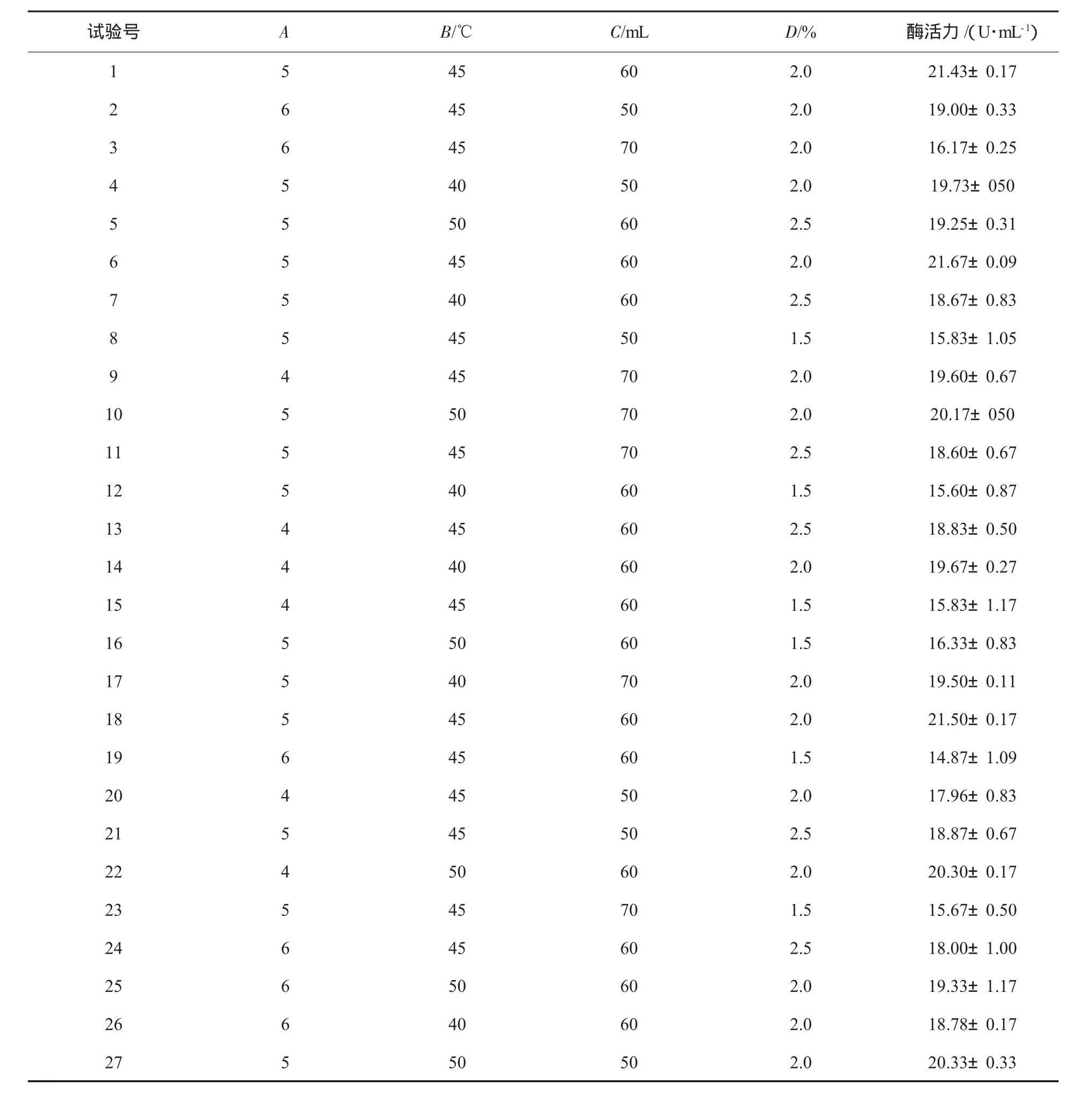
表1 响应面试验设计和结果
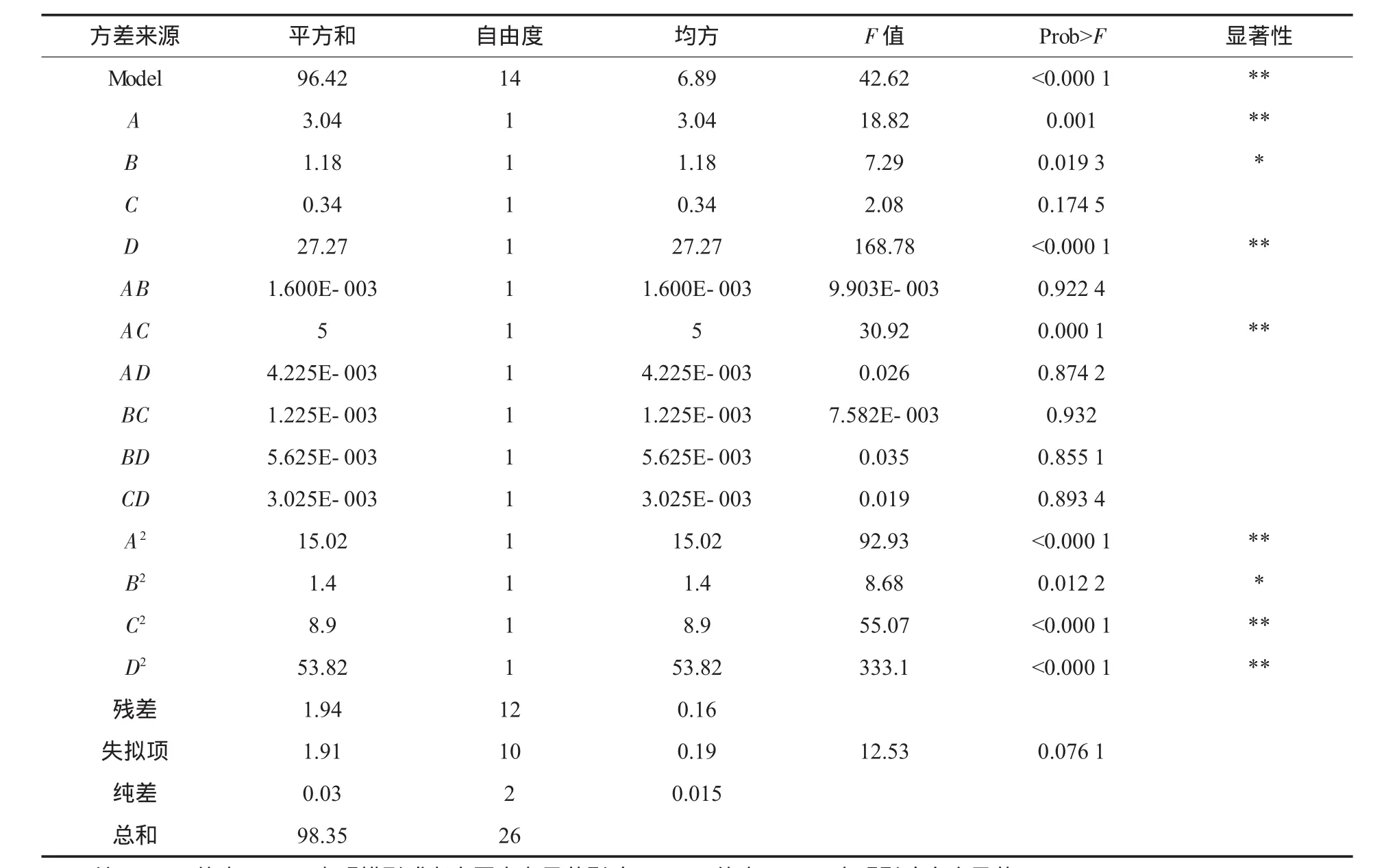
表2 方差分析

图5 响应面的立体分析
由表2可以看出,模型的P值在α=0.000 1水平上显著.同时模型中自变量一次项A,B,D,二次项 AC,A2,B2,C2,D2显著(α=0.05). 模型失拟项不显著,则模型选择得合适.因此可用该回归方程代替试验真实点对试验结果进行分析.同时,由软件分析得到模型的校正决定系数R2为0.957 3,大于0.90,说明该模型最多只有约4.27%的变化不能用此模型来解释.试验偏差系数(CV)为2.16%,其值较低,能由该模型解释,进一步说明模型拟合度较好[12].
对回归方程进行分析,得出最佳发酵条件为:pH 4.9,温度46.5℃,装液量60 mL,接种量2.1%,酶活力为21.8 U/mL.采用最优发酵条件进行产酶试验,重复 3 次,酶活力为(21.7±0.1)U/mL,与模型预测值接近,说明该模型可靠.
3 结论
以自行筛选鉴定的一株耐高温酸性脂肪酶产生菌Klebsiella sp.B-36为研究对象,采用单因素试验和Box-Benhnken响应面分析法对其产酶条件进行了优化,得到了优化发酵条件为:初始pH值4.9,温度46.5℃,250 mL三角瓶装液量60 mL,接种量2.1%(V/V),在最优发酵条件下,发酵产酸性脂肪酶活力达到21.8 U/mL,具有潜在的生产应用价值.
[1] Arifin A R,Kim S J,Yim J H,et al.Isolation and biochemical characterization of bacillus pumilus lipases from the antarctic[J].Journal of Microbiology and Biotechnology,2013,23(5):661-667.
[2] Akanbi T,Adcock J L,Barrow C J,et al.Selective concentration of EPA and DHA using thermomyces lanuginosus lipase is due to fatty acid selectivity and not region selectivity[J].Food Chemistry,2013,138(1):615-620.
[3] Davis B G,Boyer V.Biocatalysis and enzymes in organic synthesis[J].Journal of Natural Products,2001,18:618-640.
[4] Johri S,Bhat A,Sayed S,et al.Novel thermostable lipase from Bacillus circulans IIIB153:comparison with the mesostable homologue at sequence and structure level[J].World of Journal Microbiology and Biotechnology,2012,28(1):193-203.
[5] Grosso C,Ferreira-Dias S,Pires-Cabral P,et al.Modeling and optimization of ethyl butyrate production catalysed by Rhizopus oryzae lipase[J].Journal of Food Engineering,2012,115(4):475-480.
[6] Vaseghi Z,Najafpour G D,Mohseni S,et al.Production of active lipase by Rhizopus oryzae from sugarcane bagasse:solid state fermentation in a tray bioreactor[J].International Journal of Food Science and Technology,2013,48(2):283-289.
[7] Tanaka D,Yoneda S,Yamashiro Y,et al.Characterization of a new cold-adapted lipase from Pseudomonas sp.TK-3[J].Applied Biochemistry and Biotechnology,2012,168(2):327-338.
[8] 宋萍,戚小灵,胡燚,等.响应面法优化枯草芽孢杆菌产脂肪酶的合成培养基[J].中国生物工程杂志,2010,30(8):100-105.
[9] Ebrahimpour A,Abd R R,Ean C D,et al.A modeling study by response surface methodology and artificial neural network on culture parameters optimization for thermostable lipase production from a newly isolated thermophilic Geobacillus sp.strain ARM[J].BMC Biotechnology,2008,96(8):1472-1486.
[10] Ramani K,Saranya P,Jain S C,et al.Lipase from marine strain using cooked sunflower oil waste:production optimization and application for hydrolysis and thermodynamic studies[J].Bioprocess and Biosystems Engineering,2013,36(3):301-315.
[11]桂妍雯,陶文卿,王瑞明,等.克雷伯氏菌发酵条件的响应面设计[J].中国酿造,2012,31(3):132-135.
[12] Wang Q F,Zhang C Y,Hou Y H,et al.Optimization of cold-Active lipase production from psychrophilic bacterium Moritella sp.2-5-10-1 by statistical experimental methods[J].Bioscience Biotechnology and Biochemistry,2013,77(1):17-21.

