AM真菌和磷对小马安羊蹄甲幼苗生长的影响
宋成军,曲来叶,马克明 ,*,傅伯杰 ,陈 羚
(1. 农业部规划设计研究院农村能源与环保研究所/农业部农业废弃物能源化利用重点实验室,北京 100125;2. 中国科学院生态环境研究中心城市与区域国家重点实验室,北京 100041)
AM真菌和磷对小马安羊蹄甲幼苗生长的影响
宋成军1,曲来叶2,马克明2 ,*,傅伯杰2,陈 羚1
(1. 农业部规划设计研究院农村能源与环保研究所/农业部农业废弃物能源化利用重点实验室,北京 100125;2. 中国科学院生态环境研究中心城市与区域国家重点实验室,北京 100041)
丛枝菌根(arbuscular mycorrhizal,AM)真菌在退化生态系统恢复与重建实践中具有重要作用。采用盆栽模拟方法,重点分析不同土壤磷条件下小马鞍羊蹄甲(Bauhiniafaberi)幼苗接种AM真菌后,幼苗的形态、生物量积累、菌根侵染率和菌根效应(mycorrhizal growth response, MGR)在一个生长季内的动态变化。结果表明,Glomusmosseae和Glomuscoronatum能较好地侵染幼苗,两种AM真菌显著地增加幼苗根系、叶片数和生物量;接种AM真菌显著影响幼苗的生物量分配,而土壤磷对幼苗的生物量分配影响不明显,AM真菌和土壤磷对幼苗生长的交互作用显著;G.mosseae是小马鞍羊蹄甲的优势AM菌,其接种的幼苗根长、叶片数、生物量、侵染率和菌根效应都显著高于G.coronatum处理的幼苗;菌根效应显著,接种AM真菌能有缓解土壤磷素缺乏的限制作用,且随着苗龄增大促生作用表现更为明显。不同AM菌种对小马鞍羊蹄甲幼苗生长的促生作用表现出的差异,提示在多元资源限制的干旱贫瘠环境中进行生物修复须为目标恢复物种筛选出高效的优势AM真菌。
退化生态系统;丛枝菌根真菌;多元养分限制;生长动态;植被恢复
丛枝菌根(arbuscular mycorrhizal, AM)真菌是自然界中分布极其广泛,农业和生态意义十分重大的一类土壤微生物,它能够与陆地上90%以上的植物根系形成AM[1- 3]。AM不仅能增强寄主植物对土壤中水分和养分的吸收,而且分泌的相关土壤蛋白参与土壤团聚体的形成和稳定,从而促进寄主植物的生长和改善土壤结构,所以在退化生态系统恢复与重建过程中具有重要功能[4- 6],生态恢复中AM的作用备受关注。
横断山区干旱河谷是青藏高原特殊气候与地理环境条件下形成的脆弱生境,是我国生态环境综合治理的关键区域,有效促进干旱河谷植被恢复和重建,遏制生态退化,已成为当前一项迫切的任务[7]。小马鞍羊蹄甲(Bauhiniafaberi)是该区域现存植被中多年生乡土优势灌木之一,在横断山区干旱河谷区域广为分布,具有较强的耐旱特性和优良的水土保持性能,亦可作为饲料、薪材和药用[8],小马鞍羊蹄甲植被的恢复会产生很好的生态、社会和经济效益,具有巨大的植被恢复潜力。然而,植被调查中并未发现其幼苗的大量存在,严酷的干旱环境和贫瘠的土壤可能严重制约了幼苗的定居。我国退化生态系统中均存在AM真菌[9],球曩霉属(Glomus)是干旱生态系统中分布最广泛AM真菌,Glomusmosseae则是干旱生态系统中的优势AM菌种,豆科植物是其寄生的优势类群[10]。尽管干旱环境条件下小马鞍羊蹄甲对水分和养分胁迫的适应能力已有所研究和揭示[8,10- 11],而AM真菌在干旱和缺磷条件下对本区域优势灌木促生作用一直缺乏必要的研究,缺磷条件下AM的形成能否改善小马鞍羊蹄甲适应干旱环境的能力并不清楚。因此,针对该区土壤水分和磷素多元层级的资源限制结构[11- 12],人为接种该区域植被的优势AM真菌,假设接种AM真菌后菌根效应显著,可以刺激小马鞍羊蹄甲幼苗生长,且不同年龄幼苗对不同AM菌种的响应程度不同,使得幼苗能够更好的适应干旱贫瘠环境。为此,本研究采用盆栽方法模拟干旱缺磷环境,重点分析不同磷条件下对两种AM真菌对小马鞍羊蹄甲幼苗的促生作用,从而为岷江干旱河谷以乡土灌木为恢复目标的恢复理论与实践提供科学依据。
1 材料与方法
1.1 试验材料
寄主植物 小马鞍羊蹄甲(Bauhiniafaberivar. microphylla)。
供试AM菌种Glomusmosseae(G.mosseae)和Glomuscoronatum(G.coronatum)。菌种均由北京市农林科学院植物营养与资源研究所微生物室提供,接种剂为高粱繁殖的土沙混合物,内含供试菌种孢子、侵染根段和菌丝片段。G.mosseae从新疆昭苏新疆韭(Alliumcoeruleum)根围分离,为2857个孢子/20 mL菌剂,G.coronatum从蒙伊金霍洛旗沙蒿(Artemisiadesteroru)根际分离,为1390个孢子/20 mL菌剂。
供试基质 沙土,将沙土过2 mm筛子充分混匀备用,基质的pH值为8.8,电导率为289 μS/cm,速效磷含量为5.9 mg/kg,铵态氮为13.3 mg/kg,硝态氮含量为4.2 mg/kg,体积含水量为32%。
1.2 试验设计
2007年在岷江干旱河谷核心区飞虹乡(四川省茂县,土壤类型为石灰性褐土)采集寄主植物种子,通过筛选、水选与肉眼选择形态大小基本一致,表皮光滑,健康无虫害的种子,晒干后备用。2008年7月5日播种,挑选饱满种子,用20%浓硫酸浸泡4 h,蒸馏水冲洗干净,并浸泡24 h。萌发前用2.5%NaOCl溶液将种子消毒10 min,然后在蒸馏水中浸泡20 min。再把种子铺在垫有滤纸的托盘内,放在培养箱中,黑暗下萌发7d(60%湿度和25 ℃)。接种前,沙土和珍珠岩间歇灭菌3次(1.1 kg/cm2,126 ℃,20 min),一次性塑料杯(250 mL)则用75%酒精消毒。幼苗长出2片真叶后,选择发芽一致的幼苗移植(1株/杯)。植苗时,每杯先装基质150 g,然后放入接种剂5 g,再加入100 g基质,最后覆盖一薄层珍珠岩3.5 g,以防止基质的水分蒸发。移苗后,随即按照表2中磷的浓度和配比要求,均匀浇入磷溶液([NaH2PO4] = 4.9 mmol/L)和蒸馏水。
试验设置2个磷梯度(6.0 mg P/kg和24.0 mg P/kg)和2个菌处理(G.mosseae和G.coronatum)(表1)。两个磷梯度可以模拟干旱河谷表层褐土(0—20 cm)磷含量的极低值和高值,32%的体积含水量则代表干旱河谷生长季表层土壤含水量的平均值[12]。采用析因试验和对照,共6个处理,每一处理设置12个重复,共72株幼苗。试验在城市与区域国家重点实验室进行,幼苗置于培养箱内培植,箱内环境参数为:夜间长14 h,温度为19 ℃,相对湿度88%;白天持续10 h,温度25 ℃,相对湿度为70%。2008年7月27日,开始称重法控制水分,试验至11月7日结束。移苗两周后,每杯每周浇一次无磷Long Ashton 营养液,以保证其它营养元素的供应。

表1 磷肥和AM真菌的浓度及其施用配比
LPCK: 低磷处理;LPGc: 低磷+接种G.coronatum处理;LPGm: 低磷+接种G.mosseae处理; HPCK: 高磷处理; HPGc: 高磷+接种G.coronatum处理; HPGm: 高磷+接种G.mosseae处理
1.3 样品分析
在苗龄第48天、86天和104天时分别收割幼苗,每个处理每次收割3株幼苗。试验结束时登记所有死苗。收割前,分别测定基径、茎总长、株高、叶片数等4个生长指标;收割后,清洗根系,取少量根系进行其他测定。自然晾干后,按照叶、茎、细根和粗根将植株分开,测量各部分鲜重和细根总长度,然后在68 ℃烘箱中烘至恒重,在万分之一分析天平(Mettler-Toledo AL204)上称量,即得各器官生物生产量。幼苗由于样品量小,磨碎后全部用于元素分析。依据Phillips和Hayman[13]描述的方法染色,侵染率(IR)采用侵染频度(IF%)表示,计算公式为:IF%=(侵染根段数/总根数)×100[14];菌根效应(MGR)计算公式为:MGR(%)=(菌根植物干重-不接种植物干重)/菌根植物干重×100%[15]。根长用卷尺测量,根面积用面积测定仪(Honggu,Akinori MYKA. Lab. 1.01 Ver)测定。
1.4 数据处理
基于多元方差分析(MANOVA)来分析和评价AM真菌和土壤磷对幼苗根系、叶片、生物量等多个指标的综合影响。第一步,采用MANOVA来评定AM真菌和磷处理的主效应和交互作用;第二步:采用Tukey′s HSD 方法进行多重比较,采用皮尔逊相关分析法对各处理下幼苗的生长参数进行相关分析。方差分析前,所有实测数据进行正态检验,必要时用对数转换,以保证数据服从正态分布和方差齐性。分析统计均在SPSS13.0软件(Standard released version 13 for Windows,SPSS Inc.,IL. Chicago,USA)上完成。
2 结果
2.1 不同磷条件下AM真菌对小马鞍羊蹄甲幼苗生长的主效应和交互作用
两种土壤磷条件下,接种G.mosseae和G.coronatum后,AM真菌对小马鞍羊蹄幼苗根系有较好地侵染,G.mosseae的侵染率显著高于G.coronatum的侵染率,不同苗龄间菌根侵染率相差不大,低磷条件下G.mosseae和G.coronatum对根系的侵染率分别处在51%—71%和30%—31%之间,高磷条件下G.mosseae和G.coronatum对根系的侵染率分别处在60%—74%和35%—58%之间(图1)。
表2表明:多元方差分析模型适用于该研究(Plt;0.001),土壤磷对幼苗生长的主效应不显著,AM真菌对小马鞍羊蹄甲幼苗生长的主效应显著,磷和AM对幼苗生长交互作用影响不明显。
2.2 不同磷条件下接种AM真菌对小马鞍羊蹄甲幼苗生长的动态影响
不同土壤磷条件下,接种G.mosseae或G.coronatum对幼苗的根系生长都有显著促进作用,菌根对86d和104d的幼苗的促进作用明显高于48d的幼苗。由图2可见,48d的幼苗在HPGm处理下,根长比LPCK处理增加了57%,在HPGc处理下,根长比LPCK处理增加了8%;86d的幼苗,LPGm处理下根长比LPGc处理增加了33%,且LPGm和LPGc处理的根长分别比LPCK处理增加了104%和53%,HPGm处理的根长比HPGc处理增加了43%,且HPGm和HPGc处理的根长分别比HPCK处理增加了131%和62%;104d的幼苗,LPGm处理下根长比LPGc处理增加了15%,且在LPGm和LPGc处理下,根长分别比LPCK处理增加了77%和55%,HPGm处理的根长比HPGc处理增加了10%,且在HPGm和HPGc处理下,根长分别比HPCK处理增加了89%和72%。另外,在3个苗龄阶段,幼苗在HPCK处理下,根长分别比LPCK处理增加了15%、13%和16%,在HPGm处理下,根长分别比LPGc处理增加了36%、29%和24%,在HPGc处理下,根长分别比LPGc处理增加了12%、20%和29%。
表2不同磷条件下AM真菌对小马鞍羊蹄甲幼苗生长影响的多元方差分析
Table2MultivariateanalysisofvarianceoneffectsofAMfungiongrowthcharacteristicofB.faberiseedlingsunderdifferentsoilphorsphorus

效应EffectTWilks'lambdaTvalue假设检验自由度HypothesisdfdfF显著性Sig.截距Intercept0.0048.00011.000355.3000.000***磷肥Pfertilizer0.4428.00011.0001.7350.195菌种AMfungi0.01216.00022.00011.2820.000***磷肥×菌种P×AM0.22816.00022.0001.5060.184
***代表0.1%水平上的差异显著性

图1 生长季内不同磷和AM菌种侵染下的小马鞍羊蹄甲幼苗根系的菌根侵染率Fig.1 Change in infection frequency of B. faberi seedlings differing in mycorrhizal status and soil AP concentration in growing seasonLPCK: 低磷处理;LPGc: 低磷+接种G. coronatum处理;LPGm: 低磷+接种G. mosseae处理; HPCK: 高磷处理; HPGc: 高磷+接种G. coronatum处理; HPGm: 高磷+接种G. mosseae处理; 不同小写字母表示在0. 05 水平上差异显著

图2 生长季内不同磷条件下小马鞍羊蹄甲幼苗根长随接种AM真菌的变化Fig.2 Change in total root length of B. faberi seedlings inoculated with two AM fungi differing in soil AP concentration during one growing seasonLPCK: 低磷处理;LPGc: 低磷+接种G. coronatum处理;LPGm: 低磷+接种G. mosseae处理; HPCK: 高磷处理; HPGc: 高磷+接种G. coronatum处理; HPGm: 高磷+接种G. mosseae处理
不同土壤磷条件下,接种G.mosseae或G.coronatum对幼苗的叶片数量都有显著增加作用,菌根对86d和104d的幼苗的促进作用明显高于48d的幼苗。由图3可见,48d的幼苗在HPGm处理下,叶片数比LPCK处理增加了281%,在HPGc处理下,叶片数比LPCK处理增加了17%;86d的幼苗,LPGm处理下叶片数比LPGc处理增加了15%,且LPGm和LPGc处理的叶片数分别比LPCK处理增加了533%和450%,HPGm处理的叶片数比HPGc处理增加了54%,且HPGm和HPGc处理的叶片数分别比HPCK处理增加了433%和247%;104d的幼苗,LPGm处理下叶片数比LPGc处理增加了29%,且在LPGm和LPGc处理下,叶片数分别比LPCK处理增加了471%和373%,HPGm处理的叶片数比HPGc处理增加了5%,且在HPGm和HPGc处理下,叶片数分别比HPCK处理增加了461%和433%。另外,在3个苗龄阶段,幼苗在HPCK处理下,叶片数分别比LPCK处理增加了17%、25%和10%,在HPGm处理下,叶片数分别比LPGc处理增加了205%、5%和8%,在HPGc处理下,叶片数分别比LPGc处理增加了30%、-21%和24%。
不同土壤磷条件下,接种G.mosseae或G.coronatum对植株生物量均有明显的提高作用,菌根对86d和104d的幼苗的促进作用明显高于48d的幼苗。由图4可知,48d的幼苗在HPGm处理下,生物量比LPCK处理增加了156%,在HPGc处理下,生物量比LPCK处理增加了22%;86d的幼苗在LPGm处理下,生物量比LPGc处理增加了12%,且在LPGm和LPGc处理下,生物量分别比LPCK处理增加了19%和6%,HPGm处理的生物量比HPGc处理增加了7%,且在HPGm和HPGc处理下,生物量分别比HPCK处理增加了36%和27%;104d的幼苗在LPGm处理下,生物量比LPGc处理增加了15%,且在LPGm和LPGc处理下,生物量分别比LPCK处理增加了45%和26%,HPGm处理的生物量比HPGc处理增加了23%,且在HPGm和HPGc处理下,生物量分别比HPCK处理增加了68%和37%。另外,在3个苗龄阶段,幼苗在HPCK处理下,生物量分别比LPCK处理增加了22%、3%和15%,在HPGm处理下,生物量分别较LPGm处理增加了36%、29%和24%,在HPGc处理下,生物量分别较LPGc处理增加了12%、20%和29%。

图3 生长季内不同磷条件下小马鞍羊蹄甲幼苗叶片数随接种AM真菌的变化Fig.3 Change in leaf number of B. faberi seedlings inoculated with two AM fungi differing in soil AP concentration during one growing seasonLPCK: 低磷处理;LPGc: 低磷+接种G. coronatum处理;LPGm: 低磷+接种G. mosseae处理; HPCK: 高磷处理; HPGc: 高磷+接种G. coronatum处理; HPGm: 高磷+接种G. mosseae处理

图4 生长季内不同磷条件下小马鞍羊蹄甲幼苗总生物量随接种AM真菌的变化Fig.4 Change in total biomass of B. faberi seedlings inoculated with two AM fungi differing in soil AP concentration during one growing seasonLPCK: 低磷处理;LPGc: 低磷+接种G. coronatum处理;LPGm: 低磷+接种G. mosseae处理; HPCK: 高磷处理; HPGc: 高磷+接种G. coronatum处理; HPGm: 高磷+接种G. mosseae处理
2.3 不同磷条件下接种AM真菌对小马鞍羊蹄甲幼苗生物量积累与分配的影响
由表3可知,接种AM真菌对幼苗的生物量积累及分配有显著影响(Plt;0.05),但土壤磷素对幼苗生物量积累及分配的影响不显著(Pgt;0.05),且磷和AM真菌处理交互作用显著(Plt;0.05)。在LPGm处理下,幼苗的总生物量、叶生物量、茎生物量和细根生物量分别比LPGc处理增加了15%、131%、98%和21%,且地上生物量增加了111%而下地生物量下降了28%,LPGm处理下叶片质量分数从12%增加到24%,比LPCK处理增加了149%;在HPGm处理下,幼苗的总生物量、叶生物量、茎生物量和细根生物量分别比HPGc处理增加了23%、33%、17%和27%,且地上部生物量增加了25%而地下部生物量下降了21%,HPGm处理下叶片质量分数从26%增加到29%,比HPCK处理增加了87%。

表3 不同处理小马鞍羊蹄甲幼苗生物量在各器官中的积累与分配
LPCK: 低磷处理;LPGc: 低磷+接种G.coronatum处理;LPGm: 低磷+接种G.mosseae处理; HPCK: 高磷处理; HPGc: 高磷+接种G.coronatum处理; HPGm: 高磷+接种G.mosseae处理; *代表5%水平上的差异显著性
2.4 相关性分析
AM真菌侵染率与小马鞍羊蹄甲生长参数的相关性十分明显(表4)。侵染率与基茎、茎总长、株高、叶片数、总生物量等参数呈显著正相关,而与根茎比显著负相关,与细根长负相关但不显著;小马鞍羊蹄甲幼苗的根茎比和基茎、茎总厂、株高、叶片数显著负相关;小马鞍羊蹄甲幼苗的总生物量与基茎、茎总厂、株高、叶片数显著正相关,与叶片数正相关。
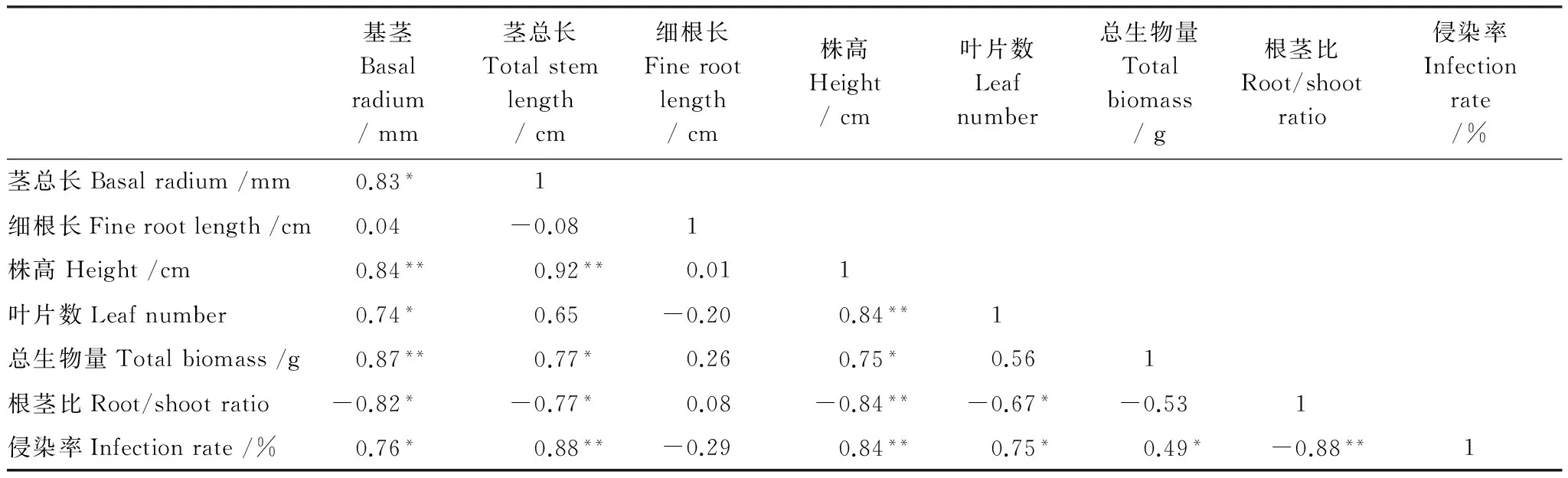
表4 不同处理小马鞍羊蹄甲幼苗生长参数和侵染率的相关关系
*,**分别代表5%、1%水平的差异显著性
3 讨论
土壤水分和有效磷是干旱生态系统植被恢复的关键限制性资源[16- 17],并在空间和时间分布上具有强烈的异质性[11,18]。小马鞍羊蹄甲作为岷江干旱河谷一种优势乡土豆科灌木,其植被生长和空间格局必然受到土壤干旱胁迫和磷分缺乏的共同限制,。同时,AM真菌作为直接联系土壤和植物根系的一类微生物,AM真菌与植物共生可以改善植物的磷营养,增强植物抵御干旱的危害,提高植物在逆境中的生存能力[19]。因此,需要深入认识干旱缺磷条件下接种AM真菌对优势灌木幼苗更新和生长的影响过程。本文应用盆栽试验研究了目标恢复物种(target species)——小马鞍羊蹄甲幼苗在干旱和缺磷条件下接种两种干旱区豆科灌木优势AM真菌(G.mosseae和G.coronatum)对其幼苗生长动态的影响。试验中,当年生幼苗株高在6—25 cm之间,单株生物量为0.1—0.5 mg,幼苗表现出一定的死亡率,多元方差分析结果表明,土壤有效磷和AM真菌对幼苗生长的交互作用明显,即不同土壤磷条件下幼苗接种AM真菌对生物量积累及分配有显著影响(表3)。以上结果证明了干旱河谷恶劣的水分和养分胁迫严重限制了幼苗的定植和生长,也证实小马鞍羊蹄甲具有较强的适应本地严酷环境的适应能力,具备了选作干旱河谷植被恢复物种的潜力。因此,在岷江干旱河谷缺水少磷的自然环境中,研究小马鞍羊蹄甲幼苗生长在不同土壤磷素条件下对接种不同AM真菌的响应,可以加深理解小马鞍羊蹄甲种群的自然恢复机制,同时为人工恢复提供技术支撑。
本研究表明G.mosseae和G.coronatum能较好地侵染小马鞍羊蹄甲幼苗根系。试验中,G.mosseae和G.coronatum在不同苗龄时均可有效侵染小马鞍羊蹄甲幼苗,即便在土壤磷素极低条件下,G.mosseae对小马鞍羊蹄甲幼苗根系的侵染率区间亦达到51%—71%,G.coronatum对幼苗的侵染率为30%—310%,而在高磷条件下,G.mosseae对小马鞍羊蹄甲幼苗根系的侵染率为60%—74%,G.coronatum的侵染率为35%—58%,可见土壤极低磷和高磷条件下,AM真菌对小马鞍羊蹄甲根系的侵染差别不大。这一结果表明两种AM真菌都能有效地侵染小马鞍羊蹄甲幼苗根系,侵染率差异不明显则表明土壤磷素对AM真菌侵染小马鞍羊蹄甲幼苗的影响较弱(图1)。这与附近区域的野外调查分析结果一致,蔡晓布等[20]调查分析了环境因子对西藏高原草地植物AM真菌的影响,发现土壤有效磷在≤24 mg/kg范围内,AM真菌侵染率和土壤有效磷几乎没有相关性。但在土壤磷极低条件下,接种AM真菌的小马鞍羊蹄甲幼苗表现出的菌根效应较高磷条件下的幼苗所表现出的菌根效应明显增大,这可能是由于侵染率的提高可以显著增加植物根系从土壤中获取水分和磷素的能力[21- 23],因为大量研究表明,干旱条件下接种AM真菌能提高幼苗和植被吸收利用难移动的和易移动土壤养分元素[24- 25]。所以,在土壤磷素缺乏的岷江干旱环境中,为幼苗接种AM真菌是一种缓解多元资源限制的有效措施。

图5 生长季内不同磷和AM真菌侵染条件下的小马鞍羊蹄甲幼苗生长的菌根效应Fig.5 Change in mycorrhizal growth response of B. faberi seedlings differing in mycorrhizal status and soil AP concentration during one growing seasonLPCK: 低磷处理;LPGc: 低磷+接种G. coronatum处理;LPGm: 低磷+接种G. mosseae处理; HPCK: 高磷处理; HPGc: 高磷+接种G. coronatum处理; HPGm: 高磷+接种G. mosseae处理; 不同小写字母表示在0. 05 水平上差异显著
AM真菌侵染小马鞍羊蹄甲幼苗根系后,AM真菌的菌根效应明显,G.mosseae产生的菌根效应显著高于G.coronatum,这暗示前者是小马鞍羊蹄甲的优势共生AM菌种。实际上,G.mosseae适应范围较广[26],共生植物较副冠球囊霉属多,本研究结果也与秦晓峰[27]的野外调查结果一致。另外,小马鞍羊蹄甲幼苗在不同苗龄时对AM真菌的响应有明显差异。在48d和86d苗龄时,无论土壤磷条件如何,两种AM真菌的菌根效应相差不明显,比如,在土壤极低磷条件下,G.mosseae侵染后,48d的幼苗菌根效应变动范围为26%—30%,86d的幼苗菌根效应约为6%,在土壤高磷条件下,G.mosseae侵染后,48d的幼苗菌根效应变动范围为16%—17%,G.coronatum侵染后菌根效应在2%—4%内波动,但生长季末(即苗龄104d)G.mosseae和G.coronatum侵染后表现出的菌根效应显著高于前2两个阶段的幼苗(图5)。
干旱环境中,在不同土壤磷条件下,接种AM真菌能缓解磷限制和显著促进幼苗生长,增加其环境适应性。LPCK处理下,幼苗根长、叶片数量和总生物量分别为HPCK处理的87%、91%和85%(图2—图4),这一结果表明小马鞍羊蹄甲幼苗在生长季内明显受到土壤磷素的强烈限制,但是LPCK和HPCK处理下的幼苗根长、叶片数、叶生物量、茎生物量、细根生物量和总生物量明显小于接种AM真菌幼苗,这又说明接种AM真菌能有缓解土壤磷素缺乏的限制作用,并且随着苗龄增大促生作用表现更为明显,蔡晓布等[20]和张燕等[28]也得到了类似研究结果。接种G.mosseae和G.coronatum显著提高小马鞍羊蹄甲幼苗的总生物量积累(分别增加了地上生物量和地下生物量)的同时,明显增加了地上生物量在总生物量中的分配比例,降低了幼苗的根茎比,这表明AM真菌对小马鞍羊蹄甲地上部生长的促进作用较根系更为强烈,幼苗叶片数与AM真菌侵染率呈显著正相关而与根茎比呈显著负相关也表明了这一结果(表4)。可见,接种AM真菌既能满足幼苗生长对磷素的需要,又可提高幼苗的光合作用面积和光合效率,从而在一定程度上缓解养分胁迫,反过来又促进幼苗生长。因此,生物修复是干旱生态系统植被恢复与重建的最为有效手段之一[29- 30]。研究表明在干旱河谷调查土壤AM真菌时发现该区域植被被球囊霉属AM真菌普遍侵染,AM侵染率高达92%,球囊霉属占所有AM真菌种类的74%[31],实际上,自然恢复过程中横断山区干旱河谷植被本身具有很高的AM真菌生物多样性和AM真菌侵染率[32- 34],盆栽试验结果和野外调查表明应用AM真菌进行植被恢复具有现实意义。
在干旱胁迫和磷限制环境中,两种AM菌种对生长效应表现出差异性是在沙土盆栽试验条件下获得的,乡土目标恢复物种仅为小马鞍羊蹄甲一种,观察时间仅为一个生长季,因此,在将AM真菌用于研究区域植被恢复时,有必要进一步在原土栽培条件下,尤其是野外环境中开展较长时间的生长状况监测,定量研究植物生长、土壤养分和AM真菌之间的相互作用,深入揭示AM真菌对土壤—植被系统恢复的作用方式,从而提高多元资源限制环境中植被恢复效率。
致谢:感谢李芳兰、田宜水、陈羚等对论文写作和修改的帮助。
[1] Pennisi E. The secret life of fungi. Science, 2004, 304(5677): 1620- 1622.
[2] Smith S E, Read D J. Mycorrhizal Symbiosis. 3rd ed. London: Academic, 2008: 105- 109.
[3] Closa I, Goicoeche N. Infectivity of arbuscular mycorrhizal fungi in naturally regenerating, unmanaged and clear-cut beech forests. Pedosphere, 2011, 21(1): 65- 74.
[4] Liang Y, Guo L H, Ma K P. The role of mycorrhizal fungi in ecosystems. Acta Phytoecologica Sinica, 2002, 26(6): 739- 745.
[5] Jeffries P, Gianinazzi S, Perotto S, Turnau K, Barea J M. The contribution of arbuscular mycorrhizal fungi in sustainable maintenance of plant health and soil fertility. Biology and Fertility of Soils, 2003, 37(1): 1- 16.
[6] Dhillion S S, Gardsjord T L. Arbuscular mycorrhizas influence plant diversity, productivity, and nutrients in boreal grasslands. Canadian Journal of Botany, 2004, 82(1): 104- 114.
[7] Wu F Z, Bao W K, Wu N. Growth, accumulation and partitioning of biomass, C, N and P Sophora davidii seedlings in response to N supply in dry valley of upper Minjiang River. Acta Ecologica Sinica, 2008, 28(8): 3817- 3824.
[8] Li F L, Bao W K, Wu N, You C. Growth, biomass partitioning, and water-use efficiency of a leguminous shrub (Bauhiniafaberivar.micophylla) in response to various water availabilities. New Forests, 2008, 36(1): 53- 65.
[9] Liu R J, Liu P Q, Xu K, Lü Z F. Ecological distribution of arbuscular mycorrhizal fungi in saline alkaline soils of China. Chinese Journal of Applied Ecology, 1999, 10(6): 721- 724.
[10] Shi Z Y, Gao S C, Wang F Y. Biodiversity of arbuscular mycorrhizal fungi in desert ecosystems. Arid Zone Research, 2008, 11(6): 783- 789.
[11] Song C J, Ma K M, Fu B J, Qu L Y, Liu Y, Zhong J F. Influence of soil moisture, nitrogen and phosphorus contents onBauhiniafaberiseedlings growth characteristics in arid valley of Minjiang River. Chinese Journal of Applied Ecology, 2009, 20(8): 1797- 1804.
[12] Song C J, Ma K M, Qu L Y, Liu Y, Xu X L, Fu B J, Zhong J F. Interactive effects of water, nitrogen and phosphorus on the growth, biomass partitioning and water-use efficiency ofBauhiniafaberiseedlings. Journal of Arid Environment, 2010, 74(9): 1003- 1012.
[13] Phillips J M, Hayman D S. Improved procedures for clearing roots and staining parasitic and vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection. Transactions of the British Mycological Society, 1970, 55(1): 158- 160.
[14] Trouvelot A, Kough J L, Gianinazzi-Pearson V.MesuredutauxdemycorhizationVAd′unsystème radiculaire. Recherche de méthodes d′estimation ayant une signification fonctionelle // Gianinazzi-Pearson V, Gianinazzi S, eds. “Physiological and genetical aspects of mycorrhizae”. Paris: INRA, 1985: 217- 221.
[15] Cavagnaro T R, Smith F A, Ayling S M, Smith S E. Growth and phosphorus nutrition of a Paris-type arbuscular mycorrhizal symbiosis. New Phytologist, 2003, 157(1): 127- 134.
[16] James J J, Tiller R L, Richards J H. Multiple resources limit plant growth and function in a saline-alkaline desert community. Journal of Ecology, 2005, 93(1): 113- 126.
[17] Song C J, Ma K M, Fu B J, Qu L Y, Xu X L, Liu Y, Zhong J F. Distribution patterns of shrubby N-fixers and non-N fixers in an arid valley in Southwest China: implications for ecological restoration. Ecological Research, 2010, 25(3): 553- 564.
[18] Xu X L, Ma K M, Fu B J, Song C J, Liu W. Relationships between vegetation and soil and topography in a dry-warm river valley, SW China. Catena, 2008, 75(2): 138- 145.
[19] Peng S L, Shen H, Yuan J J, Wei C F, Guo T. Impacts of arbuscular mycorrhizal fungi on soil aggregation dynamics of neutral purple soil. Acta Ecologica Sinica, 2011, 31(2): 498- 505.
[20] Cai X B, Qian C, Peng Y L, Feng G, Gai J P. Effects of environmental factors on AM fungi around steppe plant roots in Tibet Plateau. Chinese Journal of Applied Ecology, 2005, 16(5): 859- 864.
[21] Colpaert J V, van Tichelen K K, van Assche J A, van Laere A. Short-term phosphorus uptake rates in mycorrhizal and non-mycorrhizal roots of intactPinussylvestrisseedlings. New Phytologist, 1999, 143(3): 589- 597.
[22] Augé R M. Arbuscular mycorrhizae and soil/plant water relations. Canadian Journal of Soil Science, 2004, 84(4): 373- 381.
[23] Zhu X C, Song F B, Liu S Q, Liu T D, Zhou X. Arbuscular mycorrhizae improves photosynthesis and water status ofZeamaysL. under drought stress. Plant Soil and Environment, 2012, 58(4): 186- 191.
[24] Rowe H I, Brown C S, Claassen V P. Comparisons of mycorrhizal responsiveness with field soil and commercial inoculum for six native montane species andBromustectorum. Restoration Ecology, 2007, 15(1): 44- 52.
[25] Smith S E, Facelli E, Pope S, Smith F A. Plant performance in stressful environments: interpreting new and established knowledge of the roles of arbuscular mycorrhizas. Plant and Soil, 2010, 326(1/2): 3- 20.
[26] Zhao H M. On ecological distribution of arbuscular mycorrhizal fungi. Journal of Heze University, 2007, 29(5): 87- 90.
[27] Qin X F. Survey of VA mycorrhizal fungi of several xerophytes in Dingxi. Gansu Science and Technology, 2007, 23(5): 205- 207.
[28] Zhang Y, Guo L D, Liu R J. Diversity and ecology of arbuscular mycorrhizal fungi in Dujiangyan. Acta Phytoecologica Sinica, 2003, 27(4): 537- 544.
[29] Lin X M, Li Z Q, Han D J, Hou J. Mycorrhiza and restoration of vegetation. Agricultural Research in the Arid Areas, 2003, 21(2): 167- 170.
[30] de Deyn G B, Raaljmakers C E, Zoomer H R, Berg M P, de Ruiter P C, Verhoef H A, Bezemer T M, van der Putten W H. Soil invertebrate fauna enhances grassland succession and diversity. Nature, 2003, 422(6933): 711- 713.
[31] Zhang Y, Li J, Yao Q, Chen J Z, Hu Y L, Liu X Y, Huang Y J. Effects of arbuscular mycorrhizal fungi on growth and nutrient uptake ofEriobotryajaponicaplants under different water regimes. Acta Horticulturae Sinica, 2012, 39(4): 757- 762.
[32] Liang Y, Guo L D, Ma K P. Spatial pattern of the most common late-stage ectomycorrhizal fungi in a subtropical forest in Dujiangyan, Southwest of China. Acta Botanica Sinica, 2004, 46(1): 29- 34.
[33] Li T, Li J P, Zhao Z W. Arbuscular mycorrhizas in a valley-type savanna in southwest China. Mycorrhiza, 2004, 14(5): 323- 327.
[34] Gai J P, Feng G, Cai X B, Christie P, Li X L. A preliminary survey of the arbuscular mycorrhizal status of grassland plants in southern Tibet. Mycorrhiza, 2006, 16(3): 191- 196.
参考文献:
[4] 梁宇, 郭良栋, 马克平. 菌根真菌在生态系统中的作用. 植物生态学报, 2002, 26(6): 739- 745.
[7] 吴福忠, 包维楷, 吴宁. 外源施氮对干旱河谷白刺花(Sophoradavidii)、幼苗生长、生物量及C、N、P积累与分配的影响. 生态学报, 2008, 28(8): 3817- 3821.
[9] 刘润进, 刘鹏起, 徐坤, 吕志范. 中国盐碱土壤中AM菌的生态分布. 应用生态学报, 1999, 10(6): 721- 724.
[10] 石兆勇, 高双成, 王发园. 荒漠生态系统中丛枝菌根真菌多样性. 干旱区研究, 2008, 25(6): 783- 789.
[11] 宋成军, 马克明, 傅伯杰, 曲来叶, 刘扬, 钟剑飞. 岷江干旱河谷土壤水、氮和磷对小马鞍羊蹄甲幼苗生长的影响. 应用生态学报, 2009, 20(8): 1797- 1804.
[19] 彭思利, 申鸿, 袁俊吉, 魏朝富, 郭涛. 丛枝菌根真菌对中性紫色土土壤团聚体特征的影响. 生态学报, 2011, 31(2): 498- 505.
[20] 蔡晓布, 钱成, 彭岳林, 冯固, 盖京平. 环境因子对西藏高原草地植物丛枝菌根的影响. 应用生态学报, 2005, 16(5): 859- 864.
[26] 赵慧敏. 丛枝菌根真菌的生态分布. 菏泽学院学报, 2007, 29(5): 87- 90.
[27] 秦晓峰. 定西几种旱生植物VA菌根真菌调查. 甘肃科技, 2007, 23(5): 205- 207.
[28] 张英, 郭良栋, 刘润进. 都江堰地区丛枝菌根真菌多样性与生态研究. 植物生态学报, 2003, 27(4): 537- 544.
[29] 林晓民, 李振岐, 韩德俊, 侯军. 菌根与植被恢复. 干旱地区农业研究, 2003, 21(2): 167- 170.
[31] 张燕, 李娟, 姚青, 陈杰忠, 胡又厘, 刘翔宇, 黄永敬. 丛枝菌根真菌对水分胁迫下枇杷实生苗生长和养分吸收的影响. 园艺学报, 2012, 39(4): 757- 762.
ImpactsofarbuscularmycorrhizalfungiandphosphorusongrowthdynamicsofBauhiniafaberiseedlings
SONG Chengjun1, QU Laiye2, MA Keming2,*, FU Bojie2,CHEN Ling1
1KeyLaboratoryOfEnergyResourceUtilizationFromAgriculturalResidues(MOA),InstituteofEnergyandEnvironmentalProtection,ChineseAcademyofAgricultureEngineering,Beijing100125,China2ResearchCentreofEco-environmental,ChineseAcademyofSciences,Beijing100041,China
Arbuscular mycorrhizal (AM) fungi play key roles in ecological restoration and ecological reconstruction of degraded ecosystems in arid and semi-arid lands. Based on the previous results of limiting soil moisture and soil available phosphorus (AP) deficit in the arid valley of Mingjiang River, which is one of the main branches of Yangtze River and located in the north of the Hengduan Mountain Systems, a full factorial and completely random pot experiment in a greenhouse was designed and conducted to understand the influence of two AM fungi (GlomusmosseaeandGlomuscoronatum) on dynamics ofBauhiniafaberiseedling growth. We calculated biomass production and its partitioning, inoculation rate, and mycorrhizal growth response (MGR) across one growth season with two soil AP concentration (P1:6.0 and P2: 24.0 mg P/kg soil). The following results were obtained: (1) Irrespective of both low and high soil AP concentration (6.0 mg/kg and 24.0 mg P /kg soil ), both AM fungi could well colonized root ofB.faberiseedlings. Under two soil AP conditions, growth promotion effects on seedling root, leaf number and biomass production were significantly increased marked when inoculatingB. faberi seedling roots with both AM fungi (G.mosseaeorG.coronatum); (2) inoculation withG.mosseaeorG.coronatumon seedling root significantly impacted on root biomass accumulation and its partitioning (Plt;0.05). However, soil AP did a little effect on biomass accumulation and its partitioning (Pgt; 0.05), the coupling interaction between inoculated with AM fungi and soil AP was obvious (Plt;0.05) by multivariate analysis of variance (MANOVA); (3) The inoculation rate ofG.mosseaeranged from 51% to 71% under low soil AP condition and ranged from 60% to 74% under high soil AP condition, the inoculation rate ofG.coronatumdid from 30% to 31% under low soil AP condition and from 35% to 58% under high soil AP condition. Therefore, seedling inoculated withG.mosseaehad absolutely higher the root length, leaf number, total biomass, inoculation rate, and MGR than those of seedlings inoculated withG.coronatum. The result suggested thatG.mosseaeis the more appropriate host forB.faberiin poor arid environment; (4) MGR ofG.mosseaeandG.coronatumwas marked increasing, Inoculation with AM fungi can decrease the limiting strengthen of soil AP. Moreover, the extent with age of seedlings (both 48 and 86 day) was apparently more stronger than those seedlings of 104 day. However, no significant higher of inoculation rates for both AM fungi under 6.0 and 24.0 mg P/kg soil condition demonstrated that the impacts of soil AP on inoculation rate of AM fungi was weakly. The different abilities of both AM fungi (G.mosseaeorG.coronatum) could improve growth onB.faberiseedling, which indicated that it is important and necessary to select beneficial AM fungi for vegetation restoration practice in multi-resource limiting regions.
degraded ecosystem; arbuscular mycorrhizal fungi; multi-resource limitation; growth dynamics; vegetation restoration
国家自然科学基金资助项目(41101270,31170581)
2013- 06- 06;
2013- 07- 23
*通讯作者Corresponding author.E-mail: mkm@rcees.ac.cn
10.5846/stxb201306061367
宋成军,曲来叶,马克明,傅伯杰,陈羚.AM真菌和磷对小马安羊蹄甲幼苗生长的影响.生态学报,2013,33(19):6121- 6128.
Song C J, Qu L Y, Ma K M, Fu B J,Chen L.Impacts of arbuscular mycorrhizal fungi and phosphorus on growth dynamics ofBauhiniafaberiseedlings .Acta Ecologica Sinica,2013,33(19):6121- 6128.

