短期氮素添加和模拟放牧对青藏高原高寒草甸生态系统呼吸的影响
宗 宁, 石培礼,蔣 婧,熊定鹏,孟丰收,宋明华,张宪洲,沈振西
(1. 中国科学院地理科学与资源研究所生态系统网络观测与模拟重点实验室拉萨高原生态试验站, 北京 100101;2. 中国科学院地理科学与资源研究所生态系统网络观测与模拟重点实验室, 北京 100101; 3. 中国科学院大学, 北京 100049)
短期氮素添加和模拟放牧对青藏高原高寒草甸生态系统呼吸的影响
宗 宁1,3, 石培礼1,*,蔣 婧2, 3,熊定鹏1, 3,孟丰收1, 3,宋明华2,张宪洲1,沈振西1
(1. 中国科学院地理科学与资源研究所生态系统网络观测与模拟重点实验室拉萨高原生态试验站, 北京 100101;2. 中国科学院地理科学与资源研究所生态系统网络观测与模拟重点实验室, 北京 100101; 3. 中国科学院大学, 北京 100049)
氮沉降和放牧是影响草地碳循环过程的重要环境因子,但很少有研究探讨这些因子交互作用对生态系统呼吸的影响。在西藏高原高寒草甸地区开展了外源氮素添加与刈割模拟放牧实验,测定了其对植物生物量分配、土壤微生物碳氮和生态系统呼吸的影响。结果表明:氮素添加显著促进生态系统呼吸,而模拟放牧对其无显著影响,且降低了氮素添加的刺激作用。氮素添加通过提高微生物氮含量和土壤微生物代谢活性,促进植物地上生产,从而增加生态系统的碳排放;而模拟放牧降低了微生物碳含量,且降低了氮素添加的作用,促进根系的补偿性生长,降低了氮素添加对生态系统碳排放的刺激作用。这表明,放牧压力的存在会抑制氮沉降对高寒草甸生态系统碳排放的促进作用,同时外源氮输入也会缓解放牧压力对高寒草甸生态系统生产的负面影响。
氮素添加; 模拟放牧; 生态系统呼吸; 生物量分配; 微生物碳氮; 高寒草甸
氮素是植物生长发育所需的重要元素,氮沉降的迅速增加将对陆地生态系统的生产力和稳定性产生重要影响[1]。一般来说,氮素有效性是限制陆地生态系统生产的重要环境因子[2- 4],特别是氮受限的高寒生态系统。氮沉降的增加会促进陆地生态系统的初级生产[4- 5],降低植物向地下部分的分配[6- 7],进而可能影响植物向土壤微生物的底物供应模式,对生态系统碳平衡过程产生重要影响。一般来说,氮素添加在短期内会加快土壤氮矿化速率,促进生态系统碳排放[8- 10]。但氮沉降对草原生态系统的影响程度同时受人类活动(如放牧)的调控。
放牧是草地生态系统利用管理的重要措施。放牧通过牲畜采食植物地上部分和践踏作用,直接导致土壤呼吸底物供应的降低[11- 12]。同时放牧通过改变植物群落组成与冠层结构[13]、凋落物化学组成[14- 15]、土壤性质[13]等过程对生态系统碳过程产生间接影响。因此,氮素添加与放牧对生态系统碳排放可能呈现相反的作用。本文作者之前的研究发现放牧压力下,氮素添加能补偿土壤养分的降低,促进植物(尤其是地下部分)的补偿性生长[7]。但关于放牧压力下氮沉降增加对高寒生态系统碳排放影响的研究还较少。
高寒草甸是青藏高原主要植被之一,面积约为1.2×106km2,在亚洲中部高寒环境以及世界高寒地区都具有代表性[16]。由于受到气候条件的限制,高寒地区土壤有机质分解缓慢,有效养分匮乏,限制高寒植物的生长[17- 18],故氮沉降的增加可能会对生态系统结构和碳固持产生深刻影响。由此,本研究推测,外源氮素添加可能通过补偿放牧导致的养分减少而刺激植物的补偿性生长及微生物活性,使高寒草甸生态系统碳排放增加。本研究在藏北高寒草甸区,通过外源氮素添加和人工刈割模拟放牧实验,试图回答以下两个科学问题:①高寒草甸生态系统微生物活性与碳排放对外源氮素添加及模拟放牧产生何种响应?②这种响应模式在两种处理的交互作用下有什么改变?综合以上研究内容,本实验试图验证以下假设:放牧压力会降低高寒草甸生态系统CO2排放,而外源氮素添加通过刺激植物的补偿性生长和提高微生物活性而促进生态系统碳排放。本研究对于理解未来氮沉降情景下高寒草甸生态系统生产及碳平衡过程具有重要意义,为退化高寒草甸生态系统恢复治理及管理提供科学依据。
1 研究区概况
研究区选在西藏自治区拉萨市当雄县草原站(91°05′ E, 30°51′ N;海拔4333 m),地处念青唐古拉山的南缘,地形属于丘间盆地,地势平坦。气候属于大陆性高原季风气候,具有太阳辐射强、气温低、日较差大、年较差小的特点。多年平均气温1.3 ℃,最冷月(1月)均温-10.4 ℃,最热月(7月)均温10.7 ℃,气温年较差21.0 ℃。冰冻期3个月(11月至翌年1月)。多年年均降水量476.8 mm,其中85.1%集中在6—8月,年蒸发量1726.7 mm,年平均湿润系数0.28,介于半湿润半干旱之间[19]。
该地区优势植被是以高山嵩草为优势种的高寒草甸,建群种有高山嵩草(Kobresiapygeama)、丝颖针茅(Stipacapillace)、窄叶苔草(Carexmontis-everestii)等,并伴生线叶嵩草(K.capillofolis)、小嵩草(K.parva) 等密丛生莎草及木根香青(Anaphalisxylorhiza)、二裂委陵菜(Potentillabifurca)等杂类草[7]。由于地处湿润区向半干旱区过渡地带,该地区草甸中丝颖针茅所占比例较高,常形成草原化草甸[19]。本地区土壤属于高寒草甸土,结构为砂壤土,有机质含量较为丰富。土壤厚度一般在0.3—0.5 m之间,下层砾石含量较高,最高可达30%。土壤有机质和全氮含量分别为0.9%—2.79%和0.05%—0.19%[19- 20]。
2 材料与方法
2.1 实验设计及处理
氮素添加与模拟放牧样地于2010年7月初布设在植被均一的高寒草甸区,建群种为丝颖针茅、高山嵩草和窄叶苔草,植被盖度约30%—50%[7]。样地采用随机区组设计,共4种处理:对照(CK)、氮素添加(40 kg N hm-2a-1N)、模拟放牧(G)和模拟放牧并氮素添加处理(氮素添加量为40 kg N hm-2a-1NG),每种处理4个重复。实验小区大小为3 m × 3 m,相邻小区之间设置2 m的缓冲隔离带。氮素添加剂量参照中国氮沉降分布格局[21],即西藏地区干湿沉降率为7 kg N hm-2a-1,本实验添加浓度是模拟自然沉降量6倍的情景,也是本地区2050年氮沉降的估计浓度[22]。每年氮素添加分3次进行,参照Bowman等[23]在科罗拉多州高寒草甸的实验处理,前两次氮素添加时间在生长初期(6月初)和生长季旺盛期(8月初),分别为全年添加量的25%;最后一次氮素添加时间在生长末期(9月下旬),添加量为全年的50%[6]。小区内添加的氮素为硝酸铵(NH4NO3,分析纯),每次施肥时首先用水将肥料溶解为溶液,然后用喷壶将溶液均匀洒在小区内。采用人工刈割模拟牲畜放牧,于生长季初(6月初)和生长旺盛期(8月初) 在模拟放牧样地分别剪草1次。每次只选择牲畜可食性的牧草(主要为禾草和莎草两类) 进行刈割,留茬高度为0.5—1.0 cm[24]。将剪掉的地上生物量收集并带回实验室烘干称重, 计算出刈割从样地中共移走了15%—20%的地上生物量。
2.2 样品采集与分析
植物地上生物量采用收获法,一般在刈割后约10 d后进行收获。每个实验小区内随机选取1个0.50 m × 0.50 m的样方,齐地面剪取所有物种的地上部分,剔除枯落物后带回实验室在65 ℃下烘干48 h称重,作为群落地上生物量。植物地下生物量采集采用土柱法,在剪掉地上部分的样方内在四角及中间位置分别用土钻钻取5个土芯(直径为3.7 cm,深度为10 cm),5个土芯合为一个土样。将土样混匀后过2 mm土壤筛,筛出的根系置于100目的土壤筛中,在自来水下反复冲洗干净,去除杂物和死根,将活根装入信封置入65 ℃烘箱烘干48 h至后称重,作为群落地下生物量。筛出的土壤放置于冰柜中冷藏,进行微生物碳、氮的测定。
土壤微生物碳(SMC)、氮(SMN)含量的测定采用氯仿熏蒸-浸提法[25- 26]:用0.5 mol/L K2SO4浸提经过24 h氯仿熏蒸与未熏蒸土样(土水比1 ∶5),抽滤通过0.45 μm滤膜后用有机碳分析仪(Elementar Liqui TOC, Elementar Co., Hanau, Germany)测定浸提液中有机碳,用过硫酸钾氧化-分光光度计比色法测定全氮含量。土壤微生物碳、氮含量以熏蒸与未熏蒸的有机碳、全氮含量之差除以校正系数0.45得到[27- 28]。土壤呼吸速率与土壤微生物碳含量的比值被用于表征土壤微生物代谢活性[27,29]。利用超纯水提取,恒温振荡1 h后抽滤通过0.45 μm滤膜,然后用有机碳分析仪测定溶解性有机碳(DOC)。
2.3 生态系统呼吸与环境因子测定
在2011年和2012年生长季的7—9月测定生态系统呼吸(RE)与土壤呼吸(RS),约每旬测定1次。在每个样方内随机把一个直径为20 cm、长度为5 cm的PVC管用铁锤打入土壤内约3 cm。为避免钻土对CO2释放量的影响,PVC管固定10 d后进行呼吸测定,每种处理测定4个重复。生态系统呼吸及其组分由LICOR- 8100直接测定,测定时间选择在09:00至11:00 (地方时)之间。因研究样地植物矮小,植株全部无损伤地放置在LICOR- 8100呼吸室内测定,不会导致植物的伤害。生态系统呼吸测定结束后齐地面剪掉土壤圈内植物,为减少干扰影响,24 h后进行土壤呼吸的测定[30]。剪掉的植物于65 ℃下烘干48 h至恒重,作为相应的地上生物量。
2.4 实验数据的处理与分析
采用重复测定分析方法研究氮素添加与模拟放牧处理对生态系统CO2排放的影响,采用Oneway ANOVA与Duncan′s test分别分析氮素添加与模拟放牧样地植物群落生态系统CO2排放、植物生物量分配、土壤微生物碳氮与活性的差异,利用线性回归方法分析生态系统CO2排放与植物生物量、微生物活性等因子之间的关系。显著性水平Plt;0.05。所有统计分析均在SPSS16.0 (SPSS for Windows, Version 16.0, Chicago, USA)中进行。
3 结果
3.1生态系统CO2排放对氮素添加及模拟放牧的响应
生态系统呼吸和土壤呼吸呈单峰曲线,2011年和2012年峰值均出现在8月中旬(图1)。氮素添加(N)及模拟放牧(G)对RE及其RS的影响年际之间无差异(表1,Pgt;0.05)。N添加显著促进RE和RS,且在生长季旺盛期影响最显著,而在生长初期及末期均无显著影响(图1)。2011年和2012年8月,N处理的RE分别比与对照提高了82%和72%(Plt;0.01),RS分别提高了53%和65%(Plt;0.05)。可见,RE的增加不仅由于RS的增加,还由于地上植物呼吸增加导致。模拟放牧及放牧压力下氮素添加(NG)均未显著改变RE、RS(图1),N添加对生态系统呼吸的促进作用被放牧压力所抵消(图1)。
表1氮素添加与模拟放牧对生态系统呼吸与土壤呼吸重复测定分析结果
Table1Ecosystemrespiration(RE)andsoilrespiration(RS)fromrepeated-measure(ANOVA)usingmeasuringdateasrepeated-measures,conductedin2011and2012.FandPmeanFvalueofANOVAresultandstatisticalsignificance,respectively
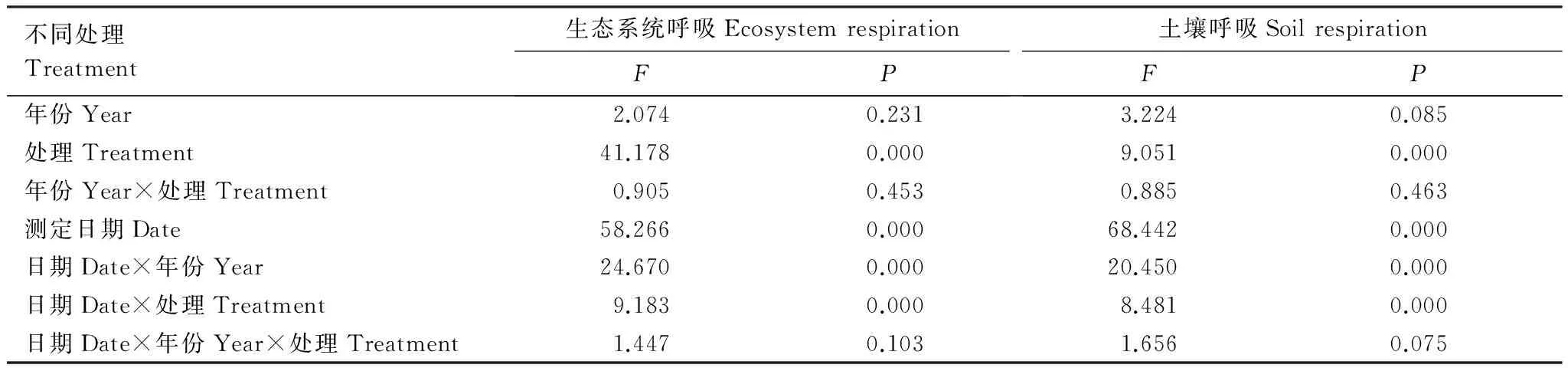
不同处理Treatment生态系统呼吸EcosystemrespirationFP土壤呼吸SoilrespirationFP年份Year2.0740.2313.2240.085处理Treatment41.1780.0009.0510.000年份Year×处理Treatment0.9050.4530.8850.463测定日期Date58.2660.00068.4420.000日期Date×年份Year24.6700.00020.4500.000日期Date×处理Treatment9.1830.0008.4810.000日期Date×年份Year×处理Treatment1.4470.1031.6560.075
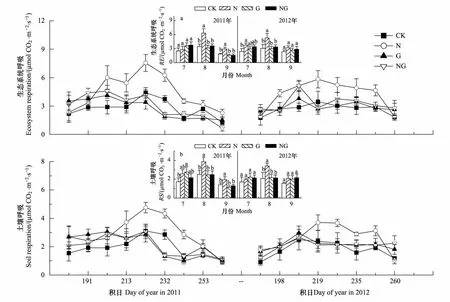
图1 氮素添加与模拟放牧对高寒草甸生态系统呼吸及土壤呼吸季节动态的影响Fig.1 Seasonal variations of RE and RS under four different treatments in 2011 and 2012Vertical bars represent the standard error of the mean (n=4); C: control plots (solid square); N: N addition (open circle); G: simulating grazing (solid triangle); NG: N addition and simulating grazing (open triangle); CK: 对照;N: 氮素添加;G: 模拟放牧;NG: 氮素添加+模拟放牧; 不同字母间表示差异显著
3.2 地上、地下生物量对氮素添加及模拟放牧的响应
氮素添加促进地上生物量增加,而放牧压力下氮素添加(NG)显著促进植物地下生产。2011年生长季初期,氮素添加对地上生物量无显著影响,而模拟放牧和NG处理加均显著促进地上生物量增加;但在2012年生长季初期,氮素添加促进了植物地上植物生物量,而模拟放牧对其无显著影响。生长季旺盛期,2011年和2012年生长季氮素添加分别提高了82%和84%的地上生物量(图2,Plt;0.01),而模拟放牧对生物量无影响,NG在2012年提高了28%的地上生物量(图2,Plt;0.05)。在生长季末期,氮素添加促进地上生物量增加,而模拟放牧对地上生物量呈现抑制作用(图2,Plt;0.05)。NG对地下生物量影响较大,在2011年(生长初期121%,生长旺盛期127%,生长末期103%)与2012年(生长初期57%,生长旺盛期116%,生长末期82%)均有显著的促进作用(图2 C和D,Plt;0.01)。氮素添加处理仅在2011年生长初期及2012年生长末期促进植物地下生物量(图2,Plt;0.05)。而模拟放牧处理对地下生物量没有影响(图2)。
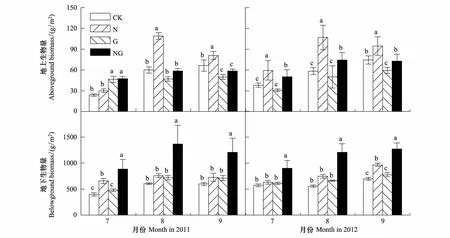
图2 氮素添加与模拟放牧对高寒草甸植物地上-地下生物量的影响Fig.2 Aboveground (AGB) and belowground biomass (BGB) under four different treatments in 2011 and 2012
3.3 土壤微生物碳、氮、代谢活性及溶解性有机碳对氮素添加及模拟放牧的响应

图3 氮素添加与模拟放牧对高寒草甸土壤微生物碳氮、代谢活性及溶解性有机碳的影响Fig.3 Soil microbial biomass C (SMC), N (SMN), soil microbial activity (RS/SMC) and dissolved organic C (DOC) under four different treatments in 2011
模拟放牧降低土壤微生物碳含量,对微生物氮含量无显著影响;氮素添加对微生物碳含量无显著影响,而提高了微生物氮含量以及微生物活性。模拟放牧在生长初期对土壤微生物碳无显著影响;在生长旺盛期,与氮添加处理相比较,放牧压力下无氮素添加与氮素添加处理分别降低了37%和39%的土壤微生物碳(图3,Plt;0.05)。氮素添加在生长初期和末期分别提高了39%和43%的微生物氮(Plt;0.05),在生长旺盛期无显著影响(Pgt;0.05)。模拟放牧在整个生长季节对土壤微生物氮均无显著影响,放牧压力下氮素添加只在生长季末期显著提高了47%微生物氮(图3,Plt;0.05)。氮素添加刺激微生物活性,主要表现在生长季前期和旺盛期;模拟放牧有降低微生物活性的趋势,主要差异表现在生长末期;在生长季初期,放牧压力下氮素添加的微生物代谢活性是对照处理的2.6倍(图3,Plt;0.05),而在生长季后期降低了49%的土壤微生物代谢活性(Plt;0.05)(图3)。氮素添加对微生物活性的影响主要表现在生长季前期;而放牧压力在生长季后期对微生物的影响更大,对微生物碳和微生物代谢活性都有降低作用。氮素添加在生长季初期和末期分别提高了32%和29%的溶解性有机碳(图3,Plt;0.05),放牧压力下氮素添加在生长季初期和末期显著提高了24%和43%溶解性有机碳(图3 D,Plt;0.05),而模拟放牧对溶解性有机碳无影响。
3.4调控生态系统CO2排放与主要环境因子
生态系统呼吸季节动态受到植物地上生产的影响(Plt;0.05),而土壤呼吸受植物地上与地下生产的共同控制,地上与地下生物量分别能解释土壤呼吸变异10.8%与10.1%(图4,Plt;0.05)。而生态系统呼吸受溶解性有机碳的影响更大,溶解性有机碳分别能解释生态系统呼吸和土壤呼吸31.1%和7.8%的变异(图4,Plt;0.05),这说明氮素添加与模拟放牧通过影响呼吸底物和微生物代谢活性而对生态系统碳排放产生影响,且这种影响比植物生产分配改变的影响更大。
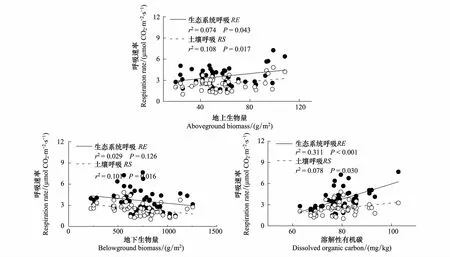
图4 生态系统呼吸、土壤呼吸与植物地上、地下生物量之间的关系Fig.4 Dependence of ecosystem respiration (RE, solid circle) and soil respiration (RS, open circle) on plant aboveground biomass (AGB) and belowground biomass (BGB) in 2011and 2012
土壤微生物代谢活性与植物地上、地下生物量无显著相关关系(图5),而分析发现生长季初期和旺盛期氮素添加显著提高了土壤微生物代谢活性,这说明土壤微生物代谢活性的改变是由氮素添加与模拟放牧直接作用的结果,而不是植物生物量分配格局的改变引起的。氮素添加与模拟放牧对土壤微生物活性的直接作用是生态系统呼吸季节格局改变的主要因素。此外相关分析发现,土壤溶解性有机碳含量受地上生物量影响较大,地上生物量能解释其变异的45.6%(图5,Plt;0.001),而地下生物量对土壤溶解性有机碳含量无影响(图5,Pgt;0.05)。这表明氮素添加及模拟放牧通过影响影响植物光合产物而对生态系统碳排放产生影响,模拟放牧对根系的补偿性生长对生态系统碳排放的影响较小。
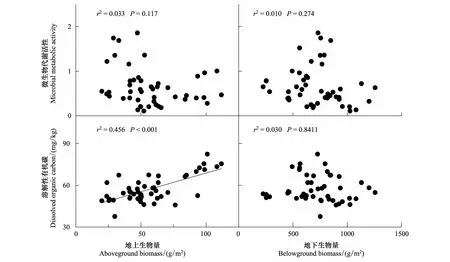
图5 土壤微生物活性、溶解性有机碳含量与植物地上、地下生产之间的关系Fig.5 Dependence of soil microbial activity (RS/SWC) and dissolved organic C (DOC)on plant aboveground and belowground biomass in 2011
5 讨论
研究结果发现,氮素添加通过对土壤微生物活性和植物地上生产的直接刺激作用来促进高寒草甸生态系统碳排放;模拟放牧有降低地上生产的趋势,但对生态系统碳排放无显著影响,且降低了氮素添加对生态系统碳排放的刺激作用;外源氮素添加对养分的补充显著促进放牧压力下植物的地下生产。
5.1 氮素添加对高寒生态系统碳排放的影响
高寒草甸是受氮素限制的生态系统,氮素添加显著提高了植物地上生产,这在很多生态系统的控制实验中已经发现[31- 33]。这一方面是因为外源氮输入能迅速提高土壤中植物可利用氮的含量,导致植物叶片氮含量的提高及光合作用的增强[6];另一方面氮素添加还会刺激土壤氮矿化作用[7,34- 35],刺激土壤中原来有机质的分解,氮素循环速率的加快会增加土壤中植物可利用养分含量,从而促进植物的生产[7]。此外,在受氮素限制的高寒生态系统,氮素添加会促进禾草植物的生长[17,36],氮添加消除了生态系统养分的限制,养分利用效率较高的禾草植物迅速生长,改变了植物竞争格局,使物种间的竞争从地下养分的竞争转向地上光竞争,光竞争能力的强弱是决定生态系统物种组成与群落结构改变的重要原因[37- 38]。同时,氮素添加会促进植物分蘖、分枝,且能增加牧草的根系数量、分布深度和再生能力[37],使单位面积生产力大幅增加。植物生产力的提高意味着更高的植物生长与维持呼吸[39]以及向地下更多的光合产物输入[40]。本研究发现氮素添加在2011年和2012年生长季分别提高了82%和84%的地上生物量,而植物地上部分光合产物是调控生态系统呼吸与土壤呼吸的重要因素(图4),氮素添加导致植物生产的提高,从而导致光合产物增加,这是生态系统碳排放增加的重要原因。
在退化的生态系统,伴随着植物丰富度降低、生产力下降和土壤性质的恶化,土壤微生物的组成与结构也遭到破坏[41]。土壤微生物活性即基础呼吸与微生物碳含量的比值,它将微生物生物量的大小与微生物的生物活性和功能有机地联系起来,是反映环境因素、管理措施等变化对微生物活性影响的一个敏感指标[27,30]。本研究发现,氮素添加提高了土壤微生物氮含量及其活性,且对土壤微生物活性的提高主要表现在生长季前期和旺盛期,这是由于生长季前期和旺盛期植物生长发育较快,导致土壤中氮素被植物大量吸收[7],故外源氮素在生长季前期和旺盛期添加会对氮素的降低产生补偿作用,而对土壤微生物活性产生刺激作用。此外,氮素添加会直接改善土壤限制养分状况,增加根际和非根际土壤微生物量碳和水溶性有机碳的含量[42],并导致根际微生物数量的增加[43]。同时,氮素添加会促进植物生长,并为微生物生长提供充足的碳源,使土壤微生物量显著提高[44]。虽然植物生产的提高会向土壤微生物提供更多的光合产物[11- 12],但土壤微生物活性的提高更大程度依赖于氮素添加直接的刺激作用。同时,土壤微生物活性与生态系统碳循环过程密切相关,因为土壤微生物呼吸是生态系统碳排放的主要来源和重要组分[45- 48],故外源氮输入导致的土壤微生物活性的刺激作用是高寒草甸生态系统碳排放增加另一重要因素。
5.2 放牧对高寒生态系统碳排放的影响
放牧作为草地生态系统最主要的利用方式,对草地生态系统的影响是多方面的,是影响草地碳循环的重要因素。模拟放牧通过刈割的方式[24,49- 50],排除了动物排便等造成的异质性,从而排除牲畜排泄物对实验结果的额外施肥干扰。与我们假设不一致的是虽然模拟放牧通过刈割处理移走了15%—20%的地上生物量,但与对照处理比较发现植物地上生产的降低并不显著,且未显著改变生态系统碳排放模式,这与Zhou等[51]和Jia等[33]研究结果一致。这是由于高寒草甸植物存在补偿性生长[7,52- 53],这种补偿机制的存在对于维持高寒草甸生态系统生产与碳循环的稳定性具有重要意义。在不放牧处理氮素添加主要刺激植物地上部分生长,而在放牧压力下氮素添加促进了植物地下生物量的增加,而总生物量无差异[7],这说明高寒植物对放牧存在补偿性生长,而氮素添加作用下会刺激这种补偿作用。模拟放牧只在生长初期和旺盛期来临前进行,放牧压力解除后植物通过自身的补偿机制逐渐恢复组织的功能[54],尤其在氮素添加条件下,植物可以稳定地维持生产能力[55]。氮素添加会促进土壤氮矿化作用[7],氮素循环速率的加快反过来会增加土壤中植物可利用养分含量,改变植物地上地下光合产物分配模式[56]。
本研究还发现,在生长季后期模拟放牧降低了土壤微生物碳含量,而在生长季前期和旺盛期显著降低了土壤微生物代谢活性。在草地生态系统中,家畜放牧通过采食、践踏及排泄物直接影响土壤[57],不同强度的放牧会改变土壤环境及养分平衡。研究发现,放牧处理降低土壤微生物数量、土壤脲酶和过氧化氢酶的活性,尤其在重牧压力下更甚[58]。放牧会降低地表植被盖度、破坏土壤结构,降低土壤养分和微生物活性[58]。在生长季旺盛期以后,植物现存生物量较高,且光合能力强,对土壤呼吸底物的供应较多,此时进行模拟放牧会导致植物地上生物量的降低,并直接减少对土壤微生物的底物供应。土壤微生物呼吸是生态系统碳排放的重要来源,模拟放牧导致的底物供应的减少会直接降低生态系统碳排放。虽然模拟放牧压力下氮素添加处理显著提高了植物地下生物量,但分析发现地下生物量与生态系统呼吸无显著相关关系,这与之前的研究结果相同[30],这表明植物地上生物量是控制生态系统呼吸与土壤呼吸变化更重要的因子。
氮素添加通过养分的外源输入刺激了高寒植物的补偿性生长,放牧压力的存在使得植物将更多的光合产物分配到地下,导致群落地下生物量的显著提高(图2)。与单独氮素添加处理相比较,模拟放牧降低了氮素添加对生态系统碳排放的促进作用。生态系统中的CO2排放很大一部分来自于最新固定的碳[30],放牧通过牲畜采食植物地上部分,直接导致植物向土壤呼吸底物供应的降低[11- 12]和凋落物输入的减少[59- 60],而氮素添加对植物生产和微生物活性的刺激作用部分抵消了模拟放牧对土壤微生物呼吸底物供应的减少。
6 结论
综上所述,短期氮素添加提高了土壤微生物活性和高寒草甸植物地上生产,植物地上部分生产的提高为生态系统呼吸提供了更多的呼吸底物,这种促进作用直接导致高寒草甸生态系统碳排放的增加。放牧压力下氮素添加刺激了高寒草甸植物的根系的补偿性生长,促进植物的地下生产,但放牧降低了氮素添加对生态系统碳排放的促进作用。因此,高寒草甸地区放牧压力的存在会抑制未来大气氮沉降对高寒草甸生态系统碳排放的促进作用,而外源氮输入的增加会促进放牧压力下植物的补偿性生长,缓解放牧压力对高寒草甸生态系统生产的负面影响。
[1] Van Breemen N. Nitrogen cycle: natural organic tendency. Nature, 2002, 415(6870): 381- 382.
[2] Burke I C, Lauenroth W K, Parton W J. Regional and temporal variation in net primary production and nitrogen mineralization in grasslands. Ecology, 1997, 78(5): 1330- 1340.
[3] Tilman D, Wedin D, Knops J. Productivity and sustainability influenced by biodiversity in grassland ecosystems. Nature, 1996, 379(6567): 718- 720.
[4] LeBauer D S, Treseder K K. Nitrogen limitation of net primary productivity in terrestrial ecosystems is globally distributed. Ecology, 2008, 89(2): 371- 379.
[5] Neff J C, Townsend A R, Gleixner G, Lehman S J, Turnbull J, Bowman W D. Variable effects of nitrogen additions on the stability and turnover of soil carbon. Nature, 2002, 419(6910): 915- 917.
[6] Reynold J F, Thornley J N M. A shoot: root partitioning model. Annual of Botany, 1982, 49(5): 585- 597.
[7] Zong N, Shi P L, Song M H, Lin L, Ma W L, Jiang J, Fu G, He Y T, Zhang X Z. Clipping alters the Response of biomass allocation pattern under nitrogen addition in an alpine meadow on the Tibetan Plateau. Journal of Natural Resources, 2012, 27(10): 1696- 1707.
[8] Butnor J R, Johnsen K H, Oren R, Katul G G. Reduction of forest floor respiration by fertilization on both carbon dioxide-enriched and reference 17-year-old loblolly pine stands. Global Change Biology, 2003, 9(6): 849- 861.
[9] Bowden R D, Davidson E, Savage K, Arabia C, Steudler P. Chronic nitrogen additions reduce total soil respiration and microbial respiration in temperate forest soils at the Harvard Forest. Forest Ecology and Management, 2004, 196(1): 43- 56.
[10] Burton A J, Pregitzer K S, Crawford J N, Zogg G P, Zak D R. Simulated chronic NO3-deposition reduces soil respiration in northern hardwood forests. Global Change Biology, 2004, 10(7): 1080- 1091.
[11] Craine J M, Wedin D A, Chapin F S III. Predominance of ecophysiological controls on soil CO2flux in a Minnesota grassland. Plant and Soil, 1999, 207(1): 77- 86.
[12] Wan S Q, Luo Y Q. Substrate regulation of soil respiration in a tallgrass prairie: Results of a clipping and shading experiment. Global Biogeochemical Cycles, 2003, 17(2), 1054, doi: 10.1029/2002GB001971.
[13] Luo Y Q, Zhou X H. Soil Respiration and the Environment. London: Academic Press.
[14] Bremer J D, Ham J M, Owensby C E, Knapp A K. Responses of soil respiration to clipping and grazing in a tallgrass prairie. Journal of Environmental Quality, 1998, 27(6): 1539- 1548.
[15] Wilsey B J, Parent G, Roulet N T, Moore T R, Potvin C. Tropical pasture carbon cycling: relationships between C source/sink strength, above-ground biomass and grazing. Ecology Letters, 2002, 5(3): 367- 376.
[16] Xu L L, Zhang X Z, Shi P L, Yu G Y. The apparent quantum yield and the apparent maximum photosynthetic rate in the alpine meadow on Tibet Plateau. Science in China Series D: Earth Sciences,2004,34( SupplementⅡ) : 125- 130.
[17] Bowman W D, Theodose T A, Schardt J C, Conant R T. Constraints of nutrient availability on primary production in two alpine tundra communities. Ecology, 1993, 74(7): 2085- 2097.
[18] Cao G M, Zhang J X. Soil nutrition and substance cycle of Kobresia meadow//Zhou X M, ed. Chinese Kobresia Meadows. Science, Beijing, 2001: 58- 147.
[19] Shi P L, Sun X M, Xu L L, Zhang X Z, He Y T, Zhang D Q, Yu G R. Net ecosystem CO2exchange and controlling factors in a steppe-Kobresiameadow on the Tibetan Plateau. Science in China Series D: Earth Sciences, 2006, 49(S2): 207- 218.
[20] Zhang D Q, Shi P L, He Y T, Xu L L, Zhang X Z, Zhong Z M. Quantification of soil heterotrophic respiration in the growth period of alpine steppe-meadow on the Tibetan Plateau. Journal of Natural Resources, 2006, 21(3): 458- 464.
[21] Lü C Q, Tian H Q. Spatial and temporal patterns of nitrogen deposition in China: Synthesis of observational data. Journal of Geophysical Research, 2007, 112(D22), doi: 10.1029/2006JD007990.
[22] Galloway J N, Dentener F J, Capone D G, Boyer E W, Howarth R W, Seitzinger S P, Asner G P, Cleveland C C, Green P A, Holland E A, Karl D M, Michaels A F, Porter J H, Townsend A R, Vöosmarty C J. Nitrogen cycles: past, present, and future. Biogeochemistry, 2004, 70(2): 153- 226.
[23] Bowman W D, Gartner J R, Holland K, Wiedermann M. Nitrogen critical loads for alpine vegetation and terrestrial ecosystem response: Are we there yet? Ecological Applications, 2006, 16(3): 1183- 1193.
[24] Julia A K, John H, Zhao X Q. Experimental warming causes large and rapid species loss, dampened by simulated grazing, on the Tibetan Plateau. Ecology Letters, 2004, 7(12): 1170- 1179.
[25] Brookes P C, Landman A, Pruden G, Jenkinson D S. Chloroform fumigation and the release of soil nitrogen: a rapid direct extraction method to measure microbial biomass nitrogen in soil. Soil Biology and Biochemistry, 1985, 17(6): 837- 842.
[26] Vance E D, Brookes P C, Jenkinson D S. An extraction method for measuring soil microbial biomass C. Soil Biology and Biochemistry, 1987, 19(6): 703- 707.
[27] Xu Z F, Hu R, Xiong P, Wan C, Cao G, Liu Q. Initial soil responses to experimental warming in two contrasting forest ecosystems, Eastern Tibetan Plateau, China: nutrient availabilities, microbial properties and enzyme activities. Applied Soil Ecology, 2010, 46(2): 291- 299.
[28] Fu G, Shen Z X, Zhang X Z, Zhou Y T, Zhang Y J. Response of microbial biomass to grazing in an alpine meadow along an elevation gradient on the Tibetan Plateau. European Journal of Soil Biology, 2012, 52: 27- 29.
[29] Schindlbacher A, Rodler A, Kuffner M, Kitzler B, Sessitsch A, Zechmeister-Boltenstern S. Experimental warming effects on the microbial community of a temperate mountain forest soil. Soil Biology and Biochemistry, 2011, 43(7): 1417- 1425.
[30] Jiang J, Zong N, Song M H, Shi P L, Ma W L, Fu G, Shen Z X, Zhang X Z, Ouyang H. Responses of ecosystem respiration and its components to fertilization in an alpine meadow on the Tibetan Plateau. European Journal of Soil Biology, 2013, 56: 101- 106.
[31] Carreiro M M, Sinsabaugh R L, Repert D A, Parkhurst D F. Microbial enzyme shifts explain litter decay responses to simulated nitrogen deposition. Ecology, 2000, 81(9): 2359- 2365.
[32] Xu W H, Wan S Q. Water- and plant-mediated responses of soil respiration to topography, fire, and nitrogen fertilization in a semiarid grassland in northern China. Soil Biology Biochemistry, 2008, 40(3): 679- 687.
[33] Jia X X, Shao M A, Wei X R. Responses of soil respiration to N addition, burning and clipping in temperate semiarid grassland in northern China. Agricultural and Forest Meteorology, 2012, 166- 167: 32- 40.
[34] Loiseau P, Soussana J F. Effects of elevated CO2, temperature and N fertilization on nitrogen fluxes in a temperate grassland ecosystem. Global Change Biology, 2000, 6(8): 953- 965.
[35] Zhang L, Huang J H, Bai Y F, Han X G. Effects of nitrogen addition on net nitrogen mineralization inLeymuschinensisgrassland, Inner Mongolia, China. Chinese Journal of Plant Ecology, 2008, 33(3): 563- 569.
[36] Bowman W D. Accumulation and use of nitrogen and phosphorus following fertilization in two alpine tundra communities. Oikos, 1994, 70(2): 261- 270.
[37] Chen W Y, Zhao M, Li G Y, Wei Q, Wang F, Liu Z H, Zhu L, Zhang J Q, Sun F D. The influence of different types of fertilizer application level on the Gannan desertification of alpine meadow of plant characteristics and the productive forces. Journal of Natural Resources, 2012, 27(2): 254- 267.
[38] Li L J, Yu Z Y, Zeng D R, Ai G Y, Mao R. Effects of fertilizations on species composition and diversity of grassland in Keerqin sandy lands. Acta Prataculturae Sinica, 2010, 19(2): 109- 115.
[39] Flanagan L B, Johnson B G. Interacting effects of temperature, soil moisture and plant biomass production on ecosystem respiration in a northern temperate grassland. Agricultural and Forest Meteorology, 2005, 130(3/4): 237- 253.
[40] Li Y L, Tenhunen J, Owen K, Schmitt M, Bahn M, Droesler M, Otieno D, Schmidt M, Gruenwald T, Hussain M Z, Mirzae H, Bernhofer C. Patterns in CO2gas exchange capacity of grassland ecosystems in the Alps. Agricultural and Forest Meteorology, 2008, 148(1): 51- 68.
[41] Zhang Y D, Sun Z H, Shen Y X. Effect of fertilization on soil microorganism of deteriorated grassland in dry-hot valley region of Jinsha River. Journal of Soil and Water Conservation, 2005, 19(2): 88- 91.
[42] Ren W D, Jia L J, Wang L L, Li J, Yang X Y. Seasonal dynamics of soil microbial biomass carbon and water soluble organic carbon in bulk and rhizospheric soils under long-term fertilization regimes in Loess soil. Acta Agriculturae Boreali-Occidentalis Sinica, 2011, 20(12): 145- 151.
[43] Jia Z H, Sun M, Yang Z P, Miao G Y. Influence of different fertilizers to crop rhizosphere microorganisms. Acta Agronomica Sinica, 2004, 30(5): 491- 495.
[44] Li G H. Effect of organic amendments and chemical fertilizer on soil microbial activity, biomass and community structure. Chinese Agricultural Science Bulletin, 2010, 26(14): 204- 208.
[45] Hanson P J, Edwards N T, Garten C T, Andrews J A. Separating root and soil microbial contributions to soil respiration: A review of methods and observations. Biogeochemistry, 2000, 48(1): 115- 146.
[46] Illeris L, Michelsen A, Jonasson S. Soil plus root respiration and microbial biomass following water, nitrogen, and phosphorus application at a high arctic semi desert. Biogeochemistry, 2003, 65(1): 15- 29.
[47] Bond-Lamberty B, Wang C K, Gower S T. Contribution of root respiration to soil surface CO2flux in a boreal black spruce chronosequence. Tree Physiology, 2004, 24(12): 1387- 1395.
[48] Millard P, Midwood A J, Hunt J E, Whitehead D, Boutton T W. Partitioning soil surface CO2efflux into autotrophic and heterotrophic components, using natural gradients in soil δ13C in an undisturbed savannah soil. Soil Biology and Biochemistry, 2008, 40(7): 1575- 1582.
[49] Lin X W, Zhang Z H, Wang S P, Hu Y G, Xu G P, Luo C Y, Chang X F, Duan J C, Lin Q Y, Xu B, Wang Y F, Zhao X Q, Xie Z B. Response of ecosystem respiration to warming and grazing during the growing seasons in the alpine meadow on the Tibetan plateau. Agricultural and Forest Meteorology, 2011, 151(7): 792- 802.
[50] Wang S P, Duan J C, Xu G P, Wang Y F, Zhang Z H, Rui Y C, Luo C Y, Xu B, Zhu X X, Chang X F, Cui X Y, Niu H S, Zhao X Q, Wang W Y. Effects of warming and grazing on soil N availability, species composition, and ANPP in an alpine meadow. Ecology, 2012, 93(11): 2365- 2376.
[51] Zhou X H, Sherry R A, An Y, Wallace L L, Luo Y Q. Main and interactive effects of warming, clipping, and doubled precipitation on soil CO2efflux in a grassland ecosystem. Global Biogeochemical Cycles, 2006, 20(1), GB1003, doi: 10.1029/2005GB002526.
[52] Alward R D, Joern A. Plasticity and overcompensation in grass responses to herbivory. Oecologia, 1993, 95(3): 358- 364.
[53] van der Graaf A J, Stahl J, Bakker J P. Compensatory growth ofFestucarubraafter grazing: can migratory herbivores increase their own harvest during staging? Functional Ecology, 2005, 19(6): 961- 969.
[54] Yuan B Z, Wang J, Zhao S L, Sun J. An approach to the mechanism of plant compensation. Chinese Journal of Ecology, 1998, 17(5): 45- 49.
[55] Zhao W. Physio-ecological Responses ofLeymuschinensisto Overgrazing and Clipping [D]. Beijing: Institute of Botany, the Chinese Academy of Sciences, 2006.
[56] Zhang X N. Responses of Community and Major Plant Species to Nitrogen Addition and Clipping in Typical Steppe of Inner Mongolia [D]. Beijing: Institute of Botany, the Chinese Academy of Sciences, 2009.
[57] Cao S B, Liu Q W, Wang L Q, Wang H R, Wang J Y. Effect of short-term grazing on soil microorganisms and soil enzyme activities in Meadow Steppe. Microbiology, 2012, 39(6): 741- 748.
[58] Yan R R, Yan Y C, Xin X P, Yang G X, Wang X, Zhang B H. Changes in microorganisms and enzyme activities in soil under different grazing intensities in meadow steppe, Inner Mongolia. Ecology and Environmental Sciences, 2011, 20(2): 259- 265.
[59] Stark S, Strömmer R, Tuomi J. Reindeer grazing and soil microbial processes in two suboceanic and two subcontinental tundra heaths. Oikos, 2002, 97(1): 69- 78.
[60] Eilersten S M, Schjelderup I, Mathiesen S D. Early season grazing effects on birch, grass, herbs and plant litter in coastal meadows used by reindeer: a short-term case study. Rangifer, 2002, 22(2): 123- 131.
参考文献:
[7] 宗宁, 石培礼, 宋明华, 林琳, 马维玲, 蔣婧, 付刚, 何永涛, 张宪洲. 模拟放牧改变了氮添加作用下高寒草甸生物量的分配模式. 自然资源学报, 2012, 27(10): 1696- 1707.
[16] 徐玲玲, 张宪洲, 石培礼, 于贵瑞. 青藏高原高寒草甸生态系统表观量子产额和表观最大光合速率的确定. 中国科学(D辑: 地球科学), 2004, 34( SⅡ): 125- 130.
[18] 曹广民, 张金霞. 嵩草草甸的土壤营养及其物质循环 // 周兴民主编. 中国嵩草草甸. 北京: 科学出版社, 2001: 58- 147.
[20] 张东秋, 石培礼, 何永涛, 徐玲玲, 张宪洲, 钟志明. 西藏高原草原化小嵩草草甸生长季土壤微生物呼吸测定. 自然资源学报, 2006, 21(3): 458- 464.
[35] 张璐, 黄建辉, 白永飞, 韩兴国. 氮素添加对内蒙古羊草草原净氮矿化的影响. 植物生态学报, 2008, 33(3): 563- 569.
[37] 陈文业, 赵明, 李广宇, 魏强, 王芳, 刘振恒, 朱丽, 张继强, 孙飞达. 不同类型施肥水平对甘南沙化高寒草甸植物群落特征及生产力的影响. 自然资源学报, 2012, 27(2): 254- 267.
[38] 李禄军, 于占源, 曾德荣, 艾桂艳, 毛瑢. 施肥对科尔沁沙质草地群落物种组成和多样性的影响. 草业学报, 2010, 19(2): 109- 115.
[41] 张彦东, 孙志虎, 沈有信. 施肥对金沙江干热河谷退化草地土壤微生物的影响. 水土保持学报, 2005, 19(2): 88- 91.
[42] 任卫东, 贾莉洁, 王莲莲, 李婕, 杨学云. 长期施肥对小麦、玉米根际和非根际土壤微生物量碳及水溶性有机碳含量的影响. 西北农业学报, 2011, 20(12): 145- 151.
[43] 贾志红, 孙敏, 杨珍平, 苗果园. 施肥对作物根际微生物的影响. 作物学报, 2004, 30(5): 491- 495.
[44] 李桂花. 不同施肥对土壤微生物活性、群落结构和生物量的影响. 中国农学通报, 2010, 26(14): 204- 208.
[54] 原保忠, 王静, 赵松岭, 孙颉. 植物补偿作用机制探讨. 生态学杂志, 1998, 17(5): 45- 49.
[55] 赵威. 羊草对过度放牧和刈割的生理生态响应 [D]. 北京: 中国科学院植物研究所, 2006.
[56] 张晓娜. 内蒙古典型草原群落和主要植物种对氮素添加和刈割干扰的响应 [D]. 北京: 中国科学院植物研究所, 2009.
[57] 曹淑宝, 刘全伟, 王立群, 王浩然, 王婧瑶. 短期放牧对草甸草原土壤微生物与土壤酶活性的影响. 微生物学通报, 2012, 39(6): 741- 748.
[58] 闫瑞瑞, 闫玉春, 辛晓平, 杨桂霞, 王旭, 张保辉. 不同放牧梯度下草甸草原土壤微生物和酶活性研究. 生态环境学报, 2011, 20(2): 259- 265.
Interactiveeffectsofshort-termnitrogenenrichmentandsimulatedgrazingonecosystemrespirationinanalpinemeadowontheTibetanPlateau
ZONG Ning1, 3, SHI Peili1, *, JIANG Jing2, 3, XIONG Dingpeng1, 3, MENG Fengshou1,3, SONG Minghua2, ZHANG Xianzhou1, SHEN Zhenxi1
1LhasaNationalEcologicalResearchStation,KeyLaboratoryofEcosystemNetworkObservationandModelling,InstituteofGeographicSciencesandNaturalResourcesResearch,ChineseAcademySciences,Beijing100101,China2KeyLaboratoryofEcosystemNetworkObservationandModeling,InstituteofGeographicSciencesandNaturalResourcesResearch,ChineseAcademySciences,Beijing100101,China3UniversityofChineseAcademyofSciences,Beijing100049,China
Both nitrogen (N) deposition and livestock grazing are important factors influencing species composition, soil nutrient availability, plant productivity and allocation pattern in grassland ecosystems. However, little is known about their interactive effects on alpine ecosystem carbon cycling process such as ecosystem respiration. In 2010 we started a long-term factorial experiment in an alpine meadow in Damxung County in northern Tibet, China, to examine the interactive effects of N addition and grazing on plant biomass allocation, soil microbial carbon and N and ecosystem CO2fluxes. The experiment had two N treatments crossed with two grazing treatments, resulting in a total of four treatments coded as CK (control, no N addition and no simulated grazing), N (with N addition but no grazing), G (no N addition but with grazing) and NG (with both N addition and grazing). For N addition, we added 40 kg N hm-2a-1, and to simulate livestock grazing, we selectively clipped palatable grasses and sedges. We analyzed the available data collected during the growing seasons in 2011 and 2012. Compared with CK, N significantly increased ecosystem respiration by 82% and 72% and soil respiration by 53% and 65% in August 2011 and 2012, respectively, but G had no significant effect on ecosystem respiration or soil respiration. Moreover, ecosystem respiration or soil respiration did not differ significantly between CK and NG, indicating that simulated grazing partially counteracted the stimulating effect of N addition on ecosystem CO2fluxes. Compared to CK, N addition stimulated plant aboveground growth by 82 % and 84 % in August 2011 and 2012, respectively, NG promoted plant root compensatory growth and increased plant allocation to belowground by 127 % and 116 % in August 2011 and 2012, respectively, and G had no effect on belowground biomass. G inhibited soil microbial carbon and did not affect soil microbial N, while N addition increased soil microbial N and soil microbial metabolic activity. Furthermore, compared to CK, both N and NG treatments increased dissolved organic carbon, while G had no such an effect. The correlation analysis showed that ecosystem respiration and soil respiration were mainly controlled by soil microbial metabolic activity and dissolved organic carbon. Additionally, aboveground biomass was significantly correlated with dissolved organic carbon but not with soil microbial metabolic activity. These results suggest that N addition promotes ecosystem respiration and soil respiration directly by the stimulating effects on soil microbial metabolic activity and aboveground plant production, and that photosynthetic substrate supplied by aboveground plant part may be of great importance for ecosystem respiration and soil respiration. The differential effects of N addition and simulated grazing on ecosystem CO2fluxes suggest that exogenous N input can relieve the negative effect of grazing pressure on plant production in the alpine meadow. On the contrary, livestock grazing will suppress the stimulated effects of increased N deposition on ecosystem CO2fluxes in the future global change scenarios.
nitrogen enrichment; simulated grazing; ecosystem respiration; plant biomass allocation; soil microbial carbon and nitrogen; alpine meadow
国家重点基础研究发展计划(2010CB833502);中国科学院战略性先导科技专项(XDA05060700);国家重点基础研究发展计划(2010CB951704)资助
2013- 06- 07;
2013- 07- 29
*通讯作者Corresponding author.E-mail: shipl@igsnrr.ac.cn
10.5846/stxb201306071385
宗宁, 石培礼,蔣婧,熊定鹏,孟丰收,宋明华,张宪洲,沈振西.短期氮素添加和模拟放牧对青藏高原高寒草甸生态系统呼吸的影响.生态学报,2013,33(19):6191- 6201.
Zong N, Shi P L, Jiang J, Xiong D P, Meng F S, Song M H, Zhang X Z, Shen Z X.Interactive effects of short-term nitrogen enrichment and simulated grazing on ecosystem respiration in an alpine meadow on the Tibetan Plateau.Acta Ecologica Sinica,2013,33(19):6191- 6201.

