镉在土壤-金丝垂柳系统中的迁移特征
张 雯, 魏 虹, 孙晓灿, 顾艳文
(三峡库区生态环境教育部重点实验室, 西南大学生命科学学院,重庆 400715)
镉在土壤-金丝垂柳系统中的迁移特征
张 雯, 魏 虹*, 孙晓灿, 顾艳文
(三峡库区生态环境教育部重点实验室, 西南大学生命科学学院,重庆 400715)
以金丝垂柳为试验对象,采用盆栽试验方式,设置无植物和金丝垂柳两组试验,分别对两组试验的土壤做梯度浓度Cd处理:0(无镉处理)、2(低浓度处理)、20(中浓度处理)、80(高浓度处理) mg/kg 土壤干重,无植物组各处理分别定义为CK(无镉处理)、L(低浓度处理)、M(中浓度处理)、H(高浓度处理),金丝垂柳组各处理分别定义为CKP(无镉处理)、LP(低浓度处理)、MP(中浓度处理)、HP(高浓度处理)。通过对土壤中各形态Cd含量及金丝垂柳叶、韧皮部、木质部、根部的Cd含量测定,分析了金丝垂柳及不同浓度Cd处理对土壤中中性交换态、螯合态和残渣态Cd含量的影响,并评价了富集指数(BCF)、转移系数(TF)和生物有效性(BF),明确了Cd在土壤-金丝垂柳系统中的转移特征及金丝垂柳对土壤中Cd的清除效果。结果表明:(1)金丝垂柳对土壤中中性交换态、有效态Cd含量及总Cd量的降低具有极显著影响,HP组与无植物H组相比,中性交换态及有效态Cd含量分别降低了52.73 %、25.34 %,MP、HP组与对应的无植物处理组的总Cd量相比分别降低了11.33 %、13.89 %;(2)金丝垂柳各处理组的Cd积累量随Cd处理浓度的增加和处理时间的延长而增加,处理90 d后,HP处理中木质部和根部的Cd含量可达170.64 mg/kg、212.49 mg/kg;(3)各浓度Cd处理下,金丝垂柳各部位生物富集系数呈根gt;木质部gt;韧皮部、叶,且随着Cd处理浓度的增加而显著降低,随处理时间的延长而升高;与40 d相比,90 d时LP组叶的生物富集系数增加了6.90倍,增幅最大。(4)各部分转移系数均随处理时间的延长而降低,90 d时LP、MP的转移系数分别比40 d时的结果低47.94 %、41.34 %。(5)金丝垂柳LP、HP组土壤Cd的生物有效性显著低于相应的无植物处理L、H组,分别低70.73 %、88.46 %,MP组与M组无显著差异。研究结果表明,金丝垂柳能有效地吸收土壤中的有效态Cd,降低土壤中Cd的生物有效性及总Cd量,提高土壤的安全性,并能将吸收的Cd有效地转移至地上部分,尤其是木质部储存。随着植株不断生长,生物量的增加,金丝垂柳可有效地清除土壤中的Cd,适用于对Cd污染地区进行长期植物修复。
金丝垂柳; 镉污染; 生物有效性; 木本植物修复
Cd是毒性最强的重金属之一,因其易水溶、有效态含量较高,极易被植物吸收从而进入食物链,因此对人体健康造成了巨大威胁[1]。工业排污、交通废气及农耕作业对农林土壤和城市土壤造成了不同程度的Cd污染[2- 3],目前我国重金属污染的土壤总面积已达2×107hm2,占全国耕地面积的1/5[4],可见其治理工作相当紧迫。传统的物理、化学修复方法存在资金、劳动力成本高,破坏土壤理化性质,易造成二次污染等弊端[5]。与之相比,植物修复[6- 7](Phytoremediation)通过利用植物吸收土壤的有机物及重金属等污染物,转运到地上部分储存,降低污染物浓度,从而提高土壤安全性,被认为是一种廉价、安全的重金属修复技术。
近20年植物修复重金属污染得到了很高的关注,研究者们针对适合植物的筛选做了大量研究,得到了Thlaspicaerulescens[8]、黑麦草(Loliumperenne)[9]、龙葵(SolanumNigrumL.)[10]、孔雀草(Tagetespatula)[11]等许多具有重金属高富集能力的草本植物。研究筛选出的草本植物特别是超富集植物的重金属富集量较大,但由于其生物量小,根系不够发达,对重金属的绝对富集量及深层土壤的修复受到限制,且草本植物相对于木本植物生长周期短,需要收割与重新栽种,人工耗费更大[12]。而木本植物则具有相对生物量大、生长速度快、根系发达、蒸腾作用大、富集和耐受性强、对贫瘠土壤更好的适应性等优势[13- 14],具有更大的重金属修复潜力。目前针对木本植物的研究较少,且多只对木本植物的富集能力以及胁迫下的生理响应做出评价[15- 16],未综合考虑植物的富集能力以及对土壤中重金属产生的影响,从整个土壤-植物系统综合地对修复效果做出评价。
金丝垂柳(Salix×aureo-pendula)为杨柳科柳属速生乔木,根系发达、生长速度快、适应性广、耐水淹[17]。已有孙晓灿[18]等人的研究表明,金丝垂柳幼苗对较低浓度的Cd胁迫具有较好的适应性,但其修复能力缺乏进一步研究。本文以金丝垂柳为研究对象,采用盆栽试验方式,设置梯度浓度Cd胁迫,测定了土壤中各形态的Cd含量以及在金丝垂柳各组织中的Cd含量,并评价了富集指数、转移系数和生物有效性指数,旨在探究Cd在土壤-金丝垂柳体系中的迁移特征,明确金丝垂柳对土壤中Cd的清除效果,评价其是否能提高土壤安全性,对土壤中的Cd进行植物修复。
1 材料与方法
1.1 试验材料
2011年5月从重庆市綦江苗圃基地选取金丝垂柳扦插条转栽入内径15 cm、高20 cm的盆钵中,每盆1株。盆钵中装入经风干后过5 mm筛的紫色土4 kg,土壤基本理化性质见表1。经50 d培养适应,待扦插条生根长成完整的植株。选取无植物土壤20盆及长势基本一致的金丝垂柳60盆,采取一次性浇灌的方式向2组盆钵的土壤中加入CdCl2·2.5H2O,分别设置Cd浓度梯度为0(无镉处理)、2(低浓度处理)、20(中浓度处理)、80(高浓度处理) mg/kg 土壤干重,无植物组各处理定义为无镉处理(CK)、低浓度处理(L)、中浓度处理(M)、高浓度处理(H),金丝垂柳组各处理定义为无镉处理(CKP)、低浓度处理(LP)、中浓度处理(MP)、高浓度处理(HP),无植物组各处理5个重复,金丝垂柳组各处理15个重复。所有盆钵置于西南大学三峡库区生态环境教育部重点实验室试验基地大棚下进行培养,试验期间进行常规田间管理。自试验处理之日算起,0、40和90 d分别从金丝垂柳组各抽取5个重复对植物进行测定,试验结束时对两组8个处理的土壤进行测定。

表1 土壤基本理化性质
1.2 测定指标及方法
1.2.1 Cd含量测定
收获植物全株,用20 mmol EDTA-Na2浸泡5 min以除去表面吸附的Cd离子,而后迅速用超纯水冲洗干净,再用滤纸吸干植株表面多余的水分。将金丝垂柳分叶、韧皮部、木质部、根4部分,分别放入80 ℃烘箱中烘至恒重后称得干重(DW)。将烘制好的各部分材料研磨碾细后装袋密封保存,待3次取样完成后一次性测量。各部分精确称取样品0.2000 g干样在ETHOS A/269微波仪(Milestone, Italy)中经双酸(6 mL HNO3、2 mL H2O2)消解后,采用TAS- 990原子吸收分光光度计(北京普析,中国)进行Cd含量测定,Cd含量表示成mg/kg 干重。
经3次植物取样完毕后,取金丝垂柳和无植物2个处理组盆钵中的土壤,自然风干,滤过杂物,用木棒研磨后过1 mm尼龙网筛,采用简单连续提取法[19]测定土壤中Cd各形态含量:分别用CaCl2提取中性交换态,螯合剂DTPA提取螯合态Cd[20],最终用强酸溶解残渣提取残渣态,3种不同形态的Cd含量均采用原子吸收分光光度计石墨炉法测定。
1.2.2 评价指数计算
利用金丝垂柳各部分的Cd含量进行生物富集系数(BCF)和转移系数(TF)计算,用以评价各部分对Cd的积累能力和土壤根系将Cd向地上部分转移的能力,公式如下:
生物富集系数[21](BCF) = 根或地上部分Cd浓度(mg/kg 干重)/ 土壤中Cd浓度(mg/kg 干重);
转移系数[22](TF) = 地上部分平均Cd浓度(mg/kg 干重)/ 根部平均Cd含量(mg/kg 干重)。
Cd的生物有效性[22](BF)即可被生物体吸收利用形态的Cd含量在土壤Cd总量中所占比例,公式如下:
土壤Cd生物有效性指数(BF)=(中性交换态Cd含量+螯合态Cd含量)/ Cd总量
1.2.4 数据分析
利用统计分析软件SPSS 19.0 和Excel 2003进行数据处理。运用单因素方差分析(One-way ANOVA)分析不同浓度Cd处理对金丝垂柳各部分Cd积累量及土壤中各种形态Cd含量的影响,双因素方差分析(Two-way ANOVA)分析金丝垂柳和不同处理浓度对土壤中Cd形态和土壤生物有效性指数的影响。用Duncan多重比较(Duncan′s multiple range test)检验各处理之间积累量的差异。采用Origin 8.5作图分析。
2 试验结果
2.1.1 金丝垂柳对土壤中Cd形态的影响
不同浓度处理对8个不同组合处理组土壤中的Cd形态具有极显著影响(表2),土壤中Cd的生物有效态、残渣态和总Cd量均随处理浓度的增加而显著增加,说明被污染土壤中Cd含量越高,生物可摄取的Cd含量越高,风险越大。经90 d处理后,与无植物组相比,金丝垂柳各Cd浓度处理组土壤中总Cd量均呈下降趋势,MP、HP组差异显著。Cd的生物有效态同样呈下降趋势,金丝垂柳HP组生物有效态含量为无植物H组的74.66 %,差异显著,LP、MP与相应的无植物处理组之间则无显著差异。金丝垂柳组中性交换态与螯合态Cd含量基本低于无植物组,HP组与H组之间具有显著差异。与无植物组相比,金丝垂柳MP、HP组残渣态Cd含量均降低,LP组呈上升趋势,差异均不显著。从双因素方差分析结果可知,金丝垂柳对中性提取态和生物有效态Cd含量以及总镉量具有极显著影响,浓度处理则对5个结果均有极显著影响,二者的交互效应与金丝垂柳产生的效应结果相同。

表2 金丝垂柳对土壤中不同浓度Cd形态的影响
图中数值为平均值±标准误(n=5);不同小写字母分别表示同列数据之间有显著差异(Plt;0.05);**:Plt;0.01; ns:Pgt;0.05; CK、L、M、H分别代表无植物处理组无镉处理、低浓度处理、中浓度处理和高浓度处理,CKP、LP、MP、HP分别代表金丝垂柳组无镉处理、低浓度处理、中浓度处理和高浓度处理
2.1.2 不同浓度Cd胁迫下金丝垂柳各部位的Cd积累量
金丝垂柳各组织中的Cd含量基本随处理时间的延长和处理Cd浓度的增加而增加(图1)。处理40 d时,金丝垂柳各部位Cd累积量均随处理Cd浓度的增高而显著增加,3个处理组中叶和韧皮部中镉含量比分别为1∶1.97∶3.63和1∶3.47∶7.72,木质部和根部中比值分别为1∶7.38∶10.07和1∶1.72∶9.21,说明在较高浓度Cd条件下,根部和木质部中的Cd含量变化程度较之于叶和韧皮部更为剧烈。
处理90 d时,金丝垂柳韧皮部、木质部和根部的Cd含量均随处理浓度的增加而显著增加,木质部和根部最高Cd含量分别为170.64 mg/kg、212.49 mg/kg。叶的Cd含量则随胁迫程度的增加表现为先升高后下降的趋势,2次取样相同浓度Cd处理的各部位均表现为根gt;木质部gt;叶、韧皮部的累积特征。
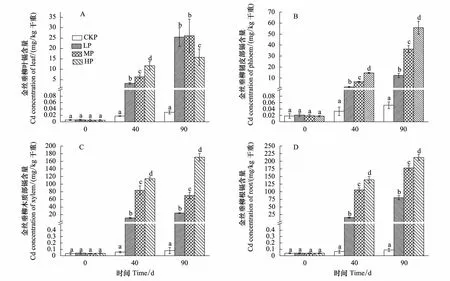
图1 不同Cd浓度胁迫下金丝垂柳各部位的Cd累积量Fig.1 Effects of different Cd concentration on Cd content of Salix × aureo-pendula 图中数值为平均值±标准误(n=5);不同小写字母分别表示同批次各处理之间有显著差异(Plt;0.05);CKP、LP、MP、HP分别代表金丝垂柳组无镉处理、低浓度处理、中浓度处理和高浓度处理
2.2 不同浓度Cd胁迫下金丝垂柳的转移特性
2.2.1 生物富集指数
金丝垂柳各部位在40 d、90 d 2次取样时生物富集系数均随处理Cd浓度升高而显著降低(表3)。MP、HP组叶部位生物富集系数较之于LP组分别降低80.12 %、90.68 %,与其他部位的生物富集系数相比,LP组降低幅度最大,说明相较于其他部位,叶对Cd的影响更为敏感。90 d时金丝垂柳各部位生物富集系数普遍高于40 d时的结果,表明金丝垂柳对Cd的富集量会随着处理时间的延长而增加,其中90 d时LP组叶、韧皮部、木质部、根的富集系数与40 d相比,分别增加了6.90、5.52、1.11、4.32倍,较之MP、HP组,LP富集系数增大效果最明显。

表3 不同Cd浓度胁迫下金丝垂柳的生物富集系数
图中数值为平均值±标准误(n=5);不同小写字母分别表示同批次同列数据之间有显著差异(Plt;0.05)
2.2.2 转移系数
金丝垂柳的转移系数在40 d时无显著差异,90 d时HP组显著高于中低浓度处理组,分别为LP、MP组的1.93、1.80倍(图2)。与40 d相比,90 d时LP、MP、HP组的转移系数均降低,分别降低47.94 %、41.34 %、0.28 %。
2.2.3 土壤中Cd的生物有效性
金丝垂柳LP、HP组土壤中Cd的生物有效性显著低于无植物L、H组,分别为无植物组的70.73 %、88.46 %,M与MP组结果无显著差异(图3)。金丝垂柳LP组结果显著低于MP、HP,MP、HP之间无显著差异。双因素方差分析结果表明,金丝垂柳处理和浓度处理均对生物有效应有极显著影响,二者的交互效应对其具有显著影响(结果未列出)。

图2 不同Cd浓度胁迫下金丝垂柳的转移系数 Fig.2 Effects of different Cd concentrations on translocation factors (TFs) of S. × aureo-pendula 图中数值为平均值±标准误(n=5);不同小写字母分别表示同批次各处理之间有显著差异(Plt;0.05)
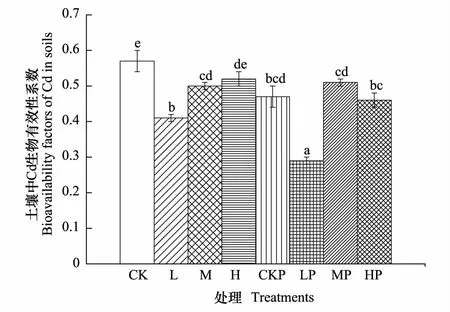
图3 不同Cd浓度处理金丝垂柳和无植物土壤中Cd的生物有效性系数Fig.3 Bioavailability factors (BFs) of Cd in soils with S. × aureo-pendula and no plant under different Cd treatments图中数值为平均值±标准误(n=5);不同小写字母分别表示各处理之间有显著差异(Plt;0.05);CK、L、M、H分别代表无植物处理组无镉处理、低浓度处理、中浓度处理和高浓度处理; CKP、LP、MP、HP分别代表金丝垂柳组无镉处理、低浓度处理、中浓度处理和高浓度处理
3 讨论与结论
一般而言,土壤中Cd总量越高则潜在危害越大,但其生物有效性直接决定了该土壤中Cd的危险程度。沈阳张士灌区长期采用城市工业用水直接灌溉农田,造成该地区土壤产生严重的Cd污染,陈涛[23]、吴燕玉[24]等人的研究发现该地区水稻土壤中Cd活性较高,交换态Cd含量约占78 %,极易被水稻吸收,因此导致该地区农作物严重Cd超标,造成了巨大危害。植物会对其根际土壤中重金属的形态产生影响,但暂无定论。有研究认为植物可通过根际分泌物对土壤中难溶态的Cd进行活化来提高Cd的生物有效性。如李花粉[25]等研究发现根际分泌物中的有机酸可促进难溶态Cd的溶解,如小麦和水稻在缺铁的情况下会从根部大量释放植物铁载体,能够活化根际难溶态的Cd,从而影响土壤中Cd的形态。植物也可通过根系吸附、沉积,或者与重金属络合,降低金属离子价态来固定重金属,从而降低土壤中重金属的有效态含量[5]。
本试验各组土壤样品中的Cd生物有效性指数均随处理浓度的增加而增加,说明Cd浓度越高,其有效态含量所占比例越大,与之前的研究结果一致[23- 24]。LP组土壤中的Cd有效态含量降低,残渣态含量增加,由此可见,金丝垂柳可同时通过吸收和固定有效态Cd来降低土壤中Cd的生物有效性。双因素方差分析结果表明,金丝垂柳对降低土壤中Cd的生物有效性具有极显著的影响,LP、HP组土壤中Cd的生物有效性均显著降低,说明金丝垂柳能有效地降低土壤中Cd的危害,提高土壤安全性,对Cd污染修复有重要意义。
从累积特性可知,金丝垂柳通过根部的吸水作用从土壤中吸收Cd,再通过木质部中的导管运输到叶和韧皮部,因此呈现出根gt;木质部gt;叶、韧皮部的累积特征。有研究表明重金属离子通过和植物体内的蛋白质等有机物结合进入植物体内。木质部存在较多的氨基酸和有机酸,能够与重金属离子结合形成复合物,并以复合物的形式在木质部中运输[26]。本研究表明金丝垂柳木质部中的Cd含量仅低于根部,具有较强的富集能力,今后的研究可通过提高木质部中有机酸等载体的方式来提高修复效率。生物量结果表明,与CKP组相比,Cd胁迫会使各处理组植物干重显著下降,但不同浓度处理组之间无显著差异,表明金丝垂柳对一定浓度范围内的Cd具有较好的耐受性。
富集指数和转移系数可反映出植物对重金属吸收、积累能力。本试验中金丝垂柳各部位的富集指数随处理浓度的升高而下降,转移系数也随着处理时间的延长而降低,这可能是由于胁迫浓度的增加使根细胞活力下降致使吸收、转移能力受限所致,与之前孔雀草(Tagetespatula)[27]和胡杨(Populuseuphratica)[28]的研究结果一致。Robinson等人发现杨树Beaupré (Populustricocapa×Populusdeltoides)组织中最高Cd积累量高达209 mg/kg[29],有研究表明短期轮作矮林(Short rotation coppice)8种柳树对重金属污染土壤原地修复的移除平均水平可达到72 g Cd和2.0 kg Zn hm-2a-1,对被污染土壤的修复效果远远高于种植于相同土壤的玉米和油菜等草本植物[30]。与之前的研究结果相似,本试验中随着处理时间的延长,金丝垂柳各部分的富集指数均上升,Cd富集量增加,HP处理组木质部和根部的Cd含量可达170.64 mg/kg、212.49 mg/kg。通过对金丝垂柳各部分生物量(数据未给出)及Cd含量的计算可得,与三级土壤[31]Cd浓度相近的LP组每盆金丝垂柳转移Cd含量可达0.019 mg,LP组土壤中Cd含量为8 mg,即根对土壤中Cd的转移率可到0.23 %,植株整体对Cd的吸收量可达土壤中Cd含量的0.41 %,与李佳华等人的研究结果一致[32]。以上数据仅表示试验期间,即90 d内金丝垂柳对土壤中Cd的清除效果。随着金丝垂柳的生长,生物量增大,其对土壤中Cd的吸收量和转移量都会增加,能够更大程度上清除土壤中的Cd。以上的结果均表明金丝垂柳的富集能力虽达不到超富集植物的富集水平,但综合其生物量,长期吸收、转移,对土壤中的Cd具有可观的清除效果。
总体而言,金丝垂柳通过根对土壤中有效态的Cd进行吸收,或者同时进行固定,使土壤中有效态的Cd含量降低,降低土壤Cd的生物有效性,再通过木质部的导管将吸收的Cd转运到叶、韧皮部进行隔离储存,从而使其地上部分的Cd积累量增加。处理浓度越高,土壤中有效态的Cd含量越高,因此金丝垂柳的Cd积累量随胁迫浓度的升高和时间的延长而增加,且生物量在试验中的处理Cd浓度范围内不受明显影响。由于金丝垂柳木质部的富集能力较高,其生物量的增大有利于Cd的富集,所以适于长期种植进行重金属污染修复。
[1] DalCorso G, Farinati S, Maistri S, Furini A. How plants cope with cadmium: staking all on metabolism and gene expression. Journal of Integrative Plant Biology, 2008, 50(10): 1268- 1280.
[2] Zhang Y Y, Sun H, Gao M, Sun C W, Wang J K. Pollution level and bioavailability of heavy metals in ginseng soil Jilin province. Acta Pedologica Sinica, 2011, 48(6): 1306- 1313.
[3] Fang X, Tang Z J, Tian D L, Xiang W H, Sun W J. Distribution and ecological risk assessment of 7 heavy metals in urban forest soils in Changsha City. Acta Ecologica Sinica, 2012, 32(23): 7595- 7606.
[4] Willey N. Phytoremediation: Methods and Reviews. Tang S R, Translation. Totowa, New Jersey: Humana Press, 2007: 351- 379.
[5] Hazrat A, Ezzat K, Muhammad A S. Phytoremediation of heavy metals-concepts and applications. Chemosphere, 2013, 91(7): 869- 881.
[6] David E S, Blaylock M, Kumar N P B A, Dushenkov V, Ensley B D, Chet I, Raskln I. Phytoremediation: a novel strategy for the removal of toxic metals from the environment using plants. Nature Biotechnology, 1995, 13(5): 468- 474.
[7] Zhang C X, Chen W F. Physiological-ecological responses of Iris germanica L. to Cd stress and its accumulation of Cd. Acta Ecologica Sinica, 2013, 33(7): 2165- 2172.
[8] Baker A J M, Proctor J. The influence of cadmium, copper, lead, and zinc on the distribution and evolution of metallophytes in the British Isles. Plant Systematics and Evolution, 1990, 173(1/2): 91- 108.
[9] Wang K, Huang H G, Zhu Z Q, Li T Q, He Z L, Yang X E, Alva A. Phytoextraction of metals and rhizoremediation of PAHs in Co-contaminated soil by Co-planting ofsedumalfrediiwith ryegrass (Loliumperenne) or castor (Ricinuscommunis). International Journal of Phytoremediation, 2013, 15(3): 283- 298.
[10] Wei S H, Clark G, Augustine Ignatius Doronila, Jin L, Alison Carol Monsant. Cd hyperaccumulative characteristics of Australia ecotypeSolanumnigrumL. and its implication in screening hyperaccumulator. International Journal of Phytoremediation, 2013, 15(3): 199- 205.
[11] Wei J L, Lai H Y, Chen Z S. Chelator effects on bioconcentration and translocation of cadmium by hyperaccumulators,TagetespatulaandImpatienswalleriana. Ecotoxicology and Environmental Safety, 2012, 84: 173- 178.
[12] Cook R L, Hesterberg D. Comparison of trees and grasses for rhizoremediation of petroleum hydrocarbons. International Journal of Phytoremediation, 2013, 15(9): 844- 860.
[13] Pulford I D, Watson C. Phytoremediation of heavy metal-contaminated land by trees-a review. Environment International, 2003, 29(4): 529- 540.
[14] Wuana R A, Okieimen F E. Heavy metals in contaminated soils: A review of sources, chemistry, risks and best available strategies for remediation. ISRN Ecology, 2011, 2011: Article ID 402647, doi: 10.5402/2011/402647.
[15] Zacchini M, Pietrini F, Mugnozza G S, Iori V, Pietrosanti L, Massacci A. Metal tolerance, accumulation and translocation in poplar and willow clones treated with cadmium in hydroponics. Water, Air, and Soil Pollution, 2009, 197(1/4): 23- 34.
[16] Jia Z M, Wei H, Sun X C, Li C X, Meng X F, Xie X H. Accumulation and tolerance ofSalixvariegateandPterocaryastenopteraseedlings to cadmium. Acta Ecologica Sinica, 2011, 31(1): 107- 114.
[17] Xu A C, Chen Y T, Wang S F, Wu T L. Preliminary research on cadmium uptake, accumulation and tolerance inSalix. Research of Environmental Sciences, 2006, 19(5): 96- 100.
[18] Sun X C, Wei H, Tian X F, Jia Z M. Effects of cadmium stress on growth and chlorophyll fluorescence characteristics ofSalix×aureo-pendulaseedlings. Guihaia, 2011, 31(4): 490- 494.
[19] Maiz I, Arambarri I, Garcia R, Millán E. Evaluation of heavy metal availability in polluted soils by two sequential extraction procedures using factor analysis. Environmental Pollution, 2000, 110(1): 3- 9.
[20] Tie M, Song L L, Hui X J, Zhang Z H, Xue S, Chen Z L, Wang J, Zhang Y. The available forms and bioavailability of heavy metals in soil amended with sewage sludge. Acta Ecologica Sinica, 2013, 33(7): 2173- 2181.
[21] Islam Md S, Ueno Y, Sikde Md T, Kurasaki M. Phytofiltration of arsenic and cadmium from the water environment usingMicranthemumumbrosum(J.F. Gmel) S.F. Blake As A Hyperaccumulator. International Journal of Phytoremediation, 2013, 15(10): 1010- 1021.
[22] Park S, Kim K S, Kang D, Yoon H, Sung K. Effects of humic acid on heavy metal uptake by herbaceous plants in soils simultaneously contaminated by petroleum hydrocarbons. Environmental Earth Sciences, 2013, 68(8): 2375- 2384.
[23] Chen T, Wu Y Y, Kong Q X, Tan F. Study on cadmium forms in soils in Zhang-shi irrigation area. Acta Ecologica Sinica, 1985, 5(4): 300- 305.
[24] Wu Y Y, Chen T, Zhang X X. Pollution ecology of Cd in the Zhangshi irrigation area of Shenyang. Acta Ecologica Sinica, 1989, 9(1): 21- 26.
[25] Li H F, Zheng Z Y, Zhang F S, Mao D R. Effect of iron untritional status on the uptake of Cd from different compounds by wheat plants. Acta Ecologica Sinica, 1999, 19(2): 170- 173.
[26] Furini A, DalCorso G, Manara A, Fasani E, Nesler A. Plants and Heavy Metals. Netherlands: Springer, 2012: 27- 53.
[27] Liu Y T, Chen Z S, Hong C Y. Cadmium-induced physiological response and antioxidant enzyme changes in the novel cadmium accumulator,Tagetespatula. Journal of Hazardous Materials, 2011, 189(3): 724- 731.
[28] Sun J, Wang R G, Zhang X, Yu Y C, Zhao R, Li Z Y, Chen S L. Hydrogen sulfide alleviates cadmium toxicity through regulations of cadmium transport across the plasma and vacuolar membranes inPopuluseuphraticacells. Plant Physiology and Biochemistry, 2013, 65: 67- 74.
[29] Robinson B H, Mills T M, Petit D, Fung L E, Green S R, Clothier B E. Natural and induced cadmium-accumulation in poplar and willow: Implications for phytoremediation. Plant and Soil, 2000, 227(1/2): 301- 306.
[30] van Slycken S, Witters N, Meiresonne L, Meers E, Ruttens A, van Peteghem P, Weyens N, Tack F M G, Vangronsveld J. Field evaluation of willow under short rotation coppice for phytomanagement of metal-polluted agricultural soils. International Journal of Phytoremediation, 2013, 15(7): 677- 689.
[31] State Environmental Protection Administration. GB/T 15618—1995 Environmental Quality Standard for Soils. Beijing: China standard Press, 1995.
[32] Li J H, Sun Y Y, Yin Y, Ji R, Wu J C, Wang X R, Guo H Y. Ethyl lactate-EDTA composite system enhances the remediation of the cadmium-contaminated soil by Autochthonous Willoow (Salix×aureo-pendulaCL ‘J1011’) in the lower reaches of the Yangtze River. Journal of Hazardous Materials, 2010, 181: 673- 678.
参考文献:
[2] 张亚玉, 孙海, 高明, 孙长伟, 王景宽. 吉林省人参土壤中重金属污染水平及生物有效性研究. 土壤学报, 2011, 48(6): 1306- 1313.
[3] 方晰, 唐志娟, 田大伦, 项文化, 孙伟军. 长沙城市森林土壤7种重金属含量特征及其潜在生态风险. 生态学报, 2012, 32(23): 7595- 7606.
[7] 张呈祥, 陈为峰. 德国鸢尾对Cd胁迫的生理生态响应及积累特性. 生态学报, 2013, 33(7): 2165- 2172.
[16] 贾中民, 魏虹, 孙晓灿, 李昌晓, 孟翔飞, 谢小红. 秋华柳和枫杨幼苗对镉的积累和耐受性. 生态学报, 2011, 31(1): 107- 114.
[17] 徐爱春, 陈益泰, 王树凤, 吴天林. 柳树对Cd吸收、积累和耐性的初步研究. 环境科学研究, 2006, 19(5): 96- 100.
[18] 孙晓灿, 魏虹, 田晓锋, 贾中民. 镉胁迫对金丝垂柳幼苗生长及叶绿素荧光特性的影响. 广西植物, 2011, 31(4): 490- 494.
[20] 铁梅, 宋琳琳, 惠秀娟, 张朝红, 薛爽, 陈忠林, 王杰, 张莹. 施污土壤重金属有效态分布及生物有效性. 生态学报, 2013, 33(7): 2173- 2181.
[23] 陈涛, 吴燕玉, 孔庆新, 谭方. 张士灌区土壤中镉形态的探讨. 生态学报, 1985, 5(4): 300- 305.
[24] 吴燕玉, 陈涛, 张学询. 沈阳张士灌区镉污染生态的研究. 生态学报, 1989, 9(1): 21- 26.
[25] 李花粉, 郑志宇, 张福锁, 毛达如. 铁对小麦吸收不同形态镉的影响. 生态学报, 1999, 19(2): 170- 173.
[31] 国家环境保护局. GB/T 15618—1995 土壤环境质量标准. 北京: 中国标准出版社, 1995.
TransfercharacteristicsofcadmiumfromsoiltoSalix×aureo-pendula
ZHANG Wen, WEI Hong*, SUN Xiaocan, GU Yanwen
KeyLaboratoryofEco-environmentintheThreeGorgesReservoirRegionoftheMinistryofEducation,CollegeofLifeSciences,SouthwestUniversity,Chongqing400715,China
Cadmium (Cd) is one of the most phytotoxic of the heavy metals, as Cd is highly water soluble and readily taken up by plants. It easily enters the food chain, and can be a serious threat to human health. Heavy metal soil contamination has become an environmental concern throughout China over the past decade. The acreage of arable lands contaminated with heavy metals such Cd, As, Cr, and Pb has been increasing in recent years, now totaling 2×107hm2or about 1/5 of the country′s arable land. Phytoremediation is a powerful technique for using growing plants to extract toxic metals from contaminated soil. However more information is needed concerning the optimum plant species, particularly for Cd contaminated soils.Salix×aureo-pendulais a fast-growing native riparian plant which has a high biomass, potential flood tolerance, and eurytropic to habitat. To determine the transfer characteristics of Cd from soil toS. ×aureo-pendula, a microcosm experiment was conducted. Two groups of four treatments, with or without plants, were established with 5 replicates per treatment for non-plant group, and 15 replicates for plant group. P referred to ‘plant’S. ×aureo-pendula(CKP, LP, MP, HP), where CK, L, M and H represent the control (0), low (2), medium (20), and high (80) treatments of Cd in mg/kg of soil dry weight. Soil and plant tissues were analyzed for various forms of Cd, the neutral exchange form of Cd concentration was extracted by CaCl2, the chelate form of Cd concentration was extracted by chelant DTPA, and residual fractions of Cd in soils were tested. These measurements were used to determine the effect ofS. ×aureo-pendulaand different treatments of Cd on bioavailable and total Cd in soil, and also Cd accumulation in the leaf, root, xylem and phloem in the plant treatments.Bio-concentrationfactor(BCF),translocationfactor(TF), andbioavailabilityfactor(BF) were calculated as indicators of the translocation and accumulation capability. The results showed: 1.S. ×aureo-pendulasignificantly decreased the content of bio-available Cd, total Cd, and the bioavailability factor of Cd in soil. The neutral exchange form and available Cd concentrations decreased 52.73 % and 25.34 % respectively in HP compared to H. The total Cd concentrations of MP, HP significantly decreased by 11.33 % and 13.89 % respectively compared to M, H. 2. The Cd concentration in all tissues ofS. ×aureo-pendulaincreased with greater Cd treatments. After 90 d′s treatment, Cd concentrations reached 170.64 mg/kg and 212.49 mg/kg in xylem and root respectively in HP. 3. Under increasing concentrations of Cd, theBCFin measured parts ofS. ×aureo-penduladecreased significantly, but opposite results occurred with prolonged treatment. LP-BCFincreased 6.9 times from the 40 d to 90 d measurement. 4.TFincreased under lower treatments of Cd. The 90 dTFfor LP, MP was 47.94 % and 41.34 % respectively, which was lower than the 40 d measurement. 5. Cd bioavailability in LP and HP was 70.73 % and 88.46 % lower than in corresponding non-plant treatments L, H. There was no significant difference between MP and M. In summary, this study has shown thatS. ×aureo-pendulacould effectively translocate bioavailable Cd to the trunk and crown for storage, particularly concentrating in the xylem tissues. These results determined thatS. ×aureo-pendulais suitable for long-term phytoremediation of Cd contaminated areas to improve soil security.S. ×aureo-pendulais a promising phytoremediation candidate for Cd contaminated areas.
Salix×aureo-pendula; Cd pollution; bioavailability; phytoremediation by woody species
国家林业公益性行业科研专项(201004039);重庆市基础与前沿研究计划重点项目(CSTC2013JJB00004);重庆市自然科学基金项目(CSTC2012jjA8003);中央高校基本科研业务费专项资金(XDJK2013A011)
2013- 06- 09;
2013- 07- 25
*通讯作者Corresponding author.E-mail: weihong@swu.edu.cn
10.5846/stxb201306091495
张雯, 魏虹, 孙晓灿, 顾艳文.镉在土壤-金丝垂柳系统中的迁移特征.生态学报,2013,33(19):6147- 6153.
Zhang W, Wei H, Sun X C, Gu Y W.Transfer characteristics of cadmium from soil toSalix×aureo-pendula.Acta Ecologica Sinica,2013,33(19):6147- 6153.

