高效液相色谱 荧光法测定腊肉中的苯并芘残留
李念念,周光宏,徐幸莲,刘登勇,李春保
(南京农业大学,肉品加工与质量控制教育部重点实验室,江苏南京210095)
苯并芘又称3,4-苯并芘,简称Bap,是一种含5个环的稠环芳烃,是由一个苯环和一个芘分子结合而成的多环芳烃类化合物,是多环芳烃类化合物(PAHs)的代表,具有多种同分异构体,广泛存在于各种食品中[1]。目前,已发现的400多种致癌物中,1/2以上属于多环芳烃类化合物,其中,苯并芘是致畸、致突变和致癌性物质的代表[2]。小剂量苯并芘就有可能引起局部组织的癌变,也可引起大鼠外周血淋巴细胞DNA、肺细胞及肝细胞损伤[3-5]。目前,由食品污染所导致的疾病已成为全世界最为广泛关注的食品安全问题之一,许多国家已将Bap列为食品有害物质监测的重要内容之一,德国已对肉制品中Bap的残留制定了限量标准1μg/kg,欧盟规定烟熏剂中 Bap 的含量不超过 0.03μg/kg[6],我国国标限定粮食和肉制品中Bap的残留量应在5μg/kg以下,植物油中为 10μg/kg[7]。目前,国内外已报道大气[8]、肉类食品[9-12]、反应香精[13]、茶叶[14]、水产品[15]、植物油[16]、土壤[17]中苯并芘的检测方法有荧光分光光度法[18]、薄层层析法[19]、气相色谱-质谱联用法[20]和高效液相色谱法[9-16]。其中,高效液相色谱法具有高效、快速、灵敏度高和检出率高的优点,且易推广,是目前使用最广泛的方法,但此法通常需要固相萃取小柱对样品进行净化,固相萃取存在操作繁琐、成本高、耗时等缺点,样品多时无法满足检测的要求。因此,本实验在参考有关文献[9-11,13-16]的基础上,简化了苯并芘的提取过程,建立了一种适用于检测腊肉中苯并芘含量的快速、准确的检测方法,为食品安全检测提供一定的参考。
1 材料与方法
1.1 材料与设备
苯并芘标准品(纯度 >99%) 美国Sigma公司;甲醇 德国Meker公司,色谱纯;正己烷 美国Fisher公司,色谱纯;KOH、Na2S·9H2O 上海试剂有限公司,分析纯;腊肉 超市购买。
MDL9000(B)-H-30型台式实验室超纯水系统南京总馨纯水设备公司;Waters Alliance 2695高效液相色谱系统、Waters2475荧光检测器、Waters X BridgeTMC18柱(4.6mm ×250mm,5μm) 美国 Waters公司;SHIMADZU微量分析天平 日本岛津公司;氮吹仪 上海安普有限公司;KQ-300DE型数控超声波清洗器 昆山舒美超声仪器有限公司;0.22μm有机滤膜。
1.2 实验方法
1.2.1 标准储备液的配制 准确称取苯并芘标准品10mg,置于100mL棕色容量瓶中,甲醇定容,该储备液(A液)浓度为100μg/mL,避光,放置在4℃冰箱中保存。吸取A液1.00mL于100mL棕色容量瓶中,甲醇定容,该储备液(B液)浓度为1μg/mL,避光,放置在4℃冰箱中保存。
1.2.2 工作曲线溶液的配制 精密吸取定量B液于100mL容量瓶中,甲醇定容,配成质量浓度为0.002、0.005、0.01、0.02、0.05、0.1、0.5μg/mL 的标准系列,经0.22μm有机滤膜过滤后,置于样品瓶中,4℃冰箱保存待用。
1.2.3 液相色谱分析条件 色谱条件如下:色谱柱:Waters X BridgeTMC18(4.6mm ×250mm,5μm);流动相∶V(甲醇)∶V(水)=90∶10;荧光检测器:激发波长(λex):365nm,发射波长 (λem):410nm;流速:1mL/min;柱温:35℃;进样量:10μL。
1.2.4 样品的提取 用电子天平准确称取用绞肉机绞碎混匀的样品5g于150mL具塞锥形瓶中,加入30mL 2mol/L KOH(甲醇∶水 =9∶1,V/V)溶液和 2g Na2S·9H2O,塞紧瓶塞,置于70℃恒温水浴锅内2.5h;取出锥形瓶趁热加入30mL正己烷,再超声提取30min;加入30mL水充分振荡,然后在黑暗中静置放置直到正己烷相和水相分层。取上层正己烷相15mL经氮吹仪吹干,准确加入1.00mL甲醇,超声溶解后,经0.22μm的微孔有机滤膜过滤,供高效液相色谱测定。
1.2.5 结果的计算 采用标准物质的保留时间对样品进行定性;定量方法是根据苯并芘标准液的浓度和色谱峰面积作标准曲线,然后根据样品测定时苯并芘的色谱峰面积在标准曲线上找出相应的提取液中苯并芘的浓度,再经换算即可得到腊肉中苯并芘的含量,换算公式为
式中:X为样品中苯并芘含量,μg/kg;C为待测溶液中苯并芘的质量浓度,μg/mL;V为样品浓缩体积(V=1mL);F为正己烷总体积是经过氮吹的正己烷体积的倍数(F=2);m为称样质量,kg。
2 结果与分析
2.1 色谱条件的选择
本实验主要从流动相的组成、流速、检测器条件、进样量等几个方面来进行色谱条件的选择。比较了几种流动相,分别为甲醇∶水(70∶30)、甲醇∶水(80∶20)、甲醇∶水(90∶10),发现甲醇∶水(90∶10)条件下,苯并芘和样品中干扰物能达到较好基线分离;在0.6~2.0mL/min范围内改变流动相流速,发现在流速为1.0mL/min苯并芘出峰时间合适,峰形较好;对苯并芘标准溶液用荧光光谱仪进行扫描,固定激发波长,其发射波长为410nm处有最大吸收峰;再固定发射波长,其激发波长为365nm处有最大吸收峰;进样量大可提高测定的灵敏度,但实验中发现,当进样量达到10μL以上时,峰形将发生分散、拖尾等现象。综合考虑,本实验确定测定的色谱条件为:流动相为甲醇∶水(90∶10),流速 1.0mL/min,柱温 35℃,激发波长(λex)为365nm,发射波长(λem)为410nm,进样量为10μL,以Waters X BridgeTMC18反相色谱柱作为分离柱,所得苯并芘色谱峰形对称,基线平稳,目标峰和其它杂质峰达到完全分离,测定结果令人满意。此条件下苯并芘的保留时间为11.44min,标准品及样品色谱图见图1、图2。

图1 苯并(a)芘标准色谱图Fig.1 The chromatograms of benzo(a)pyrene in standard sample

图2 样品中苯并(a)芘的色谱图Fig.2 The chromatograms of benzo(a)pyrene in sample
2.2 样品前处理条件的选择
由于肉制品成分复杂,目前国内外普遍采用固相萃取的方法对样品进行净化。但固相萃取小柱价格昂贵、操作繁琐、提取过程不稳定。因此,本实验改进了肉制品中苯并芘的提取方法。先采用皂化的方法除去脂肪,再利用苯并芘易溶于正己烷的性质,经正己烷结合超声处理提取苯并芘,最后用水洗去其他水溶性杂质。取空白基质(猪肉)各6份,分别加入低(0.005μg/mL)、中(0.02μg/mL)、高(0.05μg/mL)三种不同浓度的苯并芘标准溶液,按照1.2.4的方法对样品进行提取,同时进行直接测定和过固相萃取柱后测定,计算回收率,结果见表1。由表1可以看出,过固相萃取柱的回收率低于不过柱的回收率,两种处理方法的测定结果之间无显著性差异(p>0.05),因此采用不过固相萃取小柱的方法进行提取。

表3 不同品牌腊肉中苯并芘的含量Table 3 Contents of Bap in preserved ham of different brands
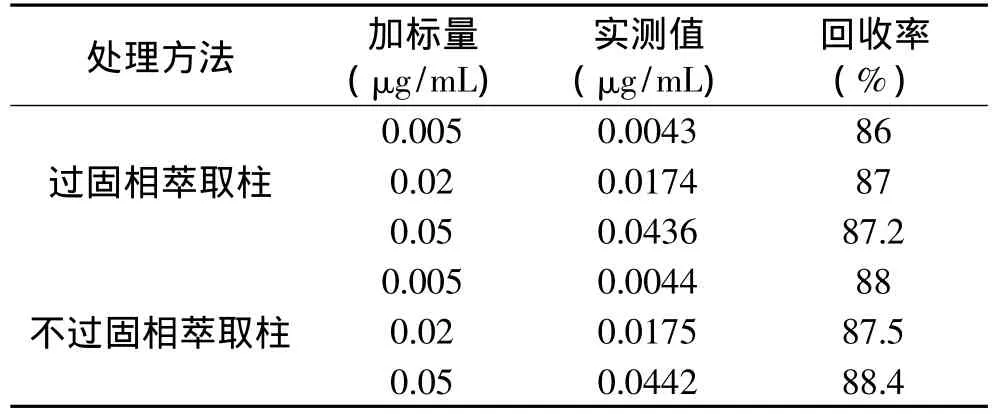
表1 不同净化方法提取苯并芘的回收率(n=6)Table 1 Recovery of the different method to purifying(n=6)
2.3 标准曲线及线性范围
取1.2.2节质量浓度0.002~0.5μg/mL的苯并芘系列标准溶液依次从低浓度到高浓度进样,按2.1节确定的色谱条件进行测定,每个浓度进行平行测定三次,得出峰面积的平均值,以质量浓度C(μg/mL)为横坐标,峰面积A为纵坐标,制作标准曲线(见图3),回归方程为Y=4×108X-662420,相关系数R2=0.9999。表明在0.002~0.5μg/mL范围内,质量浓度与峰面积呈现良好的线性关系,符合定量要求。

图3 苯并芘标准曲线Fig.3 Standard curve of Bap
2.4 精密度实验及方法的检出限
对质量浓度为0.01μg/mL的苯并芘标准溶液在同一天内连续进样6次,所得峰面积的相对标准偏差(RSD)为0.85%,表明该方法具有良好的精密度。
方法的检出限(LOD)定义为产生3倍信噪比(S/N=3)的化合物的质量浓度,以产生10倍信噪比(S/N=10)的化合物的质量浓度作为定量限(LOQ),选一系列较低浓度的苯并芘标准溶液,按2.1的液相色谱条件进行测定,信噪比S/N=3时,苯并芘的检出限为0.15μg/kg;信噪比S/N=10时,苯并芘的定量限为0.5μg/kg,实验结果表明本方法的灵敏度较高,能满足对苯并芘检测和污染控制的要求。
2.5 样品的加标回收率实验
准确称取5g腊肉样品,分别加入0.01μg/mL的苯并芘标准溶液0.5、2.5、5mL,然后按照1.2.4的方法进行提取,按照2.1的色谱条件进行测定计算加标回收率,测定结果见表2。结果显示,加标平均回收率在85.14%~91.01%之间,相对标准偏差在1.96%~5.37%之间,表明该方法的准确度和精密度良好,能够满足腊肉中苯并芘含量的检测要求。

表2 加标回收率实验结果(n=6)Table 2 Results of spike recovery test(n=6)
2.6 实际样品中苯并芘的测定
从超市里购买了8个品牌的腊肉,按照1.2.4的方法进行提取,按照2.1的色谱条件进行测定,每个样品取三份,每份平行测定3次,取平均值,所测样品中苯并芘的含量结果见表3。利用所建立的方法对市售腊肉中苯并芘含量进行了分析,8种腊肉中均存在着一定量的苯并芘,检测出的总量在0.98~8.89μg/kg之间。
3 结论
本实验建立的高效液相色谱法检测腊肉中的苯并芘色谱条件为:以Waters X BridgeTMC18反相色谱柱作为分离柱,流动相为甲醇∶水(90∶10),流速1.0mL/min,柱温35℃,荧光检测器激发波长为365nm,发射波长为410nm,进样量为10μL,苯并芘的保留时间为11.44min。该方法的线性范围、检出限、回收率和精密度均可满足实际样品检测的要求。利用所建立的方法对市售腊肉中苯并芘含量进行了分析,8种腊肉中均存在着一定量的苯并芘,检测出的总量为0.98~8.89μg/kg之间。本方法对样品的前处理简单快速,方法实用、准确,特别适合样品量较多的实验,可为今后腊肉中苯并芘研究工作的深入展开提供有力的技术支持。
[1]王欣,周智慧,赵晓联.苯并(a)芘危害性及其检测技术[J].粮食与油脂,2011(3):48-49.
[2]王丹.食品安全隐患-苯并(a)芘的研究进展[J].食品研究与开发,2006,27(1):132-135.
[3]GARRY S,NESSLANY F,ALIOUAT E,et al.Assessment of genotoxic effect of benzo(α)pyrene in endotracheally treated rat using the comet assay[J].Mutation Research,2003,534(1-2):33-43.
[4]杨业鹏,徐厚恩,芦春林,等.苯并[α]芘对人血淋巴细胞遗传损伤6项指标的敏感性比较[J].中华预防医学杂志,1994,28(5):275-277.
[5]刘治娟,姬艳丽,吴源,等.苯并[α]芘引起鼠胸腺细胞DNA 损伤及其机制[J].毒理学杂志,2005,19(4):284-286.
[6]SIMKO P.Determination of polycyclic aromatic hydro-carbons in smoked meat products and smoke flavouring food additives[J].Journal of Chromatography B,2002,770:3-18.
[7]中国预防医学科学院标准处.GB 7104-1994.食品中苯并(a)芘限量卫生标准[S].北京:标准出版社,1995.
[8]刘丽娟.高效液相色谱法测定空气中苯并(a)芘[J].山西化工,2007,27(3):38-40.
[9]JANOSZKA B.HPLC-fluorescence analysis of polycyclic aromatic hydrocarbons(PAHs)in pork meat and its gravy fried without additives and in the presence of onion and garlic[J].Food Chemistry,2011,126:1344-1353.
[10]FARHADIAN A,JINAP S,ABAS F,et al.Determination of polycyclic aromatic hydrocarbons in grilled meat[J].Food Control,2010,21:606-610.
[11]CHUNG S Y,YETTELLA R R,KIM J S,et al.Effects of grilling and roasting on the levels of polycyclic aromatic hydrocarbons in beef and pork[J].Food Chemistry,2011,129:1420-1426.
[12]ISHIZAKI A,SAITO K,HANIOKA N,A.et al.Determination of polycyclic aromatic hydrocarbons in food samples by automated on-line in-tube solid-phase microextraction coupled with highperformance liquid chromatography-fluorescence detection[J].Journal of Chromatography A,2010,1217:5555-5563.
[13]武晓剑,李琼,费玠,等.高效液相色谱法测定反应香精中的3,4-苯并芘[J].食品科技,2008(4):192-194.
[14]冼燕萍,郭新东,黄金凤,等.高效液相色谱-荧光法测定茶叶中苯并[a]芘残留量的研究[J].现代食品科技,2007,24(3):281-289.
[15]黄鸾玉,黎小正,秦振发.固相萃取/高效液相色谱荧光法测定水产品中苯并芘[J].分析实验室,2009,28(12):63-66.
[16]黄翠莉,吴苏喜,王力清,等.油茶籽油中苯并(a)芘的快速检测方法研究[J].食品工业科技,2012,33(2):64-66.
[17]弓玉红,郝林,郭凯凯.萃取-紫外分光光度法测定土壤中3,4-苯并芘含量[J].山西农业科学,2012,40(4):383-385.
[18]陶顺兴.食品中苯并(a)芘简易快速测定方法的研究[J].食品科学,1995,16(5):48-51.
[19]王焕锁,王红勇.双波长薄层扫描法测定油脂中苯并(a)芘[J].解放军预防医学杂志,1993,11(6):432-434.
[20]YURCHENKO S,MOLDER U.The determination of polycyclic aromatic hydrocarbons in smoked fish by gas chromatography mass spectrometry with positive-ion chemical ionization[J].Journal of Food Composition and Analysis,2005,18:857-869.

