鱿鱼墨多糖改善小鼠肠粘膜免疫及作用机制的研究
左 涛,李学敏,曹 露,王静凤,王玉明,李兆杰,薛长湖,唐庆娟
(中国海洋大学食品科学与工程学院山东青岛 266003)
肠道不仅是消化吸收的重要场所,也是生物体最大的免疫器官。肠道粘膜面积庞大,它的结构和功能构成了强大的粘膜免疫系统。肠粘膜免疫是全身免疫的一部分,其功能不仅仅作用于肠粘膜,还参与全身免疫功能的调节。分泌型IgA(SIgA)是由小肠上皮细胞分泌的免疫球蛋白,在肠道粘膜表面起到重要的免疫保护作用,用以抵抗外来微生物如细菌、病毒、寄生虫等的入侵,是肠道免疫屏障的主要效应因子。肠道SIgA主要是通过小肠上皮细胞的pIgR(多聚免疫球蛋白受体)穿胞转运dIgA从而分泌到细胞外的,在肠腔中 SIgA发挥粘膜防御功能[1-3]。当肠道的免疫屏障受到应激、化疗药物(如环磷酰胺)、免疫抑制剂、烧伤等内部或外界因素影响而被削弱时,轻者发生肠炎,重者甚至会危及生命[4]。因此,保护肠道粘膜免疫屏障的完整性,维持SIgA的正常分泌,对于防治肠源性感染、保护人类健康至关重要。
大量研究表明,许多多糖类物质可以明显改善机体免疫力。但是,具有改善肠道免疫促进SIgA分泌活性的多糖类物质鲜有报道。鱿鱼墨主要由黑色素和富含岩藻糖的粘多糖组成,具有抗肿瘤、免疫调节、升高白细胞、抗辐射以及促凝血等多种生理活性,是一种极具应用潜力的天然资源[5]。已有报道证实,鱿鱼墨黑色素具有免疫调节作用[6],而且鱿鱼墨粘多糖也能够明显改善氢化可的松所致的小鼠免疫功能低下状况[7]。但迄今尚未见鱿鱼墨多糖与肠道粘膜免疫关系的报道。
北太平洋鱿鱼(Ommastrephes bartrami)是目前的一种主要捕捞和加工鱿鱼品种,在中国、日本都有较高的产量。其个体墨囊相对较大,一般一个成熟鱿鱼的鱿鱼墨囊大约占其体重的1.3%,而在其加工过程中,墨囊往往作为废弃物丢弃,一些国家甚至为处理这些加工废弃物投入大量的财力和物力。因此,研究鱿鱼墨的加工再利用具有重要的意义。本文主要研究鱿鱼墨多糖对免疫低下模型小鼠的肠道免疫调节作用,旨在筛选出改善肠粘膜免疫的活性成分,为鱿鱼墨多糖在食品、营养保健等领域的应用提供理论依据。
1 材料与方法
1.1 鱿鱼墨囊 北太平洋鱿鱼墨囊,由浙江舟山渔业公司提供,-20℃冻藏,使用时于0℃解冻。
1.2 实验动物 健康♂Balb/c小鼠50只(体质量18-22 g),SPF级,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2007-0001;
1.3 实验试剂和仪器 试剂:氯化钠,甲醛(10%),磷酸二氢钠,磷酸氢二钠,均为国产分析纯;环磷酰胺购自江苏恒瑞医药股份有限公司;膜蛋白提取试剂盒(上海生工);Mouse SIgA ELISA Kit(武汉USCNK);Mouse pIgR ELISA Kit(武汉 USCNK);Mouse IgA antibody(Bethyl Laboratories);山羊抗SABC免疫组化试剂盒(博迈德);浓缩型DAB试剂盒(Solarbio);TRIzol(Invitrogen);M-MLV逆转录酶(Promega);dNTP(TaKaRa);RNase inhibitor(Roche);随机引物B0043-9(上海生工生物工程有限公司);仪器:高速台式离心机TGL-16G(上海安亭科学仪器厂);酶标仪Model680(美国Bio RAD产品);全温振荡培养箱(HZQ-F)(哈尔滨市东联电子技术开发有限公司);电热恒温水浴锅(HHS-Ni)(北京长安科学仪器厂),光学显微镜(Olympus BX41),凝胶成像系统(Tanon GIS-2000,上海天能科技有限公司)。
1.4 方法
1.4.1 鱿鱼墨粗多糖制备 鱿鱼墨囊解冻去皮经水浸泡过夜,超速离心后得到鱿鱼墨上清液。上清液经木瓜蛋白酶酶解、醇沉、丙酮洗,再经三氯乙酸除去杂蛋白,所得溶液透析后经真空冷冻干燥,得鱿鱼墨粗多糖样品。粗多糖的得率约为1.5%(m/V),粗多糖样品中多糖含量使用苯酚-硫酸法检测浓度为68.9%,蛋白含量使用福林-酚法检测浓度为8.9%。
1.4.2 环磷酰胺腹腔注射液剂量的确定 通过预实验将36只Balb/c小鼠,按体重随机分成6组,每组6只,分别为1组正常组小鼠和5组环磷酰胺模型组小鼠。5组环磷酰胺模型组小鼠分别连续腹腔注射环磷酰胺(50 mg·kg-1)1、2、3、4、5 d,d6 脱颈椎处死小鼠。刮取肠粘膜,测定脾指数、胸腺指数和肠粘膜SIgA分泌量。实验发现连续2 d注射环磷酰胺已造成胸腺、脾严重受损,SIgA分泌量也明显下降。故确定环磷酰胺最终注射剂量与时间为:连续2 d腹腔注射环磷酰胺(50 mg·kg-1)构建机体免疫下降小鼠模型。
1.4.3 鱿鱼墨多糖灌胃剂量确定 通过预实验将50只Balb/c小鼠,按体重随机分成5组,选择鱿鱼墨多糖灌胃剂量为 2 mg·kg-1、20 mg·kg-1、200 mg·kg-1,28 d灌胃饲养。于第25天开始连续两天给予小鼠腹腔注射环磷酰胺(50 mg·kg-1)处理。第28天杀鼠刮取肠粘膜通过酶联免疫反应试剂盒测定肠道SIgA分泌量与脾指数、胸腺指数。实验发现各组中仅200 mg·kg-1剂量鱿鱼墨多糖具有明显改善胸腺指数、脾指数与肠粘膜SIgA的功效。故将后续试验小鼠灌胃剂量确定为50、100、200 mg·kg-1。
1.4.4 动物分组 将50只Balb/c小鼠,按体重随机分成5组:正常对照组、模型组、低、中、高剂量组,每组10只(饲养在专门动物饲养笼内,给予清洁无菌喂养)。饲养小鼠28 d,每日给以小鼠低、中、高剂量组分别灌胃鱿鱼墨多糖50、100、200 mg·kg-1,正常组、模型组分别灌服同等体积的生理盐水;并每日记录体重;最后连续2 d,模型组、低、中、高剂量组腹腔注射环磷酰胺(50 mg·kg-1),正常组注射等体积的无菌生理盐水。第28天小鼠禁食不禁水12 h,脱颈椎处死小鼠检测相关指标。
1.4.5 胸腺指数/脾指数 Balb/c小鼠于末次给药后,禁食不禁水12 h,分别称重,脱颈椎处死,剥离胸腺、脾脏称重并计算胸腺/体重和脾脏/体重比值。
1.4.6 小肠组织切片及HE染色结构观察 小鼠处死后,沿腹部正中线切开,取出靠近空肠5~10 cm片段于中性甲醛中固定。将甲醛固定的小肠组织于进行小肠石蜡包埋、组织切片制备与HE染色,中性树胶封片。
1.4.7 小肠粘膜SIgA含量测定 沿小鼠腹部正中线切开,用镊子与剪刀小心取出靠近十二指肠段的空肠约5 cm称重,刮取肠粘膜,溶于2 ml PBS(pH 7.4),于 5 000 r·min-1,5 min 离心收集上清,按mouse SIgA ELISA Kit试剂盒(武汉USCNK)说明书操作检测单位质量小肠内SIgA含量。
1.4.8 免疫组织化学法检测小肠固有层IgA表达量 小肠石蜡切片组织经常规脱蜡至水,0.3%甲醇过氧化氢轻摇孵育30 min以消除内源性过氧化物酶的活性,胰蛋白酶37℃ 10 min,IgA抗体4℃孵育过夜,二抗37℃孵育1 h,DAB显色5 min,PBS终止显色,苏木素复染,蒸馏水1 min,脱水,中性树胶封片,置于显微镜下观察。
1.4.9 小肠pIgR含量测定 截取0.1 g小鼠空肠,经膜蛋白提取试剂盒法提取总膜蛋白,按mouse pIgR ELISA Kit试剂盒(武汉USCNK)说明书操作检测小肠内pIgR含量。
1.4.10 RT-PCR法检测小肠pIgR mRNA表达量截取0.1 g小鼠空肠采用TRIzol法提取总RNA,紫外分光光度计测定总RNA浓度,OD260/OD280为1.8~2.0,于-80℃冰箱保存。取1 μg总RNA进行逆转录反应合成cDNA,并取逆转录产物cDNA用于PCR扩增,以β-actin的表达量为内参。β-actin上游引物:5'-GAGACCTTCAACACCCCAGC-3',下游引物:5'-ATGTCACGCACGATTTCCC-3';pIgR上游引物5'-CAGACATTAGCATGGCAGACTTCAA-3',下 游 引物5'-TGCCGAGTAGGCCATGTCAG-3';PCR条件:94℃ 2 min;变性、退火、延伸各为 94℃ 30 s、53℃30 s、72℃ 1 min,重复23个循环,最后72℃延伸5 min。PCR产物在1%的琼脂糖凝胶(EB+)中电泳,紫外光(300 nm)观察并照相记录,用Image J软件进行灰度扫描比对。
2 结果
2.1 小鼠体重变化 小鼠饲养结束时,模型组和鱿鱼墨多糖各剂量组小鼠的平均体重均低于正常组,差异有显著性(P<0.05)(Fig 1)。在未注射环磷酰胺之前,各组小鼠体重均处于缓慢上升趋势,但从第25天腹腔注射环磷酰胺之后,模型组和鱿鱼墨多糖剂量组小鼠体重逐渐下降(Fig 1),但各剂量组小鼠体重均高于环磷酰胺模型组小鼠。环磷酰胺作为一种烷化剂类化疗药物,对快速增殖的细胞具有损伤作用。肠道上皮细胞增殖迅速,容易受到环磷酰胺的损伤。本研究中注射环磷酰胺小鼠的体重均下降,提示环磷酰胺对小鼠肠道具有损伤作用。鱿鱼墨多糖有改善小鼠体重的趋势,提示鱿鱼墨多糖对肠道损伤具有一定的修复作用。

Fig 1 Change of mouse bodyweight
2.2 脾指数/胸腺指数 胸腺和脾脏是重要的免疫器官,胸腺的主要功能是产生T淋巴细胞和分泌胸腺素,主要参与细胞免疫;脾脏中有丰富的淋巴细胞和巨噬细胞,B淋巴细胞比例较大,因此与体液免疫关系更为密切。其重量与其功能以及其中免疫细胞数量有关。所以脏器指数可在一定程度上反映机体免疫功能的强弱。研究中环磷酰胺模型组小鼠的胸腺指数与脾指数均低于正常组小鼠并有差异显著性(P<0.01),而且鱿鱼墨多糖可明显提高环磷酰胺所致免疫低下小鼠的脾指数、胸腺指数(Fig 2)。虽然鱿鱼墨多糖剂量组小鼠脾指数与胸腺指数均未达到正常水平,但是与模型对照组相比,低、中、高剂量组的脾指数分别提高了12.7%、13.1%、15.6%,胸腺指数分别提高了53.5%、67.6%、61.8%,差异均有显著性(P<0.05)。由此提示,鱿鱼墨粗多糖可以改善免疫低下小鼠的免疫功能。
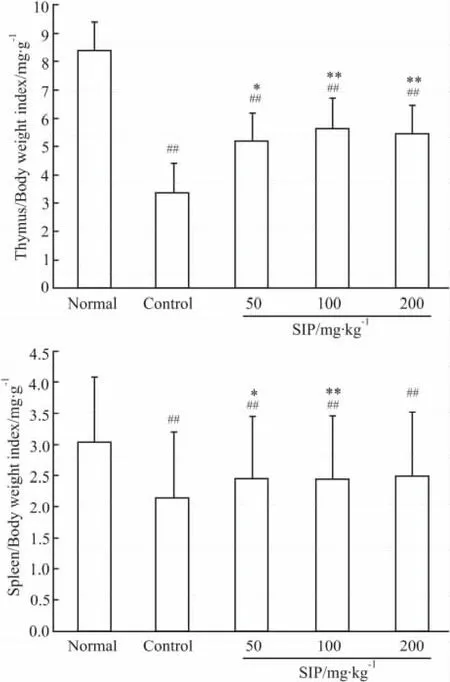
Fig 2 Effects of Squid Ink glycosaminoglycan on immune function in immunosuppressed mice
2.3 肠粘膜的结构完整性 环磷酰胺可以导致机体免疫低下,而增殖更新较快的肠道作为机体最大的免疫器官易受化疗药物环磷酰胺的损伤。小肠组织切片HE染色观察小肠粘膜结构(Fig 3),结果提示连续2 d注射环磷酰胺(50 mg·kg-1)后,小肠绒毛的完整性与形态结构未有明显变化。小肠绒毛的上皮细胞排列、固有层结构、肠隐窝结构等均未有明显变化。且模型组小鼠和鱿鱼墨剂量组小鼠中均未出现上皮细胞明显病理损伤、炎症浸润、白细胞穿越进入固有层等现象。说明此剂量的环磷酰胺注射小鼠并未引起肠道明显病理反应。
2.4 肠粘膜SIgA含量 虽然连续2 d注射环磷酰胺(50 mg·kg-1)并未引起肠道明显生理结构变化,但肠粘膜免疫功能亦与肠道许多免疫因子,如获得性免疫因子SIgA有重要关系。因此在研究中我们进一步探讨了环磷酰胺与鱿鱼墨多糖对肠粘膜SIgA的影响。通过单位质量小肠内肠粘膜SIgA的含量比较研究(Tab 1)可以看出,模型组小鼠肠道SIgA的含量明显低于正常组(P<0.01),作为肠道免疫屏障重要效应因子的SIgA分泌量明显降低说明肠道抵抗外来微生物的能力及肠道粘膜的免疫保护作用明显下降,提示环磷酰胺可以造成肠粘膜SI-gA损伤。与模型组相比,鱿鱼墨多糖低、中、高剂量组小鼠SIgA的含量均明显高于模型组(P<0.05),说明鱿鱼墨多糖对肠粘膜损伤小鼠的SIgA分泌具有改善作用,并且这种改善作用具有剂量依赖性。

Tab 1 Comparison of SIgA content in mouse small intestine
2.5 小肠固有层IgA的表达量 SIgA的分泌主要依赖于分泌IgA的浆细胞,以及表达pIgR的上皮细胞转运功能。为了探讨鱿鱼墨多糖促进肠道SIgA分泌的作用机制,本研究对小鼠肠道IgA和pIgR的表达量进行了研究。
免疫组织化学染色结果显示(Fig 4):相比正常组,模型组小鼠小肠固有层的IgA染色明显较浅,表明环磷酰胺会造成肠粘膜IgA的表达量减少。与模型组相比,鱿鱼墨粗多糖低剂量组表达量有明显变化,且中、高剂量组的小肠固有层IgA明显染色较深,高剂量组IgA染色尤为深。结果表明,北太平洋鱿鱼墨多糖可以改善小肠固有层IgA的表达受损情况,并且呈剂量依赖性。
2.6 肠pIgR mRNA与蛋白质表达量 小肠上皮细胞为肠道粘膜免疫的重要物理屏障,在其基底膜侧表达的pIgR负责转运固有层IgA并形成SIgA,以发挥免疫清除肠道有害因子的作用。为了探究鱿鱼墨多糖改善肠粘膜SIgA的功效,是否与促进pIgR的表达有关,本研究对pIgR的mRNA与蛋白质表达量进行了检测。小肠pIgR的RT-PCR结果(Fig 5)提示:环磷酰胺与鱿鱼墨粗多糖对小鼠小肠上皮细胞pIgR的mRNA表达量影响不大。pIgR的蛋白表达量结果(Fig 6)与mRNA表达量基本相似,环磷酰胺与鱿鱼墨多糖对小鼠小肠上皮细胞pIgR的蛋白表达量影响不大,但鱿鱼墨高剂量组的pIgR蛋白表达量明显增高(P<0.05)。
体外纯化蛋白和细胞与组织表达蛋白的相关研究表明,人、牛、大鼠、小鼠和兔的pIgR均是高度N-糖基化的,分子中大约有15% ~24%碳水化合物[2]。在高剂量组小鼠中,小肠上皮细胞pIgR的表达在转录水平mRNA上没有变化而蛋白质水平上却有明显提高。这可能与鱿鱼墨多糖影响pIgR的转录后调控如糖基化等过程有关。高剂量鱿鱼墨多糖促使pIgR高表达,提示鱿鱼墨多糖对上皮细胞功能具有改善作用。另外,pIgR高表达时,经上皮细胞转运并剪切后在肠腔内形成的分泌片(secretory component,SC)也增多,可以发挥更强的抑制肠道有害菌的作用。

Fig 3 Photographs of small intestine by HE staining

Fig 4 Photographs of IgA expression of small intestine by immunohistochemistry staining

Fig 5 Relative mRNA expression of pIgR in mouse intestine

Fig 6 Expression of pIgR in mouse intestine
3 讨论
肠粘膜表面存在大量的微生物,通常外环境中的大部分病原体进入胃肠道后,会被粘膜天然免疫成分形成的屏障阻止在体外。而肠道分泌的SIgA是肠粘膜免疫的重要免疫屏障,其主要功能是阻抑细菌、病毒等病原体的粘附,使之不能在肠粘膜表面定植并繁殖,从而防止感染的发生[8]。化疗药物、糖皮质激素、严重烫伤、吸烟等因素,都可以导致肠粘膜SIgA的减少[9-10]。当机体SIgA分泌能力下降时,会引起肠道菌群的失调、菌群移位、消化吸收障碍等,甚至还会引起肠炎和肠源性全身感染等情况。此外,临床上出现部分患者在血清中存在抗食物蛋白的抗体和超敏反应发生率的增加,这与SIgA的分泌下降不能有效阻止食物性抗原经肠道入侵有关[11]。因此,寻找促进肠道SIgA分泌的活性物质具有重要意义。
环磷酰胺是一种抗肿瘤的化疗药物,可以导致免疫低下,引起肠道SIgA的减少,适于构建SIgA减少的动物模型。食物和中药首先接触的是胃肠道粘膜免疫,而且几乎没有毒性,成为寻找促进SIgA活性物质的重要来源。已有报道指出:中药四君子汤复方的多糖能使环磷酰胺诱导小鼠的肠粘膜中IgA+细胞数量增加[12];海带多糖能够明显提高小鼠肠粘膜组织中 SIgA含量,并呈剂量依赖效应[13]。鱿鱼墨多糖具有改善免疫功能低下的作用[7],但是对改善肠粘膜SIgA方面的活性尚未见报道。
本研究的结果显示,北太平洋鱿鱼墨多糖可以明显改善环磷酰胺所致免疫功能低下小鼠的胸腺指数和脾指数,初步证实了鱿鱼墨多糖对小鼠具有免疫增强作用。另外,北太平洋鱿鱼墨多糖可以明显改善小鼠肠道SIgA的分泌,提示其对肠道获得性免疫具有改善作用,并且呈剂量依赖关系。肠道SIgA的生成依赖于两种细胞:分泌IgA和J链的浆细胞,以及表达pIgR的肠上皮细胞。本研究结果表明,鱿鱼墨多糖可明显促进小鼠肠道SIgA分泌,这与其促进浆细胞分泌IgA增多和促进上皮细胞表达pIgR相关。小鼠肠道固有层IgA表达量增多,上皮细胞pIgR穿胞转运dIgA含量随之增加,因此分泌到肠腔中的SIgA含量亦会增加而使肠道粘膜防御功能增强。其中鱿鱼墨多糖高剂量组小鼠SIgA的明显升高(P<0.01)可能还与鱿鱼墨多糖促进上皮细胞pIgR表达量增高有关。本研究为鱿鱼墨多糖在食品、营养保健等领域的实际应用提供了一定的理论依据。
[1]Duffield A,Caplan M J,Muth T R.Protein trafficking in polarized cells[J].IntRev Cell Molecul Biol,2008,270:145 -79.
[2]唐庆娟,戚 欣,耿美玉.多聚免疫球蛋白受体(pIgR)在粘膜免疫中的重要功能[J].中国生物化学与分子生物学报,2007,23(9):724-9.
[2]Tang Q J,Qi X,Geng M Y.Important role of polymeric immunoglobulin receptor in mucosal immunity[J].Chin J Biochem Mol Biol,2007,23(9):724 -9.
[3]Alavi A,Stupack D G.Cell survival in a three-dimensional matrix[J].Meth Enzymol,2007,426:85 - 101.
[4]Brandtzaeg P,Carlsen H S,Halstensen T S.The B-cell system in inflammatory bowel disease[J].Adv Exp Med Biol,2006,579:149-67.
[5]Takaya Y.Biological activities of natural resources around us are now in the limelight[J].Yalugaku Zasshi,2000,120(11):1075-89.
[6]雷 敏,赵梦醒,刘 淇.鱿鱼墨黑色素的免疫调节作用[J].食品工业科技,2012,33(6):397-400.
[6]Lei M,Zhao M X,Liu Q.Immunomodulatory effects of sepia melanin on hypoimmune mice[J].Sci Technol Food Indust,2012,33(6):397-400.
[7]刘治东,王静凤,王玉明,等.鱿鱼墨粘多糖对小鼠免疫调节作用的研究[J].中国海洋大学学报,2009,39:147-50.
[7]Liu Z D,Wang J F,Wang Y M,et al.The effect s of squid ink glyco saminoglycan on the immune function of mice[J].Period O-cean Univ China,2009,39:147-50.
[8]Brandtzaeg P.Role of secretory antibodies in the defence against infections[J].Internat J Med Microbiol,2003,293(1):3 -15.
[9]Sano Y,Gomez F E,Kang W,et al.Intestinal polymeric immunoglobulin receptor is affected by type and route of nutrition[J].J Parent Ent Nutrit,2007,31(5):351 -7.
[10]胡正强,江咏梅.SIgA基础与临床研究进展[J].免疫学杂志,2003,19(3):75-8.
[10]Hu Z Q,Jiang Y M.Progress of preclinical and clinical research of SIgA[J].Immunol J,2003,19(3):75 -8.
[11]Wijburg O L,Uren T K,Simpfendorfer K,et al.Innate secretory antibodies protect against natural Salmonella typhimurium infection[J].J Experiment Med,2006,203(1):21-6.
[12]刘 良,周 华,王培训,胡英杰.四君子汤复方总多糖对小鼠肠道粘膜相关淋巴组织的影响[J].中国免疫学杂志,2001,17(4):204-6.
[12]Liu L,Zhou H,Wang P X,Hu Y J.Influence of total polysaccharide extracted from sijunzi decoction on the intestinal mucosa associated lymphoid tissues of mice[J].Chin J Immunol,2001,17(4):204-6.
[13]王庭祥,王庭欣,刘峥颢,等.海带多糖对小鼠肠黏膜组织SI-gA的影响[J].安徽农业科学,2009,37(12):5515-20.
[13]Wang T X,Wang T X,Liu Z H,et al.Effect of Laminarina japonica polysaccharides on the intestinal mucosal secretory SlgA in mice[J].J Anhui Agri Sci,2009,37(12):5515 -20.

