树舌荧光多糖的制备及其在人大肠癌细胞SWWC1116中的定位
苏 玲, 李雨婷, 王再林, 宋 慧, 杜 金, 吴宗翰, 张中北
(吉林农业大学 生命科学学院, 长春 130118)
糖类物质与蛋白质和核酸均为参与生命活动的生物大分子, 不仅提供能量物质(如糖原和淀粉)与细胞内的支撑物(如纤维素和果胶)[1], 还参与介导炎症反应的发生, 影响细胞的生长、 分裂、 分化及细胞间的信号转导[2]. 由于多糖分子极性大, 利用气相色谱和核磁共振等不易直接对其进行测定; 且自身无发光基团, 不能采用紫外吸收光谱和荧光吸收光谱进行检测; 并受生物体自身内源性多糖的干扰, 因此多糖在生物体内代谢、 细胞中定位以及与细胞的识别位点等方面的研究较少. 文献[3-4]对多糖进行了荧光标记; 文献[5]对树舌(Ganodermaapplanatum)多糖进行了研究. 本文选择已被证实具有抗肿瘤和调节机体免疫功能[6-7]的工厂化生产的树舌灵芝液体深层发酵浸膏多糖作为实验材料, 将其进行荧光标记, 旨在示踪树舌多糖在细胞中的定位, 为进一步探索其生物活性的作用机制奠定实验基础.
1 材料与方法
1.1 材料与仪器
树舌液体深层发酵浸膏水提多糖(GAP)由吉林农业大学生命科学学院生化研究室制得(由相对分子量分别为4 600,6 600,30 000的3个均一组分组成, 由葡萄糖、 甘露糖、 岩藻糖、 半乳糖和葡萄糖醛酸等单糖组成); 人大肠癌SWWC1116细胞购自吉林省肿瘤研究所; 酪胺和硼氰化钠(美国Aladdin公司); 异硫氰酸荧光素FITC(美国Sigma公司); RPMI1640(美国Gibco公司); 新生牛血清(兰州民海生物技术有限公司); 其他试剂均为国产分析纯.
BD型流式细胞仪(美国FACS公司); 一体化数码荧光显微镜(深圳博宇显微仪器厂); TU-1810紫外可见分光光度计(北京普析通用仪器有限责任公司); 970CRT荧光分光光度计(上海精密科学仪器有限责任公司); 8400红外光谱仪(日本岛津公司); DG5032酶标仪(南京华东电子集团医疗装备有限责任公司); xCELLigence RTCA DP全自动实时细胞分析仪(美国Roche公司); VS-840-1超净工作台(上海博迅实业有限公司医疗设备厂); Cell240 CO2恒温培养箱(德国贺利氏公司).
1.2 实验方法
1.2.1 GAP的荧光标记 参考文献[8], 对GAP的还原性末端选择性连接荧光基团(FITC). 称取200 mg GAP, 充分溶解于7.5 mL 0.2 mol/L的磷酸盐缓冲液(pH=8.0)后, 加入200 mg酪胺和75 mg硼氰化钠, 于37 ℃反应96 h, 间或震荡, 离心收集上清液, 取500 μL上清液过Sephadex G25层析柱(16 mm×20 cm), 蒸馏水洗脱(0.3 mL/min), 收集洗脱液, 测定每管糖含量及紫外吸光值, 绘制胺化多糖(Try-GAP)洗脱曲线. 收集Try-GAP, 紫外分光光度计在190~500 nm扫描, 根据紫外吸收峰值的变化判断胺化反应是否成功. Try-GAP与FITC避光室温反应过夜, 反应产物经体积分数为75%的乙醇反复沉淀, 所得沉淀经Sephadex G25凝胶柱层析纯化, 测定每管糖含量及荧光吸光值, 绘制荧光多糖(FITC-GAP)洗脱曲线.
1.2.2 红外光谱扫描 分别称取1 mg GAP、 Tyr-GAP及FITC-GAP与KBr混匀压片, 红外光谱仪在4 000~400 cm-1扫描.
1.2.3 荧光取代度测定 参考文献[9], 将FITC配制成1 μg/mL溶液. 取5支锡箔包裹的试管, 分别加入FITC溶液0.5,1.0,1.5,2.0,2.5 mL, 蒸馏水定容至5.0 mL, 混匀. 以蒸馏水为空白对照, 用荧光分光光度计(激发波长488 nm, 发射波长530 nm, 狭缝宽10 nm)测定各管的荧光强度(A). 以FITC质量浓度为横坐标, 荧光强度(A)为纵坐标, 绘制标准曲线, 并计算回归方程. 称取2 mg的FITC-GAP, 蒸馏水定容至10 mL, 取1 mL样品溶液, 加入3 mL蒸馏水混匀后, 检测荧光强度(A), 并将其代入回归方程, 计算GAP的荧光标记效率.
1.2.4 生物活性稳定性 使用含体积分数为10%的热灭活新生牛血清RPMI1640完全培养液, 在体积分数为5%的CO2培养箱中37 ℃贴壁培养人大肠癌细胞SWWC1116. 每2 d用体积分数为0.25%的胰蛋白酶消化传代1次. 处于对数生长期的人大肠癌细胞SWWC1116按每孔5×103个细胞接种于E-Plate多孔培养板中, 将其置于Xcelligence RTCA DP细胞分析仪中, 于37 ℃培养24 h, 每15 min检测细胞指数1次, 弃去培养液, 分别加入含有质量浓度为1,2,3,4,5 mg/mL GAP和FITC-GAP的RPMI1640完全培养液, 再用全自动实时细胞分析仪监测加药48 h内各处理组细胞指数的变化.
1.2.5 流式细胞仪检测大肠癌细胞SWWC1116中的荧光信号 将人大肠癌细胞SWWC1116接种于RPMI1640完全培养液中, 在体积分数为5%的CO2培养箱中37 ℃贴壁培养, 每2 d胰酶消化传代, 细胞计数, 在6孔板中每孔接种5×105个细胞, 24 h后, 设立9个实验组, 每组分别加入含质量浓度为20,100,500 μg/mL的FITC-GAP培养液2 mL, 孵育4,8,12 h, 并以无FITC-GAP培养液2 mL为空白对照组. 收集各组细胞制成单细胞悬液, 洗涤, 固定, 每组按每毫升1×106个细胞计数, 取1 mL细胞悬液, 进行流式分析.
1.2.6 荧光显微镜观察FITC-GAP在人大肠癌细胞SWWC1116中的定位 将人大肠癌细胞SWWC1116接种于RPMI1640完全培养液中, 在体积分数为5%的CO2培养箱中37 ℃贴壁培养, 每2 d 胰酶消化传代, 细胞计数. 按每孔5×105个细胞接种于放有盖玻片的6孔板中, 培养24 h, 吸去培养液, 设立4个实验组, 每组加入含质量浓度100 μg/mL的FITC-GAP的培养液2 mL, 分别孵育2,4,8,12 h. 取出盖玻片, 洗涤, 固定, 荧光显微镜观察拍照.
2 结果与讨论
2.1 GAP荧光标记结果
多糖胺化还原后的洗脱曲线和紫外扫描曲线分别如图1~图4所示. 由图1~图4可见, 糖峰(490 nm)与蛋白峰(280 nm)重合, Tyr-GAP和GAP在λ=280 nm的光吸收值分别为0.076和0.045. Tyr-GAP经FITC亲核加成后, 洗脱曲线的糖峰(490 nm)与FITC荧光峰(450 nm)重合, 表明多糖被荧光标记.
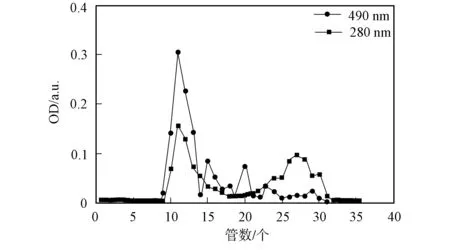
图1 Tyr-GAP洗脱曲线Fig.1 Elution curves of Tyr-GAP
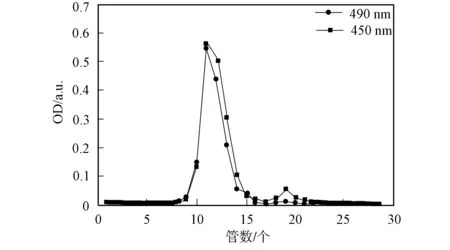
图2 FITC-GAP洗脱曲线Fig.2 Elution curves of FITC-GAP
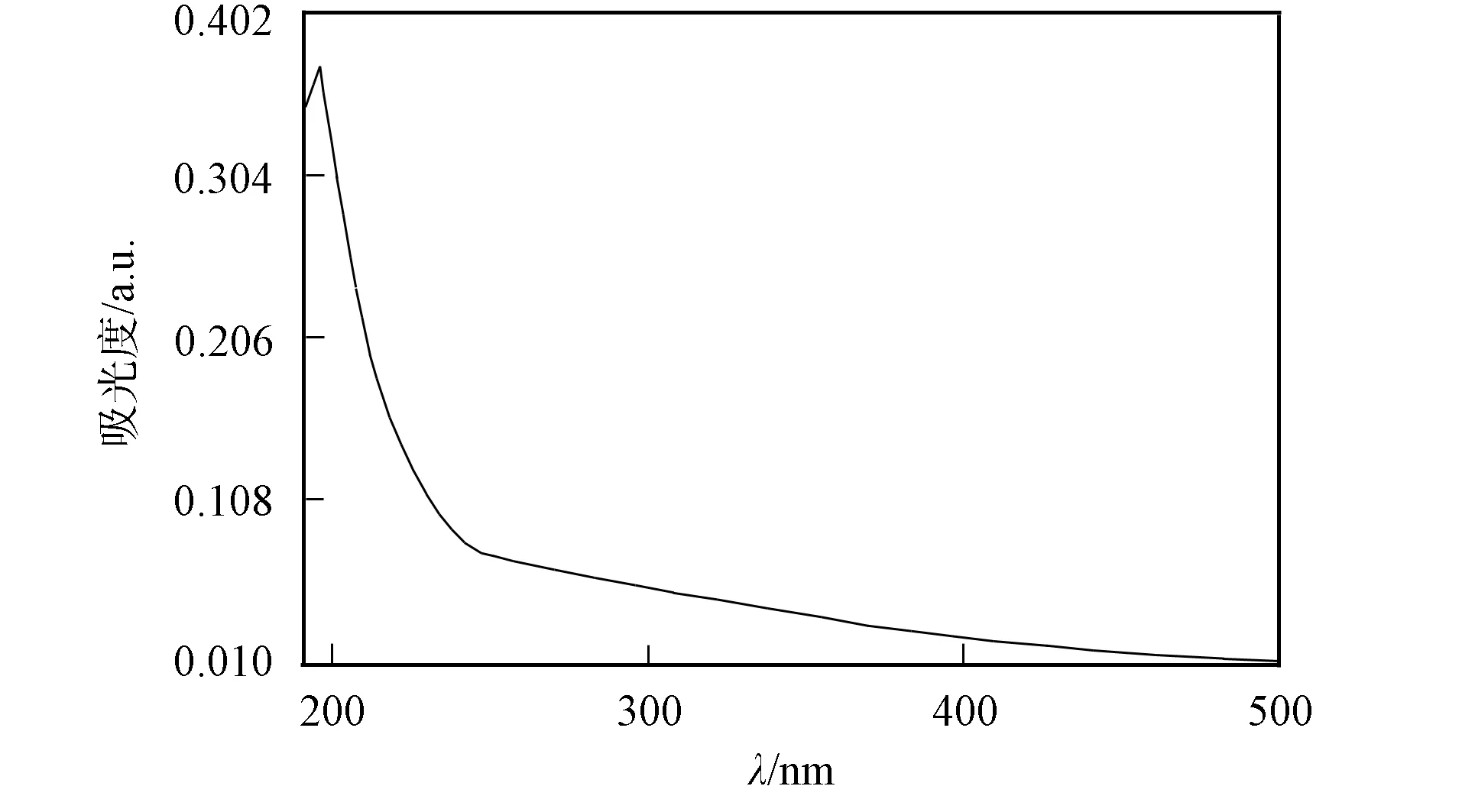
图3 GAP紫外扫描曲线Fig.3 UV curve of GAP
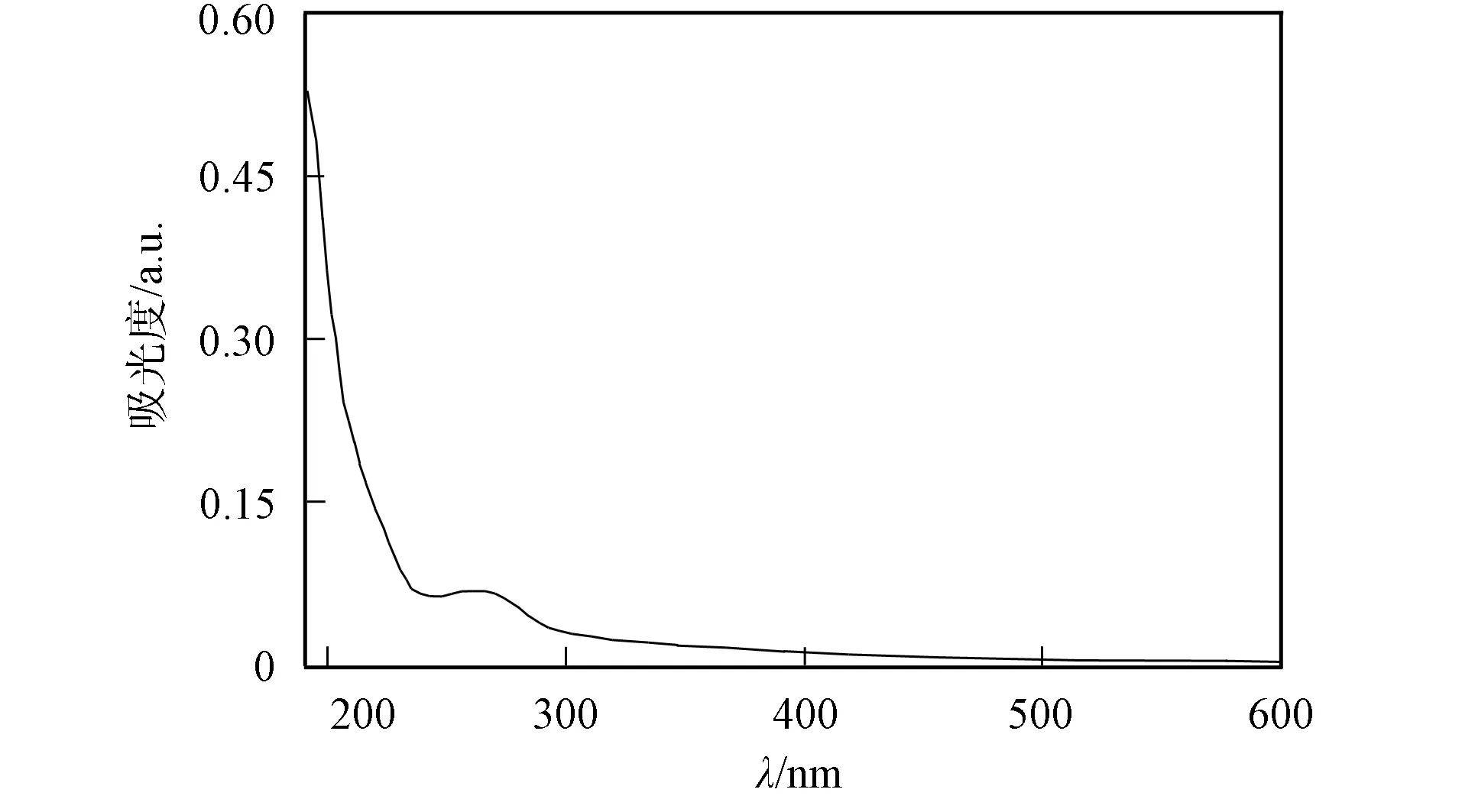
图4 Try-GAP紫外扫描曲线Fig.4 UV curve of Tyr-GAP
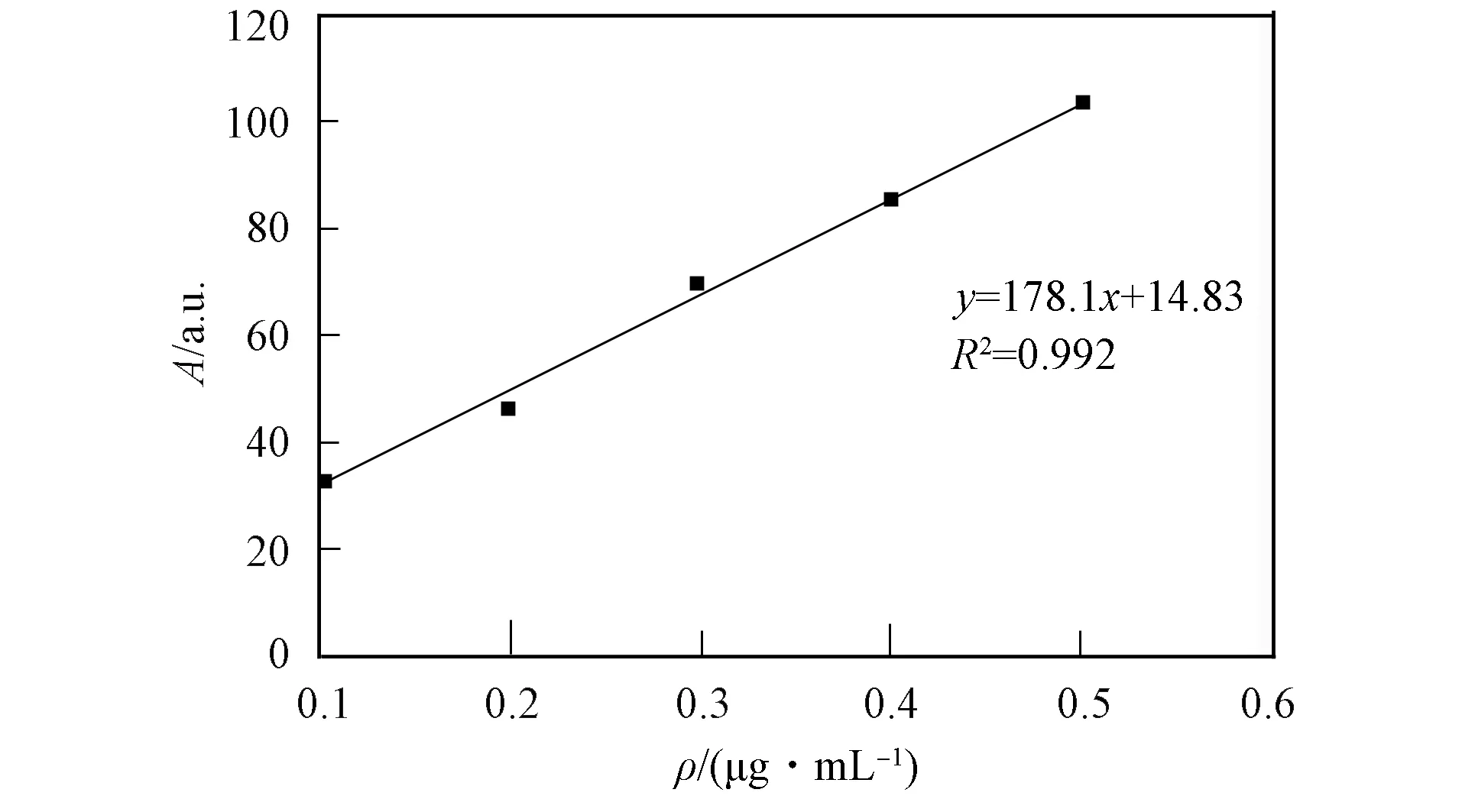
图5 FITC的标准曲线Fig.5 Standard curve of FITC
2.2 红外光谱检测结果

2.3 荧光取代度结果
图5为FITC的标准曲线. 由图5可见, FITC-GAP的荧光强度为34.871, 将其代入回归方程y=178.1x+14.83(R2=0.992), 可得FITC-GAP的荧光标记效率为0.90%. 实验结果表明, 荧光标记后每100 μg GAP中含有0.9 μg FITC.
2.4 细胞毒活性
GAP标记前后的细胞毒活性如图6所示, 其中横坐标表示时间, 纵坐标表示细胞指数, GAP反映贴壁细胞大小、 细胞数量、 细胞贴附面积和贴附的紧密程度等细胞整体状态, 细胞指数随贴壁细胞的增多、 贴壁后面积的增大和贴附紧密程度的增加而变大. 实验结果表明, GAP标记FITC后, 对人大肠癌细胞SWWC1116的细胞毒性与标记前基本一致, 即荧光标记后并未影响GAP的生物活性, 保证了GAP的生物学稳定性.
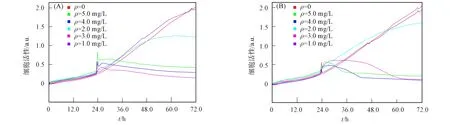
图6 GAP(A)和FITC-GAP(B)的细胞毒活性Fig.6 Cytotoxin activities of GAP (A) and FITC-GAP (B)
2.5 FITC-GAP在人大肠癌细胞SWWC1116中的定位
SWWC1116细胞的荧光信号如图7所示. 由图7可见: 各实验组均检测到FITC-GAP的荧光信号; 在相同的孵育时间下, 细胞上的荧光强度和被标记细胞数随加入FITC-GAP质量浓度的降低而下降; 当FITC-GAP的质量浓度为100,20 μg/mL时, 随孵育时间的延长, 荧光强度和被标记细胞数升高; 当FITC-GAP的质量浓度为500 μg/mL时, 荧光强度和被标记细胞数随孵育时间的改变不明显. 表明GAP可与人大肠癌细胞SWWC1116结合, 并受孵育时间及GAP加入质量浓度的影响.
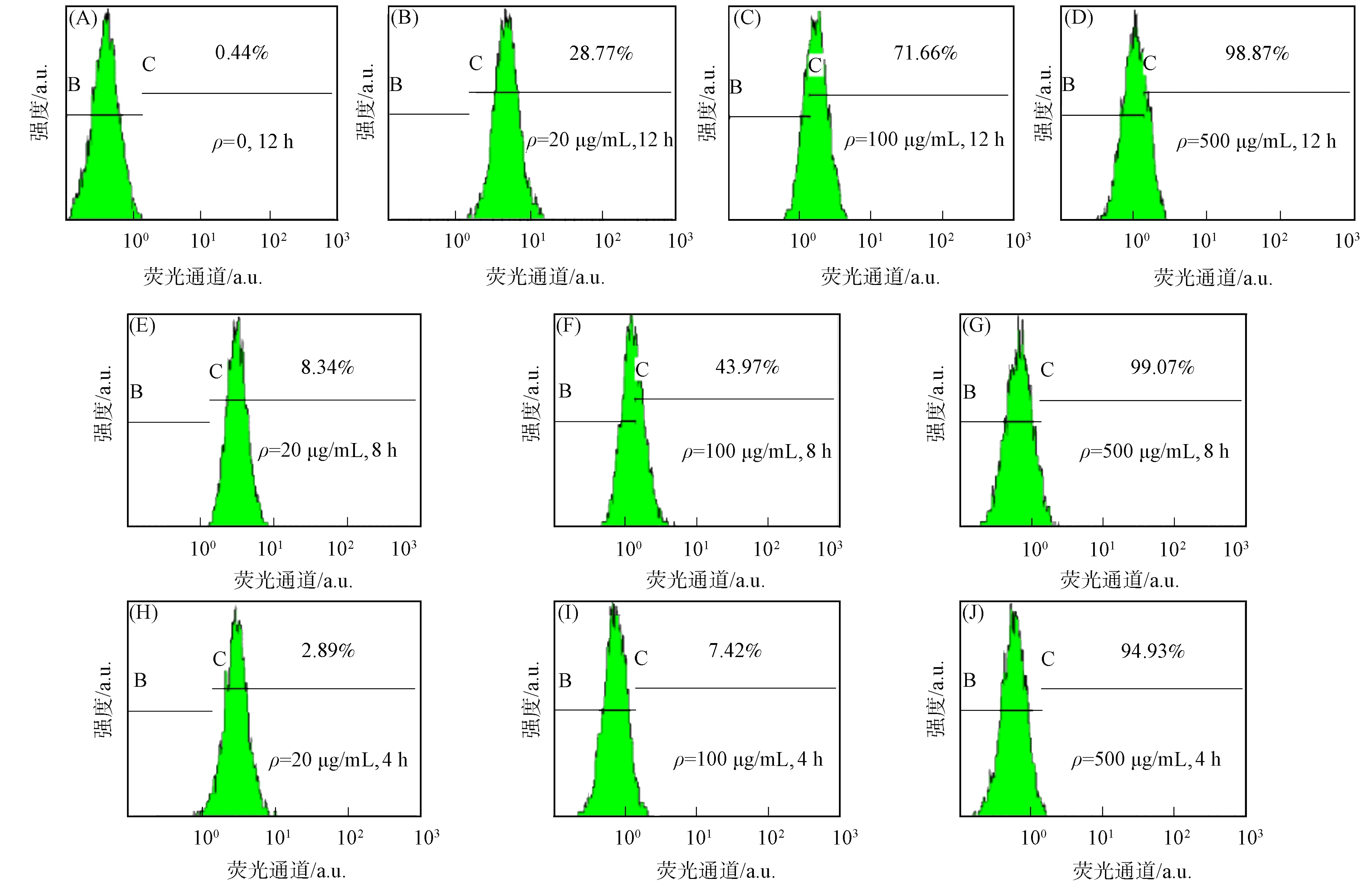
图7 SWWC1116细胞的荧光信号Fig.7 Fluorescence intensity of SWWC1116
2.6 荧光显微镜观察FITC-GAP在人大肠癌细胞SWWC1116中的定位
SWWC1116细胞的荧光显微照片如图8所示. 由图8可见, 当FITC-GAP与靶细胞SWWC1116作用2 h时, 细胞膜上有少量荧光发光. 当孵育时间分别为4,8,12 h时, 细胞膜上及细胞核内均检测到荧光信号. 表明GAP可与人大肠癌细胞SWWC1116的细胞膜结合, 并可转运至细胞核内.

图8 SWWC1116细胞的荧光显微照片Fig.8 Fluorescent microscopic pictures of SWWC1116
综上, 本文通过对GAP的半缩醛基上引入荧光基团FITC, 使GAP“可视化”, 发现GAP可与人大肠癌细胞SWWC1116的细胞膜结合并转运至细胞核, 表明GAP在SWWC1116细胞表面的特异性位点通过载体转运或细胞胞吞等方式进入胞内.
[1] 郭振楚. 糖类化学 [M]. 北京: 化学工业出版社, 2005.
[2] Walz G, Aruffo A, Kolanus W, et al. Recognition by ELAM-1 of the Sialyl-Lex Determinant on Myeloid and Tumor Cells [J]. Science, 1990, 23: 1132-1135.
[3] Jackon P. The Use of Polyacrylamide-Gel Electrophoresis for the High-Resolution Separation of Reducing Saccharides Labeled with the Fluorophoresis 8-Aminonaphthalene-l,3,6-trisulfonic Acid [J]. Biochemical Journal, 1990, 270(3): 705-713.
[4] Kbckow A, Amado R, Widmer H M, et al. Separation of 8-Aminonaphthalene-l,3,6-trisulfonic Acid-Labeled Neutral and Sialylated N-Linked Complex Oligosaccharides by Capillary Electrophoresis [J]. J Chromatogaphy A, 1995, 716(1): 241-257.
[5] Usui T, Iwasaki Y, Mizuno T, et al. Isolation and Characterization of Antitumor Activeβ-D-Glucans from the Fruit ofGanodermaapplanatum[J]. Carbohydr Res, 1983, 115(1): 273-280.
[6] LÜ Jin-chao. Study on Antitumor Activities of Polysaccarides from Submerged Fermentation of Fugi [D]. Changchun: Jilin Agricultural University, 2010. (吕金超. 真菌液体深层发酵浸膏多糖抗肿瘤活性研究 [D]. 长春: 吉林农业大学, 2010.)
[7] LIU Xiao-la. Study on Antitumor Activities of Polysaccarides from Submerged Fermentation ofGanodermaapplanatum(Pers.) Pat [D]. Changchun: Jilin Agricultural University, 2011. (刘晓腊. 树舌灵芝液体深层发酵浸膏多糖的抗肿瘤抗肿瘤活性研究 [D]. 长春: 吉林农业大学, 2011.)
[8] LI Fu-chuan, GENG Mei-yu, LI Ying-xia, et al. Studies on Fluorescent Labeling of Marine Sulfated Polysaccharide 911 [J]. Chemical Journal of Chinese Universities, 2002, 23(9): 1704-1708. (李福川, 耿美玉, 李英霞, 等. 海洋硫酸多糖911的荧光标记研究 [J]. 高等学校化学学报, 2002, 23(9): 1704-1708.)
[9] LÜ Zhi-hua. Studies on Fluorescent Labeling and Pharmacokinetics of Marine Sulfated Polysaccharide PS916 [D]. Qingdao: China Marine University, 2008. (吕志华. 海洋多糖药物PS916的荧光标记及其药代动力学研究 [D]. 青岛: 中国海洋大学, 2008.)

