HIV-GAG质粒DNA疫苗的纯化工艺
刘新涛,吴丛梅,臧 阳,孙 博,殷玉和
(1.长春工业大学 化学与生命科学学院,长春 130012;2.吉林大学 生命科学学院,长春 130012)
DNA疫苗是指直接向宿主体内免疫能编码病原体有效抗原的质粒,相应抗原在体内进行表达后便诱导机体产生特异性抗体,并引起细胞免疫反应而获得保护力[1-4].与传统疫苗相比,DNA疫苗能够诱导广泛的免疫反应[5-6].由于质粒DNA的转染效率较低,临床应用中需要毫克级的质粒DNA,因此DNA疫苗必须达到克级以上的生产规模以满足需要.本文建立了HIV-GAG药用级质粒DNA疫苗规模化生产工艺,通过使用高盐沉淀RNA、 中空纤维超滤浓缩、 离子交换介质和复合模式凝胶过滤介质,对质粒DNA纯化,去除RNA、 染色体DNA、 宿主蛋白质和内毒素等杂质,获得了高纯度的质粒DNA.其工艺流程如图1所示.
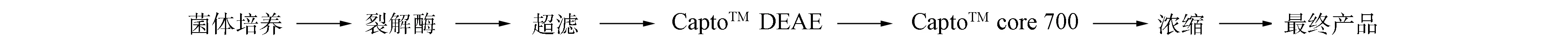
图1 药用级HIV-GAG质粒DNA疫苗工艺流程
Fig.1 Process flow sheet describing purification of HIV-GAG DNA
1 材料和方法
1.1 材 料
含有HIV核心抗原质粒的大肠杆菌菌株DH5α由吉林大学生命科学学院艾滋病疫苗国家工程实验室提供.质粒大小为6.4 kb.CaptoTMcore 700和CaptoTMDEAE购于美国GE(GE Healthcare Life Science)公司.
1.2 细菌培养及碱裂解
E.coliDH5α菌种和LB培养基经摇瓶扩增培养后,转接到生物反应器中于37 ℃培养,通过搅拌速度和补料速度控制溶氧量,收获的细菌经离心后于-20 ℃保存.
取200 g大肠杆菌DH5α发酵菌体,加入1.6 L预冷溶液Ⅰ(50 mmol/L Tris-HCl,10 mmol/L EDTA,pH=8.0)中,搅拌混匀后,加入1.6 L溶液Ⅱ(0.2 mol/L NaOH,质量分数为1.0%的十二烷基硫酸钠(SDS)),缓慢搅拌10 min; 再加入1.6 L预冷溶液Ⅲ(3 mol/L KAc,pH=5.5),形成白色絮状沉淀物,反应30 min,最后加入2.0 mol/L的CaCl2溶液1.6 L,摇匀,静置1 h,溶液分为两层,其中上层为白色絮状物,下层为裂解液,将下层裂解液用蠕动泵导出并用1.0 μm孔径的滤芯过滤除杂.
1.3 超滤浓缩
将裂解液通过Quickstand超滤分离系统用分子量为300 000的中空纤维超滤膜(美国GE Healthcare Life Science公司,膜面积850 cm2,膜纤维管直径1 mm)过滤.经6.895 kPa膜负压(TMP)1.5 h后,浓缩体积为200 mL,用注射用水将其稀释5倍.
1.4 离子交换层析(CaptoTM DEAE)及凝胶过滤层析(CaptoTM core 700)


1.5 超滤浓缩及无菌过滤
将CaptoTMcore 700纯化后样品通过Quickstand超滤分离系统用分子量为300 000的中空纤维超滤膜(美国GE Healthcare Life Science公司,膜面积140 cm2,膜纤维管直径1 mm)过滤.经6.895 kPa膜负压1 h.
1.6 蛋白质量比的测定
用MicroBCA试剂盒(美国Pierce公司)测定HIV-GAG DNA疫苗中的蛋白质量比.反应体系中的混合物(100 μL HIV-GAG DNA疫苗样品,100 μL micro-BCA试剂)在60 ℃水浴锅中孵育30 min,在λ=562 nm下检测蛋白的吸收值.
1.7 检测基因组DNA和内毒素
用Southern blot方法[7]检测基因组DNA污染.通过PCR方法扩增大肠杆菌DH 5α菌株16S RNA的361 bp片段(正向引物:5′-ACACGGTCCAGACTCCTACG-3′;反向引物:5′-TACACCTGGAATTCTACCCC-3′),用Digoxigenin-11-dUTP(美国Boehringer Mannheim公司)标记; 用碱性磷酸酶标记的地高辛对杂交探针进行免疫检测,通过碱性磷酸酶底物显色(NBT/BCIP)进行观察.用鲎试剂(湛江安度斯生物有限公司)凝胶法检测内毒素.
2 结果与讨论
2.1 碱裂解及质粒粗纯
细菌按1∶8分别加入溶液Ⅰ~Ⅲ和2.0 mol/L CaCl2进行菌体裂解,裂解液经过滤除杂后,通过Quickstand超滤系统用分子量为300 000的中空纤维超滤膜进行超滤浓缩.
2.2 CaptoTM DEAE色谱纯化
裂解浓缩液经注射用水稀释至电导值为合理数值的浓度.图2为CaptoTMDEAE纯化质粒DNA疫苗的色谱,其中峰1~ 峰3分别为缓冲液B洗脱RNA、 缓冲液C洗脱质粒DNA及CIP洗脱基因组DNA.各洗脱样品的琼脂糖凝胶电泳谱如图3所示.由图3可见,当加入高盐氯化钙时,去除了大部分RNA杂质; 裂解浓缩液经CaptoTMDEAE纯化后,质粒浓度明显提高,但仍存在少量RNA.

图2 CaptoTM DEAE纯化HIV-GAG DNA疫苗色谱Fig.2 CaptoTM DEAE purification of HIV-GAG DNA vaccine

1: 碱裂解未加CaCl2样品;2: 碱裂解加CaCl2后样品;3: 流穿峰样品;4: 溶液B洗脱峰样品;5: 溶液C洗脱峰样品;6: CIP溶液洗脱峰样品;7: 水洗脱峰样品;8: 1 kb DNA Ladder.图3 CaptoTM DEAE纯化HIV-GAG DNA 疫苗琼脂糖凝胶电泳图谱Fig.3 Agarose gel electrophoresisanalysis of CaptoTM DEAE purification of HIV-GAG DNA vaccine
2.3 CaptoTM core 700介质纯化
用CaptoTMcore 700进一步纯化质粒DNA,其色谱如图4所示,其中峰1为质粒DNA峰,峰2为CIP溶液洗脱下来的杂质峰.图5为经CaptoTMcore 700进一步纯化获得高纯度质粒DNA的琼脂糖凝胶电泳图谱.经超滤浓缩和无菌过滤,质粒DNA质量浓度达1.0 mg/mL.
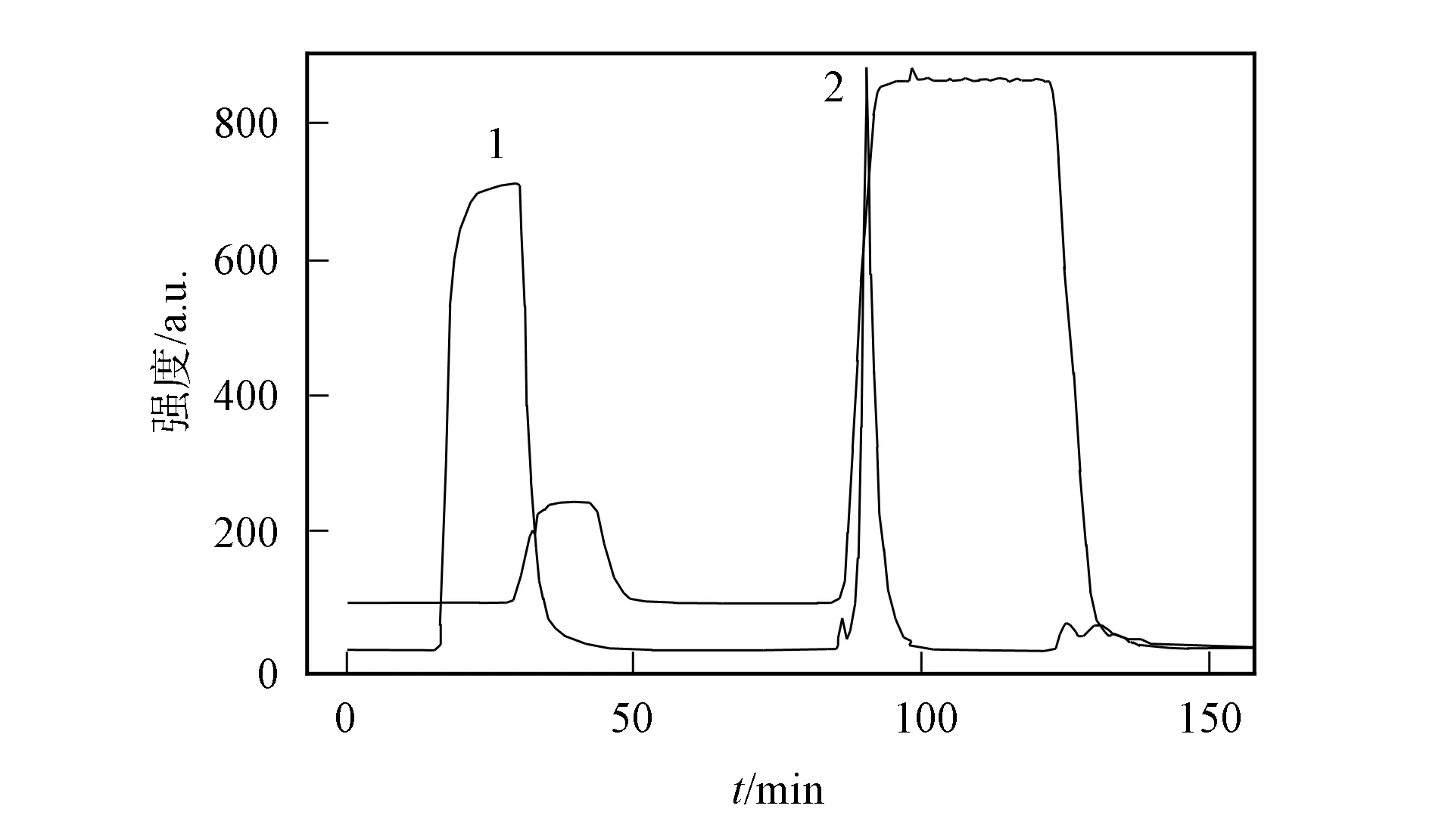
图4 CaptoTM core 700纯化图谱Fig.4 CaptoTM core 700 purification of HIV-DNA vaccine

1: CaptoTM core 700纯化样品;2: 1 kb DNA Ladder.图5 CaptoTM core 700纯化HIV-GAG DNA 疫苗琼脂糖凝胶电泳图谱Fig.5 Agarose gel electrophoresisanalysis of CaptoTM core 700 purification of HIV-GAG DNA vaccine
2.4 HIV-DNA疫苗检测结果
HIV-GAG质粒DNA疫苗经过检测,符合《中华人民共和国药典》[8]相关规程,检测结果列于表1.由表1可见,制备的HIV-GAG质粒DNA疫苗的基因组DNA质量比低于1 μg/mg,蛋白质质量比低于2 μg/mg,内毒素质量比低于10 EU/mg,用琼脂糖凝胶电泳方法检测表明无RNA残留.
2.5 讨 论
大规模生产DNA疫苗过程中的一个关键环节是菌体裂解步骤,本文采用改良后的碱裂解方法[9]破碎大肠杆菌,提高了裂解效率.加入溶液Ⅱ后应缓慢搅拌,避免局部pH值过高,过高的pH环境可使质粒DNA变性并破坏基因组DNA,导致不易分离质粒DNA(pH>12.5)[10].Urthaler等[11]研制的自动碱裂解装置能够温和地碱裂解大肠杆菌细胞,从而获得均一且稳定的质粒DNA,并能避免极端pH值的影响.本文利用低剪切桨叶搅拌也能解决该问题,裂解后向裂解液中加入高浓度的CaCl2溶液,可沉淀大部分高分子量的RNA及宿主蛋白.因此在大规模生产过程中,既可在离子交换层析前调整离子强度除去RNA[12],也可采用分子筛层析法分离RNA和DNA[13].本文采用高盐沉淀高分子量RNA和超滤去除低分子量RNA的方法,可除去RNA、 大多数蛋白质、 内毒素及基因组DNA,提高了质粒DNA的纯化效率.并采用CaptoTMcore 700凝胶介质用于纯化HIV-GAG质粒DNA疫苗.

表1 HIV-DNA疫苗质量检测结果Table 1 HIV-DNA vaccine quality test
综上,本文通过碱裂解的方法破碎菌体,采用超滤浓缩的方法将裂解液浓缩,通过离子交换介质和复合模式凝胶过滤介质进行纯化获得了HIV-GAG药用级质粒DNA疫苗.
[1] Danko I,Wolff J A.Direct Gene Transfer into Muscle [J].Vaccine,1994,12(16): 1499-1502.
[2] Ledley F D.Nonviral Gene Therapy: The Promise of Genes as Pharmaceutical Products [J].Hum Gene Ther,1995,6(9): 1129-1144.
[3] Alarcon J B,Waine G W,McManus D P.DNA Vaccines: Technology and Application as Anti-parasite and Anti-microbial Agents [J].Adv Parasitol,1999,42: 343-410.
[4] Robinson H L,Pertmer T M.DNA Vaccines for Viral Infections: Basic Studies and Applications [J].Adv Virus Res,2000,55: 1-74.
[5] Dolter K E,Evans C F,Ellefsen B.Immunogenicity,Safety,Biodistribution and Persistence of ADVAX,a Prophylactic DNA Vaccine for HIV-1,Delivered byinvivoElectroporation [J].Vaccine,2010,29(4): 795-803.
[6] Vasan S,Schlesinger S J,HUANG Yao-xing,et al.Phase 1 Safety and Immunogenicity Evaluation of ADVAX,a Multigenic,DNA-Based Clade C/B′ HIV-1 Candidate Vaccine [J].PLoS One,2010,5(1): e8617.
[7] Southern E.Southern Blotting [J].Nature Protocols,2006,1(2): 518-525.
[8] 国家药典委员会.中华人民共和国药典 [M].2010版.第三部.北京:中国医药科技出版社,2010.
[9] Sambrook J,Russell D W.Molecular Cloning: A Laboratory Handbook [M].3rd ed.New York: Cold Spring Harbor Laboratory,2001.
[10] Meacle F J,Lander R,Ayazi S P,et al.Impact of Engineering Flow Conditions on Plasmid DNA Yield and Purity in Chemical Cell Lysis Operations [J].Biotechnol Bioeng,2004,87(3): 293-302.
[11] Urthaler J,Ascher C,Wohrer H.Automated Alkaline Lysis for Industrial ScalecGMP Production of Pharmaceutical Grade Plasmid-DNA [J].J Biotechnol,2007,128(1): 132-149.
[12] Eon-Duval A,Burke G.Purification of Pharmaceutical-Grade Plasmid DNA by Anion-Exchange Chromatography in an RNase-Free Process [J].J Chromatogr B: Analyt Technol Biomed Life Sci,2004,804(2): 327-335.
[13] Ferreira G N,Cabral J M,Prazeres D M.Purification of Supercoiled Plasmid DNA Using Chromatographic Processes [J].J Mol Recognit,1999,11: 250-251.

