东亚飞蝗抗菌活性物质的萃取及抗菌效应研究
骆 雪,张春勇 ,陈克嶙,郭荣富
(云南农业大学 云南省动物营养重点实验室,云南 昆明 650201)
抗生素是微生物代谢的次级产物,在低浓度时能抑制动物病原菌的生长和繁殖,但抗生素长期大量使用及滥用,导致病原菌的耐药菌株不断增多,增加许多疾病的治疗难度。因此,研究和应用安全新型抗生素替代品已成为重要课题内容。近年来研究发现,抗菌肽不但抗菌谱广,而且不易使病原菌产生耐药菌株,被认为是现有抗生素的最佳替代品,已成为抗菌研究及应用的热点。蝗虫在我国分布广泛,资源丰富易养殖,具有很强的抗病能力,存在独特的免疫机制,迄今为止,对蝗虫抗菌肽类物质的诱导表达及其抗菌效应尚未见报道。Boman等[1]诱导分离出第一种抗菌肽-天蚕素,与传统的抗菌素生物肽不同,它是由真核细胞基因编码的多肽类抗菌分子。研究表明,不同物种的抗菌肽一级结构具有不少相似之处[2],即分子量小、呈碱性、N端亲水、C端疏水、有两个α螺旋、热稳定性好、不易被水解、无免疫原性等特点。在体外,抗菌肽浓度在10~100 μg/ mL时,对多种细菌就有杀伤作用,而在中性粒细胞中的浓度为mg/mL级,远超过这个数值,表明抗菌肽在体内可能具有很强的杀菌活性[3]。目前已从昆虫如天蚕蛹、果蝇、麻蝇等中分离得到了多种抗菌肽。研究表明,蝗虫体内营养成分非常丰富,不但蛋白质和脂肪含量高、氨基酸和维生素种类较多,而且还含有大量人体必需的微量元素[4-5]。但对东亚飞蝗抗菌物质与抗菌效应的研究鲜见报道。本研究首次以典型植食性优势种,直翅目(Orthoptera)、蝗总科(Acridoidea)、东亚飞蝗(Locustamigratoriamanilensis)为材料,以针刺成虫腹部,浸泡大肠杆菌菌悬液,采用乙酸铵缓冲液浸提方法以获得含抗菌活性物质的粗提物,为防止蛋白酶的降解,加入合适蛋白酶抑制剂PMSF,再经透析等手段纯化、分析检测东亚飞蝗中抗菌肽类物质与抗菌效应,为东亚飞蝗新型抗菌肽研究和应用提供新的试验证据。
1 材料与方法
1.1 材 料
1.1.1 菌 株 大肠杆菌、枯草芽孢杆菌、金黄色葡萄球菌,水稻白叶枯病原菌,均由云南农业大学微生物教研室提供。所有菌株均在营养丰富的培养基上生长。
1.1.2 东亚飞蝗 选取生长40~50 d左右的东亚飞蝗,云南禄劝东亚飞蝗养殖场赠送。
1.1.3 饲养管理 饲养笼用细长木棍制成相同规格的立方形蝗虫笼架,用纱窗或医用纱布制成立方形,一边带有门,便于饲料的投放。饲料为鲜嫩的禾本科植物,蝗虫采食时间在早晨9∶00至下午5∶00,每天2~3次。
1.1.4 主要试剂 蛋白胨、牛肉膏、胰蛋白胨、酵母膏(Oxoid, 美国);苯甲基磺酰氟、聚乙二醇、巯基乙醇、乙酸铵、HCl、NaOH(Amresco,美国);透析袋(Sigma,美国)。
1.1.5 主要仪器 超低温冰箱 (美国 FORMA) ;低温4 ℃离心机 (Legend Micro21,美国Thermo公司);自动灭菌锅(SANYO日本三洋);高速组织匀浆机(德国BILON公司);电热恒温培养箱 (成都电烘器厂)。
1.2 方 法
1.2.1 抗菌活性物质粗提物的制备 东亚飞蝗成虫针刺腹部,浸泡在处于对数生长期(3×108CFU/mL)的大肠杆菌菌悬液中10 min,分别饲养24、48、72 h后,收集虫体,与没有刺激浸泡的虫体,分为四组于-80 ℃冷冻过夜。取出放入高速组织匀浆机中捣碎成浆糊状,按重量/体积比为1∶3加入提取液(0.05 mol/L 乙酸铵缓冲液、35 μg/mL PMSF、2 % 巯基乙醇),充分捣碎,匀浆液用400目纱网过滤,滤液4 ℃ 12 000 r/min离心30 min,取上清液,沉淀再用0.05 mol/L 乙酸铵缓冲液浸泡后冷冻离心,重复三次,合并上清液。将上清液在沸水浴中搅拌加热5 min,迅速在冰浴中冷却后,经4 800 r/min离心30 min除去变性蛋白,沉淀再用少量蒸馏水洗涤两次,以同样转速离心30 min,合并三次上清液,放于洁净样品瓶内加盖,-80 ℃保存。
1.2.2 抗菌活性物质粗提物活性筛选 分别测定无刺激以及刺激后饲养24、48、72 h提取的抗菌活性物质粗提物的抑菌活性。在每个消毒培养皿(直径,9 cm)中将14 mL经高压灭菌冷却至50 ℃的固体培养基与200 μL的对数生长期的菌液快速混合均匀,待冷凝后,在培养皿中等距离加入两个牛津杯,分别在牛津杯中加入150 μL的蝗虫粗提液,然后放入恒温培养箱中,适当温度下培养,测量并记录透明区域直径大小来表示抑菌作用大小。
1.2.3 抗菌活性物质粗提物的纯化 参照陆健等采用的方法[6],将上述抑菌效果最好的一组粗提物装入透析袋内,排出袋中空气,封住袋子另一端,将透析袋包埋于10倍于蛋白质样品体积的装有20%聚乙二醇溶液的容器中,在4 ℃,电磁搅拌器缓慢搅拌至达到所需浓度。一方面将样本中保留的小分子蛋白质和多肽进一步得到浓缩,另一方面又除去了缓冲液中的尿素和盐类,使小分子蛋白质和多肽得到了进一步纯化。将透析浓缩的样品再次在4 ℃下, 12 000 r/min离心30 min,将沉淀的蛋白质及少量的脂肪除去,取上清液-80 ℃保存,即为纯化的抗菌活性物质。
1.2.4 纯化抗菌活性物质对细菌的抑菌效应 分别比较抗菌活性物质对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌以及水稻白叶枯病原菌的抑菌活性,采用国际通用抗生素效价测定方法即杯碟法,测定抑菌圈直径,每种菌种3次平行。将菌种接种于LB液体培养基中在恒温摇床中37 ℃培养6 h,然后将培养液稀释成106 个/mL的菌液。取500 μL的菌液涂布于LB固体培养基制成平板中,放上4个牛津杯,分别加上200 μL的样品液,200 μL的蒸馏水作为阴性对照,最后一个则不加任何物质作为空白对照。然后在37 ℃恒温培养箱中培养过夜,第二天观察记录抑菌效果。
1.2.5 抗菌活性物质浓度测定 依照紫外吸收法[7]取纯化后的抗菌活性物质溶液50 μL,用蒸馏水稀释,分别在280 nm、260 nm处测定吸收值,按下式计算蛋白浓度(mg/mL)。
c=(1.45 A280-0.74 A260)×稀释倍数
式中:c为抗菌活性物质原始浓度(mg/mL);A280为蛋白溶液在280 nm处测得的吸光度;A260为蛋白溶液在260 nm处测得的吸光度。
1.2.6 抗菌活性物质收率测定 东亚飞蝗抗菌活性物质收率测定用邹锋采用的方法[8]。
蝗虫抗菌活性物质收率=c·V/m×100%
式中:c为抗菌活性物质滤液浓度(mg/mL);V为滤液体积(mL);m为蝗虫质量(g)。
2 结 果
2.1 抗菌活性物质粗提物的萃取
三组刺激后的东亚飞蝗与未经诱导的一组东亚飞蝗,每组10只,去除腿与翅膀后,经过组织匀浆,每组各得到16 mL左右的匀浆液,经处理纯化后得到粗提物13 mL,各组取3 mL做抑菌试验。
2.2 粗提物抗菌活性的筛选
本试验中,无刺激以及刺激后饲养24 h、48 h和72 h不同处理条件下的东亚飞蝗抗菌活性物质粗提液均有一定的抑菌活性(图1)。图1结果显示,未刺激与刺激后饲养72 h的两组东亚飞蝗抗菌活性物质粗提液抑菌活性效果不明显;针刺腹部,浸泡大肠杆菌后饲养48 h的东亚飞蝗抗菌活性物质粗提液抑菌活性明显高于对照和刺激后饲养72 h的抗菌活性物质粗提液;针刺腹部,浸泡大肠杆菌后饲养24 h的东亚飞蝗抗菌活性物质粗提液抑菌活性在四组中最高。

图1 四组不同处理条件下东亚飞蝗抗菌活性物质粗提液抑菌效果Fig.1 Bacteriostasis effects of Asiatic migratory locust antibacterialactivity materials extract liquid in different treatment conditions
A.正常饲养未经针刺腹部、浸泡大肠杆菌悬液的蝗虫粗提液;B.针刺腹部、浸泡大肠杆菌菌悬液,饲养24 h后蝗虫粗提液;C.针刺腹部、浸泡大肠杆菌菌悬液,饲养48 h后蝗虫粗提液;D.针刺腹部、浸泡大肠杆菌菌悬液,饲养72 h后蝗虫粗提液
Noet:A.The locusts crude extracts of normal feeding without needle abdomen, soakE.colisuspension;B.The locusts crude extracts of abdomen was needled and soakE.colibacterial suspension then feeding 24 h ;C.The locusts crude extracts of abdomen was needled and soakE.colibacterial suspension then feeding 48 h; D.The locusts crude extracts of abdomen was needled and soakE.colibacterial suspension then feeding 72 h
2.3 抗菌活性物质粗提物的纯化结果
将上述抑菌效果最好一组,即针刺腹部、浸泡大肠杆菌菌悬液饲养24 h后的东亚飞蝗抗菌活性物质粗提液透析过夜,透析浓缩后再次置于4 ℃下,12 000 r/min 离心30 min,检测其对金黄色葡萄球菌抑菌活性,如图2所示。

图2 纯化的蝗虫抗菌活性物质提取液抑菌效果A.纯化前粗提液;B. 纯化后粗提液Fig.2 Bacteriostasis effects of purified Asiatic migratory Locust antibacterial activity materials extract liquidA.crude extract before purified;B.crude extract liquid after purified
2.4 抗菌谱的测定
东亚飞蝗抗菌活性物质粗提液对革兰氏阳性菌(如金黄色葡萄球菌、枯草芽孢杆菌)或对革兰氏阴性菌(如大肠杆菌、水稻白叶枯病原菌)均有一定的抑制作用,其抗菌谱为:金黄色葡萄球>水稻白叶枯病原菌>枯草芽孢杆菌>大肠杆菌(见图3),其中以对金黄色葡萄球菌的抑菌效果最明显(见图4)。
2.5 抗菌活性物质的浓度
东亚飞蝗抗菌活性物质的浓度c=(1.45A280-0.74A260)×稀释倍数=(1.45×2.092-0.74×2.507)×10=11.782 mg/mL
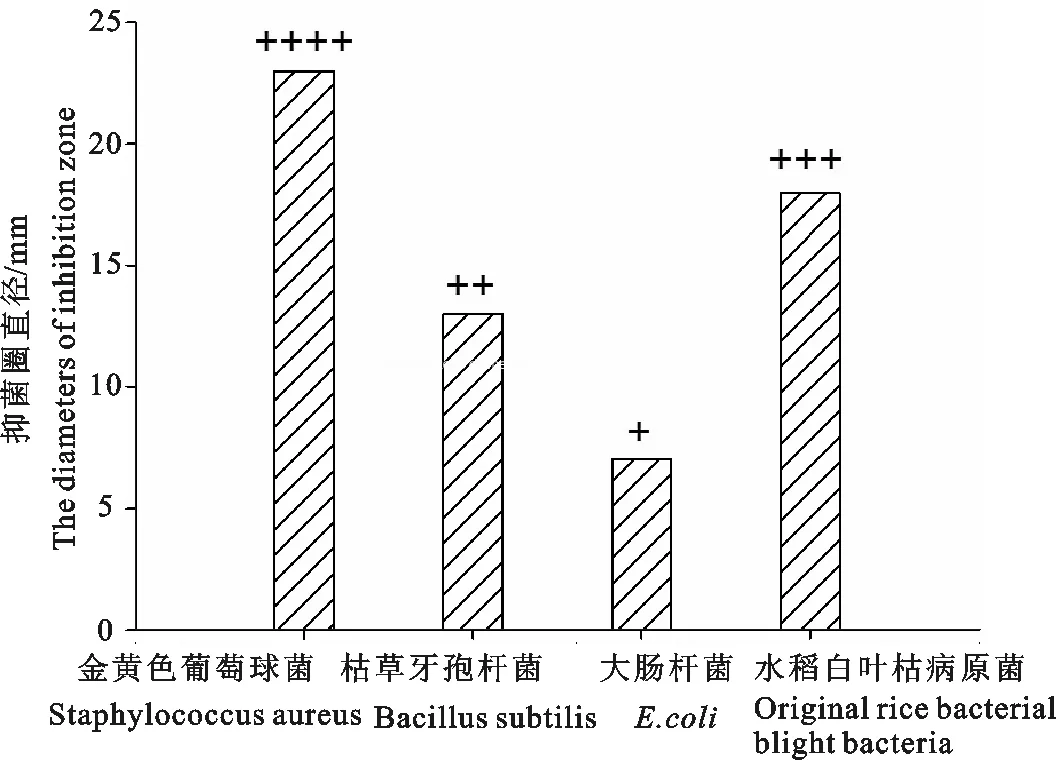
图3 东亚飞蝗抗菌活性物质对细菌的抗菌谱
Fig.3 Antibacterial activity spectrum of antibacterial sub-stances of oriental migratory locust on bacterial
-.无活性(inactive);+.5.0~10 mm; ++.10.0~15 mm; +++.15.0~20 mm;++++.20.0~25 mm
2.6 抗菌活性物质的收率
蝗虫抗菌活性物质收率=c·V/m×100 %=11.782×69.6÷9509.35=8.623%

图4 东亚飞蝗粗提物对革兰氏阳性菌与革兰氏阴性菌的抑菌效果Fig.4 Bacteriostasis effects of Asiatic migratory locust antibacterial activity materials extract liquid in gram-positive bacteria and gram-negative bacteriaA.大肠杆菌;B.金黄色葡萄球菌;C.水稻白叶枯病原菌;D.枯草芽孢杆菌A. E. coli bacteria;B.Staphylococcus aureus;C. Original rice bacterial blight bacteria;D.Bacillus subtilis
3 讨 论
20世纪60年代,人们开始重视昆虫免疫的研究。但目前国内外对昆虫抗菌活性物质的研究主要集中在果蝇、家蚕、蜜蜂、粉纹夜蛾等基础研究上,对东亚飞蝗抗菌肽类物质的提取、功能、体外表达及活性检测的研究鲜见报道。云南地处中国西部地区,对蝗虫物种多样性的研究比较全面、深入,蝗虫资源基本清楚。东亚飞蝗属昆虫纲,直翅目,蝗科昆虫,雌雄异体,成虫后善跳、善飞。主要采食禾本科与莎草科植物,喜食的农作物主要有玉米、谷子等禾本科植物,是我国重要的农业蝗虫[9]。本研究以东亚飞蝗为试验材料,萃取抗菌活性物质和研究抑菌效应,为进一步研究东亚飞蝗新型抗菌肽积累基础试验数据。
昆虫免疫系统具有对外源物质的免疫应答能力,一些外源物质或因素均能诱导昆虫产生抗菌活性物质。昆虫在机体受到损伤时,会产生抗菌肽,平时也会在表皮、口腔、肠道和生殖道等不同部位表达产生一定量抗菌肽,使共生的自然菌落处于稳定状态[10-11],与本试验研究结果一致,即没有针刺蘸大肠杆菌诱导的东亚飞蝗粗提液也能产生抗菌作用,表明东亚飞蝗血淋巴中抗菌活性物质的产生可能受某种基因的调控。本试验结果显示,针刺蝗虫腹部,浸泡在大肠杆菌菌悬液中能显著提高蝗虫粗提液的抑菌效果,其中针刺蝗虫腹部后饲养24 h抑菌活性最强。
昆虫抗菌活性物质对细菌的作用主要是破坏细胞膜,通过具有α-螺旋结构的双亲性蛋白质改变细菌质膜的渗透性发挥作用,不同于青霉素等抗生素是阻断大分子生物合成的抗菌机制,故不易产生耐药性。本试验通过牛津杯法证明,此类萃取物对临床多重耐药的革兰氏阳性菌和革兰氏阴性菌均有一定抑制作用,其中对革兰氏阳性菌的金黄色葡萄球菌抑制效果最好,对其它几种临床多重耐药菌也有一定的抑制作用。研究表明,Moricin(丝蚕抗菌肽)对大肠杆菌JM109、枯草芽孢杆菌、金黄色葡萄球菌等13种细菌均有明显的抑制作用,而且它们的最小致死浓度均低于0.9 μM[12],与本试验结果基本一致。邱晓燕[13]从舍蝇幼虫中提取的抗菌肽可抑制金黄色葡萄球菌生长,但是对大肠杆菌、绿脓杆菌和枯草芽孢杆菌均无抑制作用。而赵立苹[14]初步分离稻蝗抗菌肽对大肠杆菌等革兰氏阴性菌没有抑制效果,其原因可能与蝗虫品种及饲养条件有关。
将蝗虫萃取物置于100 ℃水浴锅及-80 ℃不同温度下,对其活性影响不大,证明其具有一定的耐热耐寒稳定性,具有较大研发和应用潜力。党向利[15]从诱导的家蝇蛹的粗提液中分离纯化出了4种抗菌物质,即3个抗菌肽和1个抗菌化合物。3个抗菌肽分别是分子量为11992.48 Da的IA,家蝇defensin和分子量为7 988.43 Da的IIB。应用RT-PCR技术对4种抗菌肽/蛋白基因在家蝇蛹内表达进行了研究,明确了家蝇蛹体内cecropin、defensin和attacin等抗菌肽的表达是诱导型的,而lysozyme是组成型表达。应用生物信息学方法,证实了家蝇defensin具有典型的昆虫防御素空间构象,即αββ结构。骆雪等[16]研究表明,东亚飞蝗抗菌活性物质可成功诱导LPS刺激猪免疫应激细胞β-defensins-1(pBD-1),pBD-2和pBD-3基因表达上调,结果为改善动物抗病能力提供了有效途径。结合本试验结果,提示东亚飞蝗提取的抗菌活性物质可能治疗某些细菌性疾病,而且不易产生耐药性,这是抗生素替代品未来研究发展的一个重要方向。在本试验基础上,进一步研究东亚飞蝗抗菌活性物质的抗菌谱与最小抑菌浓度,研究东亚飞蝗抗菌肽的抗病作用机理,可成功诱导机体抗病基因的表达,改善机体免疫性能和提高抗病能力。
4 结 论
针刺诱导东亚飞蝗成虫和饲养不同时间后提取液的抑菌活性具有明显差别,东亚飞蝗成虫提取液对革兰氏阳性菌或革兰氏阴性菌均有抑制作用,其抗菌谱为:金黄色葡萄球>水稻白叶枯病原菌>枯草芽孢杆菌>大肠杆菌,其中以针刺诱导饲养24 h后的抑菌效果最明显,东亚飞蝗抗菌活性物质粗提液经纯化后增强抑菌效果。结果提示:东亚飞蝗体内含有抗菌活性物质,具有可诱导性,但其抗菌作用机理有待进一步研究。
参考文献:
[1] Boman H G, Nilsson-Faye I, Paul K, et al. Insect immunity. I. Characteristics of an inducible cell-free antibacterial reaction in hemolymph of Samia Cynthia pupae[J]. Infection and Immunity, 1974, 10:136-145.
[2] Otvos L, Philippe Bulet , Reto Stocklin. Insect Antimicrobial Peptides: Structures, Properties and Gene Regulation[J]. Protein and Peptide Letters, 2005, 12:3-11.
[3] 王义鹏,赖 仞.昆虫抗菌肽结构、性质和基因调控[J].动物学研究, 2010,31(1):27-34.
[4] 张干伟,孙素玲,汤 坚,等.东亚飞蝗营养成分分析[J].营养学报,2011,33(1):90-91.
[5] 赵 莉.东亚飞蝗体内主要营养成分的生物化学分析[D].天津:天津师范大学,2008:4-36.
[6] 陆 健. 蛋白质纯化技术及应用[M].北京:化学工业出版社,2005.
[7] 俞建瑛,蒋 宇,王善利. 生物化学实验技术[J]. 北京:化学工业出版社,2005.
[8] 邹 锋.家蝇抗菌肽生产及制剂研究[D].湖南 长沙:湖南农业大学,2007.
[9] 王顺良,李虎群,张小龙,等.东亚飞蝗生物防治技术研究[J]. 农药科学与管理,2011,32(2):51-53.
[10] Yu Y, Park J W,Kwon H M,et al.Diversity of Innate Immune Recognition Mechanism for Bacterial Polymeric meso-Diaminopimelic Acid-type Peptidoglycan in Insects[J]. J Biol Chem Oct,2010,285:32 937-32 945.
[11] Igboin C O,Tordoff K P,Moeschberger M L, et al. Porphyromonas gingivalis-Host Interactions in a Drosophila melanogaster Model[J].Infection and Immunity, 2011,79(1):449-458.
[12] Hara S, Yamakawa M. Moricin, a novel type of antibacterial peptide isolated from the silkworm, Bombyx mori[J]. Biol Chem,1995,270(50):29 923-29 927.
[13] 邱晓燕. 舍蝇幼虫抗菌肽的提取及其生物活性的初步研究[D].福建 厦门:厦门大学,2001.
[14] 赵立苹. 稻蝗抗菌肽的初步分离及pUC118 DNA与小檗碱作用的荧光特征[D].山西 太原:山西大学,2005.
[15] 党向利.家蝇蛹天然抗菌肽的制备及其分离纯化研究[D].广东 广州:中山大学,2008.
[16] 骆 雪,云南特有猪种β-defensin基因表达特点及外源活性物质的调节作用[D].云南 昆明:云南农业大学, 2012.

