绿僵菌胞外蛋白酶Pr1C诱导飞蝗中肠免疫功能分析
郭隆隆 李贝贝 李霜
摘要 为明确金龟子绿僵菌Metarhizium anisopliae胞外蛋白酶Pr1C在绿僵菌侵染飞蝗Locusta migratoria中肠中的作用,从绿僵菌IMI330189菌株转录组中获得并分析了Pr1C基因全长序列,设计引物对该基因进行了克隆和原核表达。将表达的Pr1C蛋白与绿僵菌IMI330189混合后饲喂处理,测定了混合物对飞蝗的毒力,并通过荧光定量PCR检测了飞蝗中肠免疫相关基因的表达情况。结果显示,该基因属于绿僵菌类枯草杆菌丝氨酸蛋白酶家族,全长为2 126 bp,蛋白大小为71 kDa。Pr1C與绿僵菌IMI330189混合后可以显著提高对飞蝗的毒力。荧光定量结果表明,Defensin, Persephone, Tube, Relish, Dredd 5个基因在各处理中表达量均呈现升高趋势,其中Pr1C蛋白和绿僵菌混合处理的变化比其他处理组变化快,于第2天达到较高水平;绿僵菌处理变化较慢,于第6天达到最高水平。本研究表明,绿僵菌胞外蛋白酶Pr1C可显著提高绿僵菌毒力,促进绿僵菌侵染速率,为进一步研制和应用生物制剂防治飞蝗提供理论依据。
关键词 绿僵菌; 胞外蛋白酶; 飞蝗; 毒力
中图分类号: S 476.12 文献标识码: A DOI: 10.16688/j.zwbh.2019075
Abstract In order to explore the role of Metarhizium anisopliae in the midgut infection of Locusta migratoria, the full-length sequence of Pr1C gene was obtained from the transcriptome sequences of M. anisopliae strain IMI330189 and primers were designed to clone and express the Pr1C gene. The obtained Pr1C protein was mixed with M. anisopliae IMI330189 spore and its toxicity to the locust was checked by using bait-feeding method. The expression level of intestinal immune-related genes in locusts was detected by fluorescence quantitative PCR. NCBI Blast results showed that Pr1C gene belonged to the serine protease family of M. anisopliae with a full length of 2 126 bp, and its protein size was 71 kDa. The bioassay results showed that the mixture of Pr1C and M. anisopliae IMI330189 could significantly increase the virulence to L. migratoria. The expression level of five genes Defensin, Persephone, Tube, Relish and Dredd showed an increasing trend in all treatments, but the treatment with the mixture of Pr1C protein and metarhizium induced a faster change than other treatments and reached to the highest level on the second day. The treatment with M. anisopliae induced slow change in the expression of genes, and the highest level was observed on the sixth day. This study indicated that the extracellular protease Pr1C of M. anisopliae could significantly increase the virulence of M. anisopliae and its infection rate, providing a theoretical basis for the further development and application of biological preparations for controlling L. migratoria.
Key words Metarhizium anisopliae; extracellular protease; Locusta migratoria; virulence
金龟子绿僵菌 Metarhizium anisopliae作为一种广泛存在的昆虫病原真菌能够寄生于多种害虫,它主要通过穿透昆虫体表进入寄主体内,消耗营养,产生毒素等方式致死害虫[1]。Kucera在昆虫体壁离体诱导培养条件下首次发现了绿僵菌胞外蛋白酶的活性,并指出菌株的蛋白酶活力与其毒力存在关系[2]。樊美珍等利用该方法,以马尾松毛虫作为试虫,测定了球孢白僵菌胞外蛋白酶的产量与毒力的关系,进一步证实二者之间存在相关性[3]。St Leger等研究发现,胞外蛋白酶Pr1作为一组碱性同工酶[4],能够作用于昆虫表皮中的天冬氨酸和谷氨酸的羧基,降解蛋白质[5],在绿僵菌对昆虫致病力方面发挥着重要的作用[6]。St Leger等通过构建超表达Pr1A基因的菌株,发现其对昆虫的致病力显著高于野生型菌株[7]; Pr1A和Pr1B基因缺失的自发突变体菌株毒力明显降低[8]。证明Pr1是绿僵菌中重要的毒力因子。
Quesada等研究发现绿僵菌胞外蛋白抽提物经口饲喂后会引起海灰翅夜蛾Spodoptera littoralis死亡及中肠结构破坏[9]。本实验室前期研究也发现,绿僵菌饵剂处理飞蝗,可导致飞蝗中肠微绒毛变形肿胀、断裂脱落逐渐稀疏[10]。而饲喂含有绿僵菌和胰凝乳蛋白酶抑制剂(TPCK,Pr1的抑制剂)的飞蝗中肠微绒毛结构完整,未发生脱落变形等现象[11]。通过测定金龟子绿僵菌IMI330189的转录组发现在该菌株中存在包括Pr1C在内的多个Pr1基因。为明确Pr1C基因的功能,本研究以金龟子绿僵菌IMI330189為试验材料,从中分离、克隆了胞外蛋白酶Pr1C基因,测定了Pr1C对绿僵菌的增效作用及其对蝗虫免疫相关基因表达的影响, 为进一步明确其在绿僵菌破坏寄主中肠中的作用奠定了基础。
1 材料与方法
1.1 供试菌株
金龟子绿僵菌IMI330189保存于中国农业科学院植物保护研究所。在 28℃条件下,用 PDAY 培养基培养15 d,刮下分生孢子干燥后于4℃保存。使用前测定孢子含量及萌发率[12],计算活孢子含量。
1.2 供试虫源
试验所用飞蝗 Locusta migratoria种群为本实验室饲养纯化种群。飞蝗卵在人工气候培养箱中孵化,孵化条件为:温度(30±2)℃,湿度60%,L∥D=16 h∥8 h。将同一时间孵化、大小一致的蝗蝻转移到养虫笼(60 cm×50 cm×60 cm)中用新鲜麦苗饲养。饲养条件:L∥D=16 h∥8 h,温度(30±2)℃,相对湿度60%。
1.3 培养基
LB液体培养基:酵母粉5 g,胰蛋白胨10 g,氯化钠10 g,补水定容至1 000 mL,121℃高压灭菌15 min。
PDAY 固体培养基:马铃薯(去皮煮汁)200 g,琼脂 20 g,蔗糖 20 g,酵母粉 5 g,补水定容至1 000 mL,121℃高压灭菌 25 min。
萌发培养基:蔗糖 2 g,琼脂粉 1.8 g,补水定容至 100 mL, 121℃高压灭菌 15 min。
菌丝生长培养基:硫酸镁 2 g,酵母粉 10 g,蔗糖 20 g,磷酸氢二钾 5 g,补水定容至1 000 mL, 121℃高压灭菌 15 min。
1.4 主要试剂及仪器
试剂主要包括TransZol Up Plus RNA Kit(全式金),PrimeScriptTM II 1st Strand cDNA Synthesis Kit(TaKaRa),DL2000 DNA marker(TaKaRa),RNA spin column(全式金),ProteinIso His-Tag Resin(全式金),Trans1-T1 Phage Resistant Chemically Competent Cell(全式金),无核酸酶水(Ambion),胶回收试剂盒(Axygen),质粒提取试剂盒(Axygen),Ex Taq DNA聚合酶(TaKaRa),氯仿、无水乙醇、异丙醇、丙三醇(国产分析纯)等。本文所用引物均由上海生工生物工程股份有限公司合成。
仪器主要包括智能人工气候箱(宁波赛福),超净工作台(上海博迅),东胜龙ETC-811PCR仪,德国Sigma3K15冷冻离心机,THZ-D台式恒温振荡器(华美生化仪器厂),HPX-9052MBE数显电热培养箱(上海博迅),ABI Fast 7500荧光定量PCR仪等。
1.5 Pr1C基因克隆与表达
利用菌丝生长培养基培养绿僵菌,使用TransZol Up Plus RNA Kit(全式金)从绿僵菌菌丝中提取样品总RNA,PrimeScriptTM II 1st Strand cDNA Synthesis Kit反转录样品cDNA。通过上、下游引物F1: 5′-ATTTAATGTGCAAAGCCGGTG-3′和R1: 5′-CAGATGCTCAGGACGAGAAAGT-3′对Pr1C基因进行PCR扩增。扩增条件为95℃ 3 min;95℃ 30 s,58℃ 30 s,72℃ 1 min 30 s,36个循环;72℃ 10 min;4℃保存。扩增后的目的产物进行回收,与pMD-19-T Easy载体连接。然后,通过热激法将连接产物转入Trans1-T1 Phage Resistant Chemically Competent Cell感受态细胞,利用氨苄抗性筛选阳性菌株。阳性克隆经PCR检验正确后,由上海生工生物(北京)公司测序。
从测序确认无误的转化子中提取质粒,并以此为模板,通过含有Nde I和Sal I酶切位点的引物F2: 5′-GGAATTCCATATGGACTGCAACGGTCAC-3′(Nde I)和R2: 5′-ACGCGTCGACATTGTGTCCCCTTTCGACTC-3′(Sal I)进行PCR,扩增Pr1C全长基因片段,PCR扩增条件为:95℃ 3 min;95℃ 30 s,60℃ 30 s,72℃ 1 min 30 s,36个循环;72℃ 10 min;4℃保存。将PCR产物纯化回收后进行双酶切(Nde I/Sal I),酶切、回收后的片段与pET-21b载体进行连接,连接产物转化大肠杆菌BL21(DE3)菌株,利用氨苄抗性筛选阳性克隆。从筛选出的阳性克隆中提取质粒,进行双酶切、PCR鉴定。将验证正确的单克隆进行诱导表达,检测目的蛋白Pr1C的表达情况。
挑取含有pET-21b-Pr1C质粒的大肠杆菌单菌落,37℃、220 r/min、活化培养12 h后,吸取4 mL加入含有200 mL LB培养基的三角瓶中,相同条件下培养2 h;然后加入IPTG,终浓度为0.5 mmol/L,20℃、150 r/min诱导培养8 h。7 000 r/min离心,收集菌体。加入20 mmol/L Tris-HCl(pH 8.0)缓冲液悬浮菌体。在400 W,工作5 s,间隔5 s超声破碎菌体细胞15 min,获得所需目的蛋白产物。
目的蛋白含量测定采用 Bradford考马斯亮蓝方法,以牛血清白蛋白为标准蛋白,用酶标仪在 595 nm 处读取 OD值,计算样品蛋白含量。
1.6 对飞蝗的毒力测定
1.6.1 试验处理
试验共设3个处理,分别为:1)浓度为1.8 mg/mL的Pr1C蛋白;2)孢子含量2.5×108 个/g的绿僵菌IMI330189;3)浓度为1.8 mg/mL的Pr1C蛋白+孢子含量2.5×108 个/g的金龟子绿僵菌IMI330189。以大肠杆菌BL21(DE3)(含有pET-21b空載体)诱导表达的菌体作为空白对照。所有处理和对照都设5次重复。
1.6.2 饵剂的配制
称取适量麦麸,加入5%(V/m)植物油,混匀。根据不同处理每克麦麸中绿僵菌孢子粉和Pr1C蛋白的含量、绿僵菌孢子粉中孢子含量及萌发率、Pr1C蛋白溶液的浓度,计算不同处理中所需加入绿僵菌孢子粉和Pr1C蛋白的量,进行称量,分别加入含有植物油的麦麸中,混匀。4℃保存备用。
1.6.3 生物测定
将预先饥饿 12 h 的飞蝗3龄若虫放入无菌的塑料筐中(长×宽×高=30 cm×12 cm×9 cm),每筐 30 头,用已消毒的玻璃板盖好。将混合好的饵剂按每30头(1筐)4 g的量盛放在灭菌的培养皿中,然后放入有蝗虫的塑料筐中,每个处理重复5 次。蝗虫取食 24 h 后,将饵剂取出,换成新鲜麦苗。每天记录蝗虫死亡数和存活数,连续记录10 d,计算每天死亡率和存活率,并绘制存活率折线图。
1.7 基因荧光定量检测
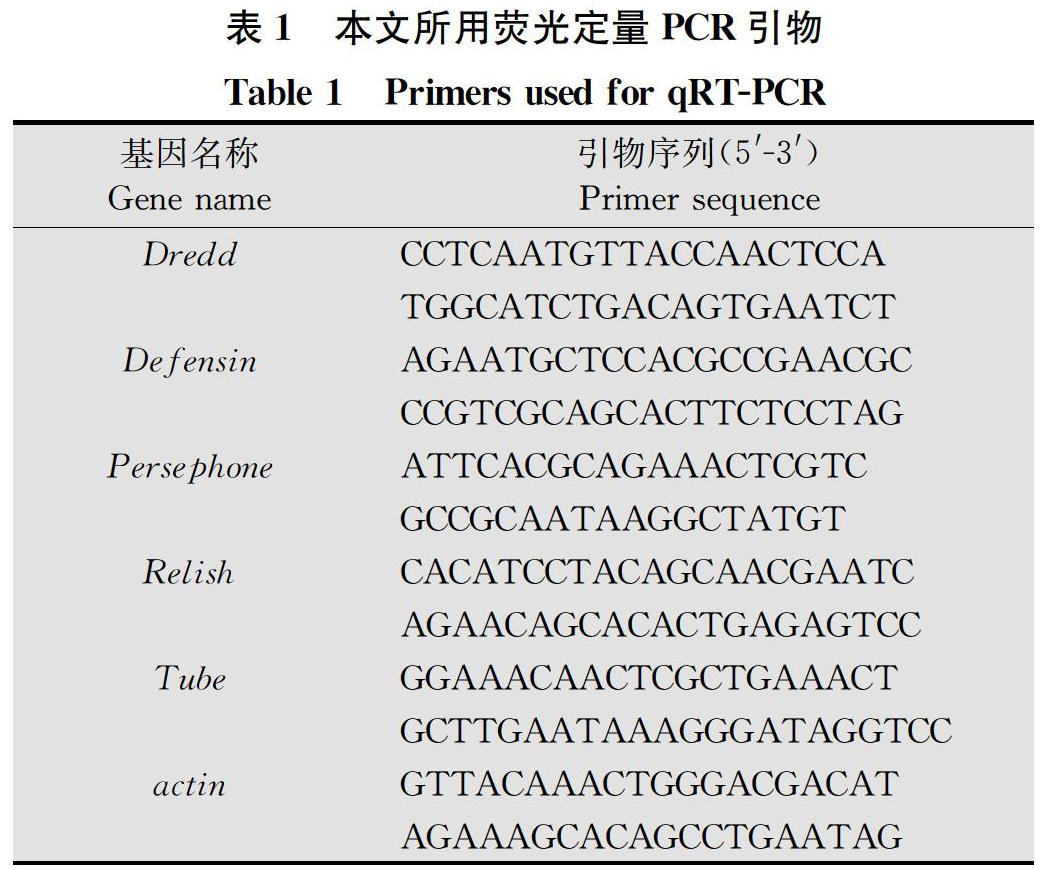
按照1.6.1相同的处理和重复进行设计,对照组及处理组取食饵剂 24 h 换成麦苗后开始第 1 次取样,然后每间隔1 d取样,共取4次。每个重复中取活虫1头,每个处理共取活虫 5头,切取中肠, 0.75%的生理盐水清洗,中肠样品液氮速冻后放于-80℃冰箱保存。用TransZol Up Plus RNA Kit(全式金)提取中肠总RNA样品,PrimeScriptTM II 1st Strand cDNA Synthesis Kit反转录获得cDNA,设计荧光定量PCR引物(表1),对飞蝗免疫途径相关基因Dredd、Defensin、 Persephone、 Relish、 Tube表达量进行检测,内参选用β-actin。反应程序为:95℃预变性2 min;95℃ 15 s,58℃ 15 s,68℃ 30 s,40个循环。2-ΔΔCT法分析不同处理后飞蝗免疫基因表达量变化。
1.8 数据统计与分析
蝗虫存活率计算方法如下:存活率=存活数/总数×100%,存活率统计结果采用SPSS 20.0软件进行单因素方差分析,分析结果采用GraphPad Prism 6软件进行图表制作。2 结果与分析
2.1 绿僵菌胞外蛋白酶Pr1C基因序列分析
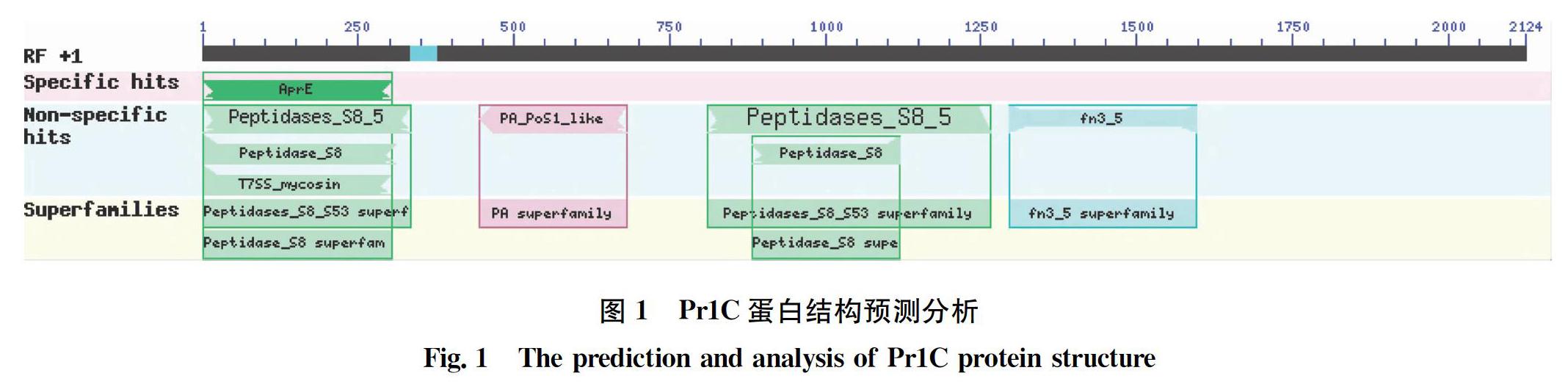
对胞外蛋白酶Pr1C序列分析结果显示,该基因序列全长2 124 bp,编码含有707个氨基酸的蛋白序列,该基因与类枯草杆菌蛋白酶具有很高的同源性,达到97%,序列中含有肽酶S8家族结构域(Peptidases_S8_5)酶家族(丝氨酸蛋白酶家族)结构域(Peptidases_S8), Ⅶ型分泌型丝氨酸蛋白酶肌球蛋白 (type Ⅶ secretion-associated serine protease mycosin),Fn3类结构域(fn3_5),类PoS1蛋白酶相关结构域等保守结构域(图1)。
2.2 绿僵菌胞外蛋白酶Pr1C原核表达载体构建及转化
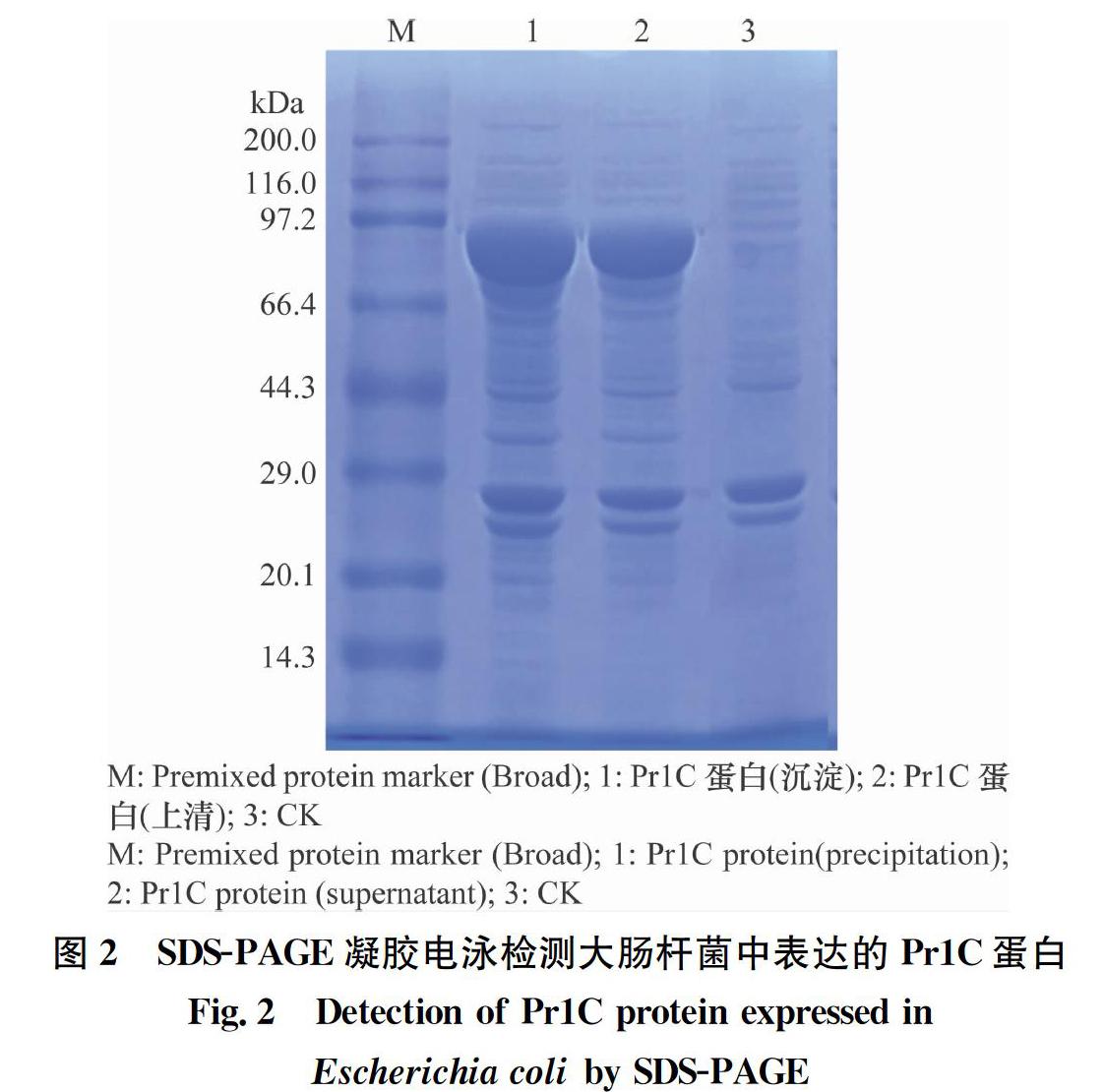
通过PCR从绿僵菌cDNA中扩增获得了2 124 bp的Pr1C基因片段,将其连接到pMD-19-T Easy载体,获得了4 816 bp的重组质粒pMD-19-T-Pr1C。以其为模板,采用引物F2、R2进行PCR扩增,获得了含有Nde I和Sal I双酶切位点的Pr1C基因片段,经Nde I和Sal I双酶切后插入到pET-21b载体相应的酶切位点间,获得7 567 bp的重组表达质粒pET-21b-Pr1C(图2),然后将质粒转化到大肠杆菌BL21(DE3)中。经氨苄抗性筛选,获得了含有重组质粒pET-21b-Pr1C的转化子。从转化子中提取质粒进行PCR和酶切验证,证明插入的目的片段正确。用IPTG对目的基因片段进行诱导表达,结果该转化子可以表达出71 kDa的Pr1C蛋白(图2)。
2.3 绿僵菌IMI330189与Pr1C处理后飞蝗存活率检测 结果显示,随着时间的延长,飞蝗的存活率整体呈现逐渐降低的趋势。在对照中,飞蝗的存活率一直维持在较高的水平,从第1天到第10天,存活率只降低了10.0%(存活率为90.7%)。在绿僵菌处理中,由于绿僵菌的侵染导致飞蝗不断死亡,飞蝗的存活率逐渐降低,到第10天,降低到60.7%。Pr1C处理与绿僵菌处理结果类似,到第10天,飞蝗的存活率降低到63.3%,二者之间没有显著差异(P>0.05),但与对照组相比,差异显著 (P<0.001)。将绿僵菌与Pr1C混合后,飞蝗的存活率迅速下降,到第10天降低到只有30.0%,与其他处理间存在显著差异。
2.4 飞蝗中肠免疫途径下游相关基因检测
荧光定量检测结果(图4)显示,飞蝗取食饵剂后,中肠内5个免疫相关基因表达量水平总体呈升高趋势。绿僵菌处理中,免疫基因在处理后第2天呈现出微弱上升,第4天表达量增长较多,到第6天时表达量达到最高;Pr1C蛋白处理组中免疫基因在处理后第2~4天表达量与绿僵菌处理组基本一致,第4~6天5个基因表达量与第2~4天相比呈现出稳定的增长趋势,但显著低于其他处理(P<0.01);绿僵菌和Pr1C蛋白混合处理后,免疫基因在第2天即呈现出较高的表达量,第2~4天增长最快,第4天5个基因表达量与其他处理组相比存在极显著差异(P<0.001),然而到第6天时5个基因表达量明显低于绿僵菌单独处理,可见绿僵菌和Pr1C蛋白混合处理短时间内能够显著增加绿僵菌毒力,促进绿僵菌入侵寄主,并能引起寄主强烈的免疫反应。
3 讨论
昆虫的消化道作为其主要的营养消化和吸收场所,在昆虫的生长发育中起着重要的作用,中肠作为分泌消化酶、消化食物和吸收养分的主要部位[13],一直以来都受到人们的广泛关注。本文通过体外表达绿僵菌胞外蛋白酶Pr1C,并采用人工饲料饲喂的方式对飞蝗进行处理,结果发现绿僵菌胞外蛋白酶Pr1C和绿僵菌混合作用的处理中,飞蝗死亡率明显高于单独处理。并且,绿僵菌胞外蛋白酶单独作用的处理中死亡率达到了36.7%。曹伟平等采用饲喂方式处理棉铃虫幼虫的试验发现,球孢白僵菌经消化道侵染后可导致寄主中肠微绒毛脱落严重,肠壁组织溶解,表皮下细胞被菌丝侵染等现象[14]。王正浩通过饲喂飞蝗蛋白酶抑制剂的试验发现,食用绿僵菌的飞蝗中肠微绒毛结构遭到破坏,加入TPCK后的飞蝗中肠微绒毛结构未发生明显的破坏[11]。根据这一结果推测飞蝗食用含有绿僵菌胞外蛋白酶Pr1C人工饲料后,之所以能够导致飞蝗较高的死亡率,可能的原因是,取食含有胞外蛋白酶的人工饲料后,导致飞蝗中肠微绒毛结构脱落,表皮结构遭到破坏,影响飞蝗正常的取食作用,并影响飞蝗营养吸收,最终使得飞蝗死亡率升高。由此我们也可以得出结论,飞蝗在取食了含有绿僵菌和胞外蛋白酶Pr1C的人工饲料后的2~3 d内,胞外蛋白酶破坏中肠微绒毛结构,并导致中肠表皮结构破坏,破坏后的中肠表面有利于绿僵菌分生孢子的附着,且分生孢子更容易吸收虫体营养物质,从而促进了绿僵菌的侵染,这使得绿僵菌和胞外蛋白酶混合使用的处理组死亡率明显高于其他处理。
Toll和免疫缺陷途径(IMD,immune deficiency pathways)作为主要的免疫途径,在蝗虫免疫中起重要作用[15-17]。绿僵菌在侵染过程中释放毒力因子,与寄主Persephone蛋白结合,激活Toll途径中SPE转变为Sptzle,有活性的Sptzle与Toll受体胞外域结合从而促进Toll途径的激活,使下游髓样分化因子(myeloid differentiation factor88,MyD88)参与免疫反应促进Tube、Pelle基因的表达,并最终导致核转录因子κB(NF-κB)相关的转录调控因子Dif的磷酸化反应,促进抗菌肽的表达进而抵抗病原菌的入侵[18]。IMD途径作为与Toll途径协同作用的免疫反应,在病原真菌入侵过程中由寄主防御过程中大量的活性氧簇(ROS)的释放而激活该免疫反应,IMD途径的激活引发下游死亡相关结构域蛋白(Fadd)和死亡相关的类ced-3/Nedd2细胞凋亡蛋白酶(Dredd)基因表达,该基因的表达促进核转录因子κB(NF-κB)和转录因子Relish基因表达[19],Relish的大量表达促进抗菌肽的产生抵抗病原菌的入侵[20-21]。防御素(defensin)是一种富含半胱氨酸的肽类物质,拥有抵抗革兰氏阳性菌和参与昆虫抗菌防御反应的作用[22],在昆虫免疫反应中同样也起到至关重要的作用。在对飞蝗饲喂了含有Pr1C和绿僵菌的饵剂后,对飞蝗中肠免疫基因的表达量变化进行检测后发现,在IMD途径中Dredd、Relish两个基因表达量均上调,Toll途径中Tube、Pelle两个基因表达量上调,由此可见在绿僵菌入侵中肠过程中Toll途径和IMD途径均参与蝗虫中肠的免疫反应,使得下游免疫基因表达量升高,从而促进抗菌肽的产生引发蝗虫中肠免疫反应。
本研究表达了绿僵菌胞外蛋白酶Pr1C,通过人工饲料饲喂的方式对该蛋白酶作用进行了生物学检测,并对飞蝗存活率和免疫基因进行了转录水平的检测,后期还需要深入研究该蛋白在飞蝗免疫中的作用机制。根据本试验研究结果可以发现,绿僵菌胞外蛋白酶在对绿僵菌侵染飞蝗的过程中发挥着有效的促进作用,因此值得进一步开展作用机理及开发利用研究。
参考文献
[1] 王海川, 尤民生. 绿僵菌对昆虫的入侵机理[J]. 微生物学通报, 1999, 26(1):71-73.
[2] KU CˇERA M. Proteases from the fungus Metarhizium anisopliae toxic for Galleria mellonella larvae [J]. Journal of Invertebrate Pathology, 1980, 35(3):304-310.
[3] 樊美珍, 胡锦江, 李农昌, 等. 球孢白僵菌胞外蛋白酶及其与毒力关系的研究[J]. 微生物学通报, 1994, 21(4):202-206.
[4] ST LEGER R J, BIDOCHKA M J, ROBERTS D W. Isoforms of the cuticle-degrading pr1 proteinase and production of a metalloproteinase by Metarhizium anisopliae [J]. Archives of Biochemistry & Biophysics, 1994, 313(1):1-7.
[5] ST LEGER R J, HAJEK A E, STAPLES R C, et al. Fungi for the biocontrol of insects: tools and trends [C]∥Molecular Biology of Filamentous Fungi: Embro-workshop, 1992.
[6] 劉颖, 殷从松. 金龟子绿僵菌致病的分子机理研究进展[J]. 贵州农业科学, 2010, 38(10):96-100.
[7] ST LEGER R, JOSHI L, BIDOCHKA M J, et al. Construction of an improved mycoinsecticide overexpressing a toxic protease [J]. Proceedings of the National Academy of Sciences, 1996, 93(13):6349-6354.
[8] WANG Chengshu, TYPAS M A, BUTT T M. Detection and characterisation of pr1 virulent gene deficiencies in the insect pathogenic fungus Metarhizium anisopliae [J]. FEMS Microbiology Letters, 2002, 213(2):251-255.
[9] QUESADA E M, CARRASCO-DAZ J A, SANTIAGO-LVAREZ C. Insecticidal and antifeedant activities of proteins secreted by entomopathogenic fungi against Spodoptera littoralis (Lep. Noctuidae)[J]. Journal of Applied Entomology, 2006, 130(8):11.
[10] 王达,袁芳芳,黄大庄,等.绿僵菌侵染光肩星天牛幼虫过程的透射电镜观察[J].林业科学,2010,46(5):113-115.
[11] 王正浩.绿僵菌胞外蛋白酶对东亚飞蝗中肠毒力差异分析[D].兰州:甘肃农业大学,2016.
[12] 娄延霞.绿僵菌经口饲喂侵染东亚飞蝗的组织病理学研究[D].北京:中国农业科学院,2013.
[13] 王晓容.昆虫中肠生理与病理研究进展[J].仲恺农业工程学院学报,2000,13(1):58-68.
[14] 曹伟平,王刚,甄伟,等.球孢白僵菌不同感染方式侵染棉铃虫幼虫的毒性比较及组织病理变化[J].昆虫学报,2011,54(4):409-415.
[15] BUCHON N, SILVERMAN N, CHERRY S. Immunity in Drosophila melanogaster from microbial recognition to whole-organism physiology [J]. Nature Reviews Immunology, 2014, 14(12):796-810.
[16] 王英, 黄复生. 昆虫天然免疫的研究进展[J]. 免疫学杂志, 2008, 24(4):473-478.
[17] 刘甜, 罗开珺. 果蝇Toll和IMD信号通路中的功能结构域[J]. 环境昆虫学报, 2011, 33(3):388-395.
[18] YANG Lishi, YIN Zixin, LIAO Jixiang, et al. A Toll receptor in shrimp [J].Molecular Immunology,2007,44(8):1999-2008.
[19] HETRU C, HOFFMANN J A.NF-κB in the immune response of Drosophila [J]. Cold Spring Harbor Perspectives in Biology, 2009, 1(6):a000232.
[20] LAN Jiangfeng, ZHOU Jing, ZHANG Xiaowen, et al. Characterization of an immune deficiency homolog (IMD) in shrimp (Fenneropenaeus chinensis) and crayfish (Procambarus clarkii)[J]. Developmental & Comparative Immunology, 2013, 41(4):608-617.
[21] LI Fuhua, XIANG Jianhai. Recent advances in researches on the innate immunity of shrimp in China [J]. Developmental and Comparative Immunology, 2012, 39(1/2):11-26.
[22] COCIANCICH S, GHAZI A, HETRU C, et al. Insect defensin, an inducible antibacterial peptide, forms voltage-dependent channels in Micrococcus luteus [J]. Journal of Biological Chemistry, 1993, 268(26):19239-19245.
(責任编辑: 田 喆)

