左卡尼汀通过抑制钙/钙调素依赖蛋白激酶Ⅱ信号通路抑制过氧化氢诱导的大鼠心肌细胞凋亡*
戴红良, 贾桂枝, 刘 堃, 梁春光, 张 林, 张志刚, 王洪新
(辽宁医学院1护理学院,2生物化学与分子生物学教研室,4药理学教研室,辽宁锦州121001;3聊城市人民医院药学部,山东聊城252600)
氧化应激在缺血再灌注损伤、高血压、糖尿病等疾病所致心肌损害中具有重要作用。异常的氧化应激水平可诱发炎症反应,引起细胞凋亡增加,最终引起心肌重构及充血性心力衰竭[1-2]。鉴于此,阻止氧化应激和对抗细胞凋亡为临床治疗各种心血管疾病提供了重要思路。左卡尼汀又称左旋肉碱,其基本功能是将长链脂肪酸转运至线粒体机制,促进其氧化分解,是哺乳动物体内参与能量代谢的重要物质[3]。除此之外,左卡尼汀还具有显著的抗氧化及抗凋亡活性[4]。我们最近的研究也发现左卡尼汀能够显著抑制由过氧化氢(hydrogen peroxide,H2O2)刺激引起的体外心肌细胞凋亡[5],然而对于其确切机制却知之甚少。本研究拟在我们前期研究的基础上,进一步探讨左卡尼汀的抗凋亡作用机制。
材料和方法
1 材料
1.1 药物与试剂 胎牛血清购自杭州四季青生物工程材料研究所;胰蛋白酶、DMEM低糖培养基、二甲基亚砜、MTT、左卡尼汀、1,2-双(2-氨基苯氧基)乙烷-N,N,N',N'-四乙酸[1,2-bis(2-aminophenoxy)ethane-N,N,N',N'-tetraacetic acid,BAPTA]及KN93均购于Sigma;annexin V-FITC细胞凋亡检测试剂盒购自北京宝赛生物技术有限公司;Fluo-3/AM购自江苏碧云天;牛血清白蛋白(bovine serum albumin,BSA)蛋白定量试剂盒购自Pierce;cleaved caspase-3 I抗购于Cell Signaling;钙调素依赖蛋白激酶II(calmodulin-dependent protein kinase II,CaMKII)I 抗购自Santa Cruz;磷酸化 CaMKⅡ (phospho-CaMKⅡ,p-CaMKⅡ)购自 Promega;甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)I抗购于Sigma;辣根过氧化物酶(horseradish peroxide,HRP)标记的II抗购于Santa Cruz。
1.2 动物 出生1~3 d Sprague-Dawley(SD)大鼠乳鼠,雌雄不拘,由辽宁医学院实验动物中心提供。动物合格证号为SCXK(辽)2003-0007。
2 方法
2.1 心肌细胞培养 新生大鼠心肌细胞原代培养方法,参照文献[5]。取出生1~3 d SD大鼠乳鼠,开胸取出心脏,用D-Hanks液冲洗3次后剪成约1 mm×1 mm×1 mm大小的碎块,在37℃条件下,以0.8 g/L胰蛋白酶消化分离细胞。将消化完毕的细胞以差速贴壁法进行纯化后,置于含15%胎牛血清的DMEM培养液中,置于37℃、5%CO2培养箱中培养。待细胞融合后,换以含0.04%胎牛血清的DMEM,继续培养24 h后,将细胞分组用于实验。
2.2 实验分组 将体外培养的SD大鼠心肌细胞随机分为正常对照组、H2O2处理组、左卡尼汀(1.2 mmol/L)+H2O2组、BAPTA(细胞内钙离子络合剂,20μmol/L)+H2O2组和KN93(CaMKII特异性抑制剂,0.2 μmol/L)+H2O2组。H2O2浓度为200 μmol/L,作用时间为12 h。左卡尼汀于加入H2O21 h前加入,BAPTA及KN93于加入H2O230 min前加入。左卡尼汀、BAPTA及KN93均维持至H2O2处理结束。
2.3 心肌细胞活力检测 采用MTT法测定心肌细胞活力。将接种于96孔培养板,处理完毕后的心肌细胞用于实验。在测试前4 h,每孔加入0.5 g/L MTT,于CO2培养箱中继续培养4 h后弃去培养液,每孔加入二甲基亚砜100μL,振荡10 min,使结晶物充分溶解。选择570 nm波长,在酶标仪上测定各孔吸光度(A),该值间接反映细胞活力的高低。
2.4 心肌细胞凋亡测定 采用流式细胞术进行检测,将经过处理的心肌细胞用1.25 g/L胰蛋白酶消化分离,调节细胞密度为1×109/L后,按照annexin V-FITC凋亡检测试剂盒说明书进行操作。
2.5 心肌细胞内静息钙浓度([Ca2+]i)测定 细胞用D-Hanks液洗3次,用5μmol/L Fluo-3/AM 37℃避光孵育45 min,然后吸出染液,再以D-Hanks液洗涤3次,每孔加入0.5 mL D-Hanks液。将激光共聚焦显微镜专用培养皿置于LSCM 570载物台上,激发波长488 nm,发射波长525 nm,记录细胞内荧光强度并由计算机软件进行处理。以细胞内荧光强度间接反映细胞内静息钙离子水平。指定对照组荧光强度为1,以其它组与对照组的比值反映各组的相对荧光强度。
2.6 Cleaved caspase-3和 p-CaMKII表达 收集细胞,加细胞裂解液 RIPA[1%乙基苯基聚乙二醇(nonidet P-40,NP-40),0.5% 脱氧胆酸钠,1% 十二烷基硫酸钠(sodium dodecyl sulfate,SDS),0.1% 苯甲基磺酰氟(phenylmethanesulfonyl fluoride,PMSF)]提取细胞总蛋白,二喹啉甲酸(bicinchoninic acid,BCA)法测定蛋白浓度。取50μg总蛋白,以1×样品缓冲液配平上样体积,沸水煮5 min后置10%SDSPAGE中进行电泳,待电泳完成后电转移至聚偏氟乙烯(polyvinylidene fluoride,PVDF)膜。用5%脱脂牛奶封闭1 h,接着加 cleaved caspase-3、p-CaMKII、CaMKII及GAPDHⅠ抗4℃孵育过夜。TBS-T充分洗膜后,以HRP标记的Ⅱ抗室温孵育2 h。TBS-T洗膜后,增强化学发光法(enhanced chemiluminescence,ECL)显色。用ImageJ 1.42软件对扫描的条带进行灰度分析。指定对照组蛋白表达为1,以其它组与对照组的比值反映各组的相对蛋白表达。
3 统计学处理
采用SPSS 13.0统计软件分析。数据以均数±标准差(mean±SD)表示。组间比较采用单因素方差分析。以P<0.05为差异有统计学意义。
结 果
1 左卡尼汀、BAPTA及KN93对大鼠心肌细胞活力的影响
与正常组比较,H2O2组大鼠心肌细胞活力显著降低。而与模型组比较,左卡尼汀、BAPTA及KN93预处理组心肌细胞活力则显著增加,见图1。
2 左卡尼汀、BAPTA及KN93对大鼠心肌细胞凋亡的影响
流式细胞术结果显示,H2O2处理12 h后大鼠心肌细胞凋亡显著增加。与H2O2组相比左卡尼汀、BAPTA及KN93预处理组心肌细胞凋亡率均显著降低;利用Western blotting检测cleaved caspase-3(代表凋亡执行蛋白caspase-3的活性)的表达,也得到了类似的结果,见图2、3。

Figure 1.Effects of L-carnitine,BAPTA and KN93 on decreased cell viability induced by H2O2 in rat cardiomyocyte.Mean±SD.n=6.*P <0.05 vs control;#P <0.05 vs H2 O2 alone.图1 左卡尼汀、BAPTA及KN93对H 2 O 2诱导的大鼠心肌细胞活力降低的影响
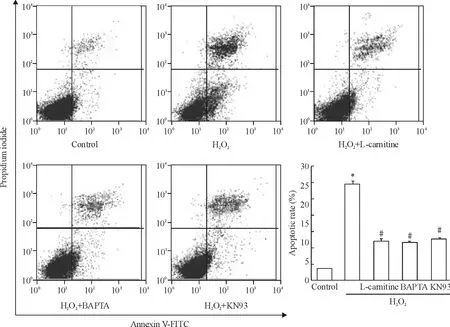
Figure 2.Effects of L-carnitine,BAPTA and KN93 on H2 O2-triggered apoptosis of rat cardiomyocytes.Mean ± SD.n=5.*P <0.05 vs control;#P <0.05 vs H2O2 alone.图2 左卡尼汀、BAPTA及KN93对H 2 O2诱导的大鼠心肌细胞凋亡的影响

Figure 3.Effects of L-carnitine,BAPTA and KN93 on H2O2-triggered caspase-3 activation in rat cardiomyocytes.Mean±SD.n=3.*P <0.05 vs control;#P<0.05 vs H2 O2 alone.图3 左卡尼汀、BAPTA及KN93对H 2O2诱导的大鼠心肌细胞内caspase-3活化的影响
3 左卡尼汀、BAPTA及KN93对大鼠心肌细胞内静息钙的影响
与正常组比较,H2O2处理12 h后大鼠心肌细胞内静息钙离子水平显著增加。左卡尼汀和BAPTA均能显著降低H2O2处理组心肌细胞内的静息钙水平。而KN93对H2O2诱导的静息钙增加无显著影响,见图4。

Figure 4.Effects of L-carnitine,BAPTA and KN93 on H2O2-triggered elevation of resting intracellular free calcium concentration([Ca2+]i)in rat cardiomyocytes.Mean±SD.n=120.*P <0.05 vs control;#P <0.05 vs H2O2 alone.图4 左卡尼汀、BAPTA及KN93对H 2 O2诱导的大鼠心肌细胞内静息钙升高的影响
4 左卡尼汀、BAPTA及KN93对大鼠心肌细胞内CaMKII磷酸化的影响
与正常组比较,H2O2处理12 h后大鼠心肌细胞内磷酸化CaMKII(p-CaMKII)水平显著升高。左卡尼汀、BAPTA及KN93预处理不同程度抑制CaMKII的磷酸化,见图5。
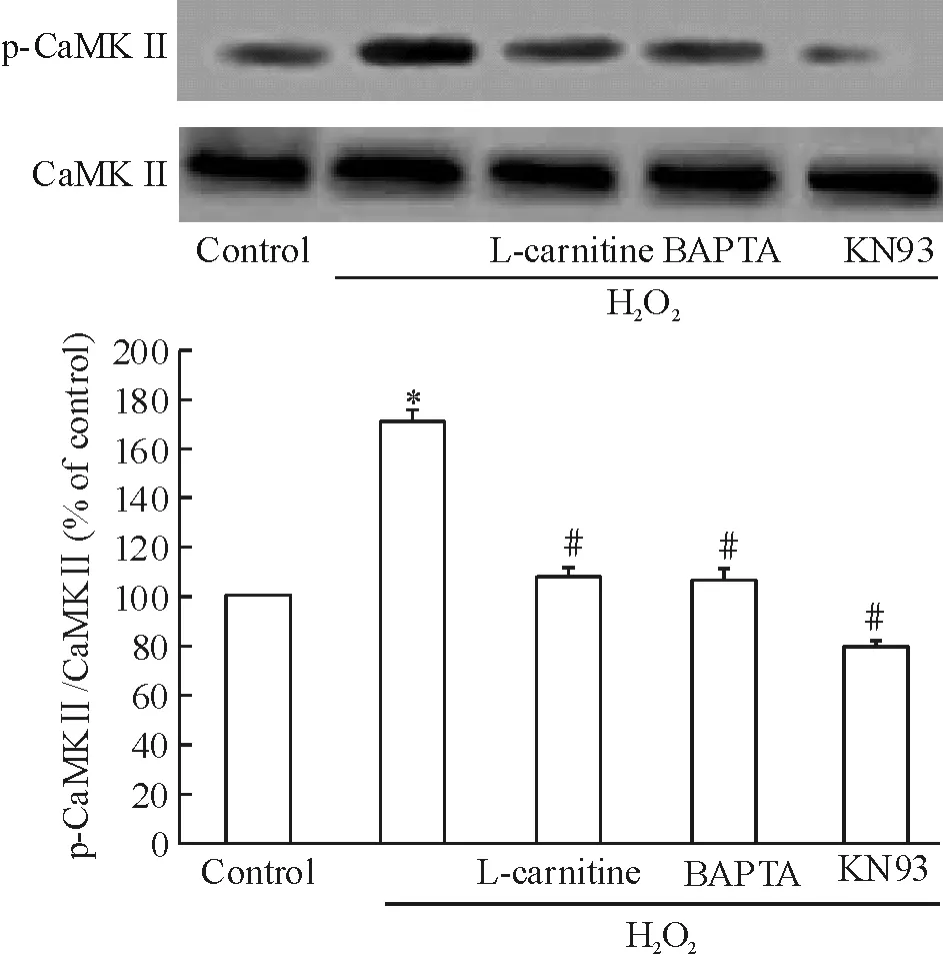
Figure 5.Effects of L-carnitine,BAPTA and KN93 on H2 O2-triggered CaMKII activation in rat cardiomyocytes.Mean±SD.n=3.*P <0.05 vs control;#P <0.05 vs H2 O2 alone.图5 左卡尼汀、BAPTA及KN93对H 2 O 2诱导的大鼠心肌细胞内CaMKII活化的影响
讨 论
氧化应激系指细胞中的促氧化与抗氧化系统失衡,导致氧化作用过度增强而引起的一种细胞内的紊乱状态。心肌受到损伤后,活性氧与自由基生成大大增加。已经证实,氧化应激在心肌缺血再灌注损伤、充血性心力衰竭及乙醛中毒等病理过程中发生的细胞凋亡有着密不可分的关系[6-8]。而应用抗氧化剂往往能够抑制该过程[9]。
左卡尼汀具有显著的抗氧化活性。我们之前的研究也发现左卡尼汀能显著改善活性氧物质H2O2诱导的心肌细胞内氧化应激及凋亡。利用钙瞬变技术,我们认为该抗凋亡作用可能与左卡尼汀改善细胞内的钙紊乱有关[5]。由于上述钙离子测定是在急性条件下进行的(H2O2最长刺激5 min),用其解释慢性刺激后的凋亡尚具有一定的局限性。为此,为进一步证实左卡尼汀的抗凋亡活性确实与其抑制细胞内Ca2+超载有关,我们在本实验中运用了激光共聚焦技术,同步测量细胞凋亡与细胞内静息Ca2+浓度(H2O2刺激12 h)。在本研究中我们发现,BAPTA(Ca2+螯合剂)预处理可明显抑制H2O2刺激诱导的心肌细胞凋亡,表明Ca2+超载是H2O2诱发心肌细胞凋亡的重要机制。而左卡尼汀在抑制细胞凋亡的同时,还可显著降低心肌细胞内的静息钙水平。充分说明,纠正心肌细胞内钙超载是左卡尼汀发挥其抗H2O2所致细胞凋亡的重要机制。
作为细胞内重要的钙离子调节蛋白,CaMKII活化在心肌细胞凋亡中起着至关重要的作用[10]。在本实验中用特异性抑制剂KN93阻断CaMKII后,H2O2诱发心肌细胞凋亡明显降低。说明CaMKII活化也参与了H2O2诱导的心肌凋亡。而且,左卡尼汀预处理能显著降低CaMKII的磷酸化(活化),表明左卡尼汀的抗凋亡活性可能与其抑制CaMKII的活化有关。
目前共发现α、β、γ及δ亚型的CaMKII,而心肌中最主要的类型属δ亚型[10]。而且在δ亚型的13种剪接变异体中,只有 δB和 δC在心肌中表达[11]。虽然在本研究中我们不能确定是δ亚型哪个变异体参与了H2O2诱导的凋亡。但已有研究提示,在氧化应激时,δB和δC心肌中起着截然相反的作用:δB抑制凋亡,而δC则促进凋亡[12]。所以很可能是 δC活化介导了H2O2诱导的心肌凋亡。
总之,本研究证实左卡尼汀对H2O2诱发心肌细胞凋亡具有显著的抑制作用,其作用机制可能与其减轻细胞内钙超载和抑制CaMKII活化有关。

